- 1.03 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
栏目索引
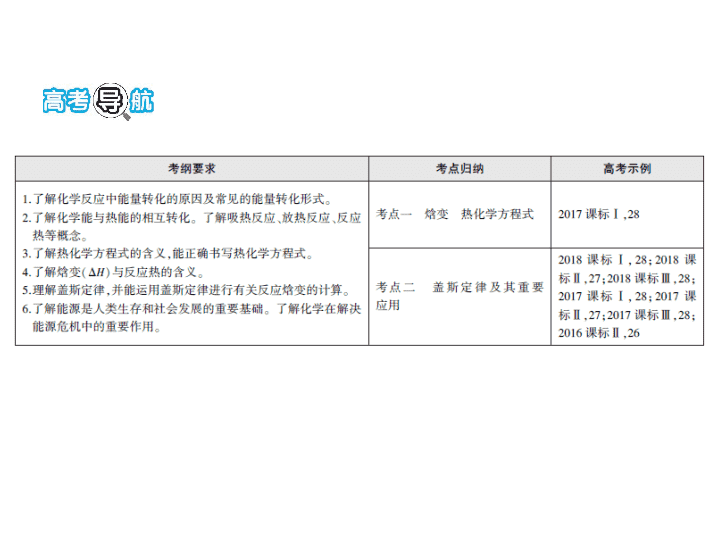
高考导航
专题五 化学能与热能
栏目索引
高考导航
高考导航
栏目索引
高考导航
总纲目录
总纲目录
考点一 焓变 热化学方程式
考点二 盖斯定律及反应热的大小比较和计算
栏目索引
高考导航
考点一
考点一 焓变 热化学方程式
1.从三个角度理解化学反应产生热效应的原因
栏目索引
高考导航
考点一
(1)从宏观角度分析:
ΔH= 的总能量- 的总能量
(2)从微观角度分析:
ΔH= 的键能总和- 的键能总和
(3)从活化能角度分析:
ΔH= 的活化能- 的活化能
答案 < > (1)生成物 反应物 (2)反应物 生成物 (3)正
反应 逆反应
栏目索引
高考导航
考点一
2.物质具有的能量、稳定性和键能的关系
物质所具有的能量越低,物质越 ,键能 ,断裂化
学键所需能量越 ,形成化学键所释放的能量也 。
答案 稳定 越大 多 多
栏目索引
高考导航
考点一
3.书写热化学方程式的“六大”要点
(1)注意ΔH的符号和单位。
若为放热反应,ΔH ;若为吸热反应,ΔH 。ΔH的
常用单位为 。
(2)注意焓变的测定条件。
绝大多数ΔH是在 下测定的,此时可不注明温度
和压强。
(3)注意热化学方程式中的化学计量数。
热化学方程式中的化学计量数仅表示相应物质的 。
(4)注意物质的聚集状态。
气体用“ ”,液体用“ ”,固体用“
”,溶液用“ ”。
栏目索引
高考导航
考点一
(5)注意ΔH的数值与符号。
由于ΔH与反应完成时各物质的量有关,如果化学计量数
,则ΔH也要 。互为逆反应的焓变数值 ,但符
号 。
(6)可逆反应的焓变。
对于可逆反应的焓变(ΔH)是指 时的焓变。
答案 (1)<0 >0 kJ·mol-1
(2)25 ℃、101 kPa (3)物质的量 (4)g l s aq
(5)加倍 加倍 相同 相反 (6)完全反应
栏目索引
高考导航
考点一
题组一 化学反应能量变化的图像分析
1.(2018河北邢台期末)H2S的分解反应是一个可逆反应,其能量与
反应过程的关系如图所示,下列有关说法中正确的是 ( )
栏目索引
高考导航
考点一
A.正反应的活化能大于逆反应的活化能
B.若减小体系的压强,则该反应的焓变将增大
C.升高温度,化学反应速率加快,H2S的平衡转化率减小
D.向密闭容器中充入1 mol H2S充分反应,吸收84.9 kJ的热量
答案 A 由题图可知,该反应是吸热反应,所以正反应的活化能
大于逆反应的活化能,A项正确;压强的改变能影响反应的速率和
平衡的移动,但不影响反应的焓变,B项错误;升高温度,化学反应
速率加快,正反应是吸热反应,平衡向右移动,使H2S的转化率增大,
C项错误;向密闭容器中充入1 mol H2S充分反应,该反应是可逆反
应,1 mol H2S不能完全分解,所以吸收的热量小于84.9 kJ,D项错误。
栏目索引
高考导航
考点一
2.(2018广西重点高中联考)BeCl2是有机反应的催化剂,铍和氯气
反应的能量变化如图所示。下列说法正确的是 ( )
A.E2是正反应的活化能 B.该反应的ΔH<0
C.加入催化剂,ΔH减小 D.ΔH=E2-E1
栏目索引
高考导航
考点一
答案 B A项,E1是正反应活化能,E2是逆反应活化能,错误;B项,
该反应是放热反应,正确;C项,加入催化剂,E1和E2减小,不改变ΔH,
错误;D项,ΔH=E1-E2,错误。
栏目索引
高考导航
考点一
3.由反应物X转化为Y和Z的能量变化如图所示。下列说法正确
的是 ( )
A.由X→Y反应的ΔH=E5-E2
B.由X→Z反应的ΔH>0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
栏目索引
高考导航
考点一
答案 C A项,根据化学反应的实质,反应X→Y的ΔH=E3-E2,错
误;B项,由图可知,反应物的总能量高于生成物的总能量,即反应X
→Z的ΔH<0,错误;C项,根据化学反应2X(g) 3Y(g),该反应是
气体分子数增加的可逆反应,降低压强,平衡正向移动,有利于提
高Y的产率,正确;D项,该反应为放热反应,升高温度,平衡逆向移
动,Z的产率降低,错误。
栏目索引
高考导航
考点一
归纳总结
解答能量变化图像题的“4关键”
1.某一反应物能量和某一生成物能量的相对大小不能决定反应
是吸热还是放热。
2.注意活化能在图示(如下图)中的意义。
栏目索引
高考导航
考点一
(1)从反应物至最高点的能量数值表示正反应的活化能,即E1。
(2)从最高点至生成物的能量数值表示逆反应的活化能,即E2。
3.催化剂只影响正、逆反应的活化能,而不影响反应的ΔH。
4.涉及反应热的有关计算时,要注意图示中反应物和生成物的物
质的量。
栏目索引
高考导航
考点一
题组二 热化学方程式的正误判断及书写
4.下列热化学方程式书写正确的是 ( )
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g) CO2(g) ΔH=+393.5 kJ·mol-1
答案 B A项,未注明各物质的聚集状态,错误;C项,ΔH的单位错
误,应为kJ·mol-1;D项,碳的燃烧为放热反应,ΔH<0,错误。
栏目索引
高考导航
考点一
5.根据信息,写出下列反应的热化学方程式。
(1)Si与Cl2反应生成1 mol Si的最高价化合物,恢复至室温,放热68
7 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃。该反应的
热化学方程式为 。
(2)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃,101 kPa
下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ。该反应的热化学方程
式为 。
(3)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为16
7 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8
kJ。该反应的热化学方程式为 。
栏目索引
高考导航
考点一
(4)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和
液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃
的热化学方程式为 。
答案 (1)Si(s)+2Cl2(g) SiCl4(l) ΔH=-687 kJ·mol-1
(2)NaBH4(s)+2H2O(l) NaBO2(s)+4H2(g) ΔH=-216.0
kJ·mol-1
(3)AX3(l)+X2(g) AX5(s) ΔH=-123.8 kJ·mol-1
(4)SiH4(g)+2O2(g) SiO2(s)+2H2O(l) ΔH=-1 427.2 kJ·mol-1
栏目索引
高考导航
考点一
归纳总结
热化学方程式的书写及正误判断的思维模式
1.书写一般分三步。
栏目索引
高考导航
考点一
2.正误判断要做到“五审”。
栏目索引
高考导航
考点二
考点二 盖斯定律及反应热的大小比较和计算
1.盖斯定律的理解
答案 ΔH1 aΔH2 -ΔH2 ΔH1+ΔH2
栏目索引
高考导航
考点二
2.反应热大小的比较
(1)利用盖斯定律比较,如:
依据盖斯定律得ΔH1=ΔH2+ΔH3,因ΔH1<0,ΔH2<0,ΔH3<0,所以ΔH1
ΔH2。
(2)同一反应的生成物状态不同时,如:
A(g)+B(g) C(g) ΔH1
A(g)+B(g) C(l) ΔH2
则ΔH1 ΔH2。
栏目索引
高考导航
考点二
(3)同一反应物状态不同时,如:
A(s)+B(g) C(g) ΔH1
A(g)+B(g) C(g) ΔH2
则ΔH1 ΔH2。
答案 (1)< (2)> (3)>
栏目索引
高考导航
考点二
题组一 盖斯定律的重要应用
1.(2017北京理综,26节选)氯化过程:TiO2与Cl2难以直接反应,加碳
生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g) TiCl4(g)+O2(g) ΔH1=+175.4
kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH2=-220.9 kJ·mol-1
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:
。答案 TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g)
ΔH=-45.5 kJ·mol-1
解析 将已知的两个热化学方程式相加,即可得出答案。
栏目索引
高考导航
考点二
2.(2016课标Ⅱ,26节选)联氨(又称肼,N2H4,无色液体)是一种应用
广泛的化工原料,可用作火箭燃料。回答下列问题:
①2O2(g)+N2(g) N2O4(l) ΔH1
②N2(g)+2H2(g) N2H4(l) ΔH2
③O2(g)+2H2(g) 2H2O(g) ΔH3
④2N2H4(l)+N2O4(l) 3N2(g)+4H2O(g) ΔH4=-1 048.9 kJ·mol-1
上述反应热效应之间的关系式为ΔH4= 。
答案 2ΔH3-2ΔH2-ΔH1
解析 根据盖斯定律,由2×(③-②)-①可得④,故ΔH4=2ΔH3-2ΔH2-
ΔH1。
栏目索引
高考导航
考点二归纳总结
利用盖斯定律书写热化学方程式和计算反应热的步骤
第一步:写,书写待求的反应方程式。
第二步:看,看待求的反应方程式中的反应物和生成物在已知方程
式中的位置,如果位置相同,即都是反应物或都是生成物,则用加
法,即加ΔH ;如果位置相反,则用减法,即减ΔH。
第三步:调,根据待求方程式中的反应物和生成物的系数,观察同
一物质前的化学计量数是否一致,若不一致,则在相应的物质前乘
以或除以一定数字,将其调整,与待求的方程式中的反应物和生成
物的化学计量数一致。
第四步:查,有时往往会出现一些干扰的方程式,我们最好检验上
述分析正确与否。
第五步:和,将已知方程式变形后的ΔH相加,计算得出新的ΔH。
栏目索引
高考导航
考点二
题组二 反应热的比较和计算
3.(2018湖南怀化联考)下列四组热化学方程式中,ΔH1>ΔH2的是
( )
①C(s)+O2(g) CO2(g) ΔH1
C(s)+ O2(g) CO(g) ΔH2
②S(s)+O2(g) SO2(g) ΔH1
S(g)+O2(g) SO2(g) ΔH2
③CaCO3(s) CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l) Ca(OH)2(s) ΔH2
栏目索引
高考导航
考点二
④HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l) ΔH1
HCl(aq)+NH3·H2O(aq) NH4Cl(aq)+H2O(l) ΔH2
A.①③ B.①④ C.②③ D.②④
答案 C
①中碳完全燃烧放热多,放热越多,ΔH越小,即ΔH1<ΔH2;
②中同质量的气态硫燃烧比固态硫燃烧放热多,放热越多,ΔH越
小,即ΔH1>ΔH2;③中碳酸钙分解吸热,氧化钙与水反应放热,则ΔH
1>ΔH2;④中由于弱电解质电离吸热,所以盐酸和强碱反应放热多,
放热越多,ΔH越小,即ΔH1<ΔH2。
栏目索引
高考导航
考点二
4.(2018福建百所重点校联考)用CrO3作催化剂,CO2重整C2H6制乙
烯的反应过程如下:
C2H6(g) C2H4(g)+H2(g) ΔH1
3H2(g)+2CrO3(s) 3H2O(g)+Cr2O3(s) ΔH2
Cr2O3(s)+3CO2(g) 3CO(g)+2CrO3(s) ΔH3
(1)反应C2H6(g)+CO2(g) C2H4(g)+CO(g)+H2O(g)的ΔH=
(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)已知部分化学键的键能数据如下表所示,则ΔH1= kJ·mol-1
。
栏目索引
高考导航
考点二
答案 (1)(3ΔH1+ΔH2+ΔH3)/3 (2)+123
解析 (1)将题述热化学方程式分别用a、b、c表示,(3a+b+c)/3得:
C2H6(g)+CO2(g) C2H4(g)+CO2(g)+H2O(g) ΔH=
。
(2)ΔH=反应物键能之和-生成物键能之和,则ΔH1=(6×413+348-4×
413-615-436) kJ·mol-1=+123 kJ·mol-1。
栏目索引
高考导航
考点二
5.(2018天津理综,10节选)CO2是一种廉价的碳资源,其综合利用具
有重要意义。回答下列问题:
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+CO2(g) 2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH= 。分别在V L恒温密闭容器A
(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气
体。两容器中反应达平衡后放出或吸收的热量较多的是
(填“A”或“B”)。。此反应优选温度为900 ℃的原因 。
栏目索引
高考导航
考点二
则该反应的ΔH= 。分别在V L恒温密闭容器A
(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气
体。两容器中反应达平衡后放出或吸收的热量较多的是
(填“A”或“B”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和
H2产率的影响如图所示。此反应优选温度为900 ℃的原因是
。
栏目索引
高考导航
考点二
答案 (2)①+120 kJ·mol-1 B
②900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能
耗升高,经济效益降低
解析 (2)①由已知键能数据知,反应的ΔH=4×413 kJ·mol-1+2×745
kJ·mol-1-(2×1 075 kJ·mol-1+2×436 kJ·mol-1)=+120 kJ·mol-1;已知正
反应是气体分子数增大的吸热反应,A(恒容)与B(恒压,容积可变)
相比,B中压强小于A,减压平衡正向移动,则B容器中反应达到平
衡后吸收的热量较多。②观察图像知,900 ℃时,合成气产率已经
较高,再升高温度产率增幅不大,但能耗升高,经济效益降低,故此
反应优选温度为900 ℃。
栏目索引
高考导航
考点二
归纳总结
原子晶体:1 mol金刚石中含2 mol C—C键,1 mol硅中含2 mol Si—
Si键,1 mol SiO2晶体中含4 mol Si—O键;分子晶体:1 mol P4中含
6 mol P—P键,1 mol P4O10(即五氧化二磷)中含有12 mol P—O键、
4 mol P O键,1 mol C2H6中含有6 mol C—H键和 1 mol C—C
键。
栏目索引
高考导航
考点二
1.(2018课标Ⅰ,28节选)①已知:2N2O5(g)
2N2O4(g)+O2(g)
ΔH1=-4.4 kJ·mol-1
2NO2(g) N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g) 2NO2(g)+ O2(g)的ΔH= kJ·mol-1。答案 ①53.1
解析 ①2N2O5(g) 2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-
1 a
2NO2(g) N2O4(g) ΔH2=-55.3 kJ·mol-1 b
根据盖斯定律,由 -b可得:N2O5(g)
2NO2(g)+ O2(g) ΔH=53.
1 kJ·mol-1。
栏目索引
高考导航
考点二
2.(2018课标Ⅱ,27节选)CH4-CO2催化重整反应为:CH4(g)+CO2(g)
2CO(g)+2H2(g)。
已知:C(s)+2H2(g) CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g) CO2(g) ΔH=-394 kJ·mol-1
C(s)+ O2(g) CO(g) ΔH=-111 kJ·mol-1
该催化重整反应的ΔH= kJ·mol-1。
栏目索引
高考导航
考点二
答案 247
解析 C(s)+2H2(g) CH4(g) ΔH=-75 kJ·mol-1 ①
C(s)+O2(g) CO2(g) ΔH=-394 kJ·mol-1 ②
C(s)+ O2(g) CO(g) ΔH=-111 kJ·mol-1 ③
运用盖斯定律,③×2-①-②可得CH4(g)+CO2(g) 2CO(g)+2H2
(g) ΔH=[(-111×2)-(-75)-(-394)] kJ·mol-1=247 kJ·mol-1。
栏目索引
高考导航
考点二
3.(2018课标Ⅲ,28节选)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g) SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g) SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1
。
答案 114
解析 由盖斯定律可知ΔH=3ΔH1+ΔH2=3×48 kJ·mol-1-30 kJ·mol-1=
114 kJ·mol-1。
栏目索引
高考导航
考点二
4.(2017课标Ⅰ,28节选)下图是通过热化学循环在较低温度下由
水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为
、
,制得等量H2所需能量较少的是 。
栏目索引
高考导航
考点二
答案 H2O(l) H2(g)+ O2(g) ΔH=286 kJ·mol-1
H2S(g)
H2(g)+S(s) ΔH=20 kJ·mol-1 系统(Ⅱ)解析 将系统(Ⅰ)、(Ⅱ)中的三个热化学方程式均直接相加即可
得到答案。
栏目索引
高考导航
考点二
5.(1)(2017课标Ⅱ,27节选)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热
化学方程式如下:
反应①的ΔH1为 kJ·mol-1。
(2)(2017课标Ⅲ,28节选)已知:
As(s)+ H2(g)+2O2(g) H3AsO4(s) ΔH1
栏目索引
高考导航
考点二
H2(g)+ O2(g) H2O(l) ΔH2
2As(s)+ O2(g) As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l) 2H3AsO4(s)的ΔH= 。
答案 (1)123 (2)2ΔH1-3ΔH2-ΔH3
解析 (1)结合已知信息运用盖斯定律,由②-③可得①,故 ΔH1=[-
119-(-242)] kJ·mol-1=123 kJ·mol-1。(2)结合题给信息,根据盖斯定
律计算得ΔH=2ΔH1-3ΔH2-ΔH3。