- 23.13 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
北京市朝阳区高三年级学业水平等级性考试练习一
化学试题
(考试时间:90 分钟 满分:100 分) 2020.4
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mn 55
第一部分
每小题只有一个选项符合题意,每小题 3 分,共 14 道小题,共 42 分。
1.下列家庭常用消毒剂的有效成分属于无机物的是
A B C D
家庭
常用
消毒剂
有效
成分 对氯间二甲苯酚 乙醇 次氯酸钠 过氧乙酸
2.下列化学用语不正确...的是
A.羟基的电子式: B.乙烯的球棍模型:
C.Cl 的原子结构示意图: D.乙醇的分子式:C2H6O
3.下列说法不正确...的是
A.氨基酸能与酸、碱反应生成盐
B.葡萄糖和蔗糖的官能团种类完全相同
C.乙醇和乙醛可用银氨溶液进行鉴别
D.氢键既影响有机物的沸点,又影响有机物的空间结构
4.用 NA 代表阿伏伽德罗常数的数值。下列说法正确的是
A.7.8 g Na2O2 中含有的离子数为 0.3 NA
B.1 mol NO2 与水完全反应转移的电子数为 NA
C.标准状况下,22.4 L NH3 含有的质子数为 5NA
D.1 L 0.1mol·L-1 NH4Cl 溶液中含有的 NH4+数为 0.1NA
5.镓(31Ga)是化学史上第一个先从理论上被预言,后在自然界被发现的元素。Ga 与 K 同周期。下
列说法不.正确..的是
A.Ga 在周期表中的位置:第 4 周期第 IIIA 族
B.原子半径:Ga > K
C.中子数为 36 的 Ga 的核素:3167Ga
D.最高价氧化物对应水化物的碱性:Ga(OH)3>Al(OH)3
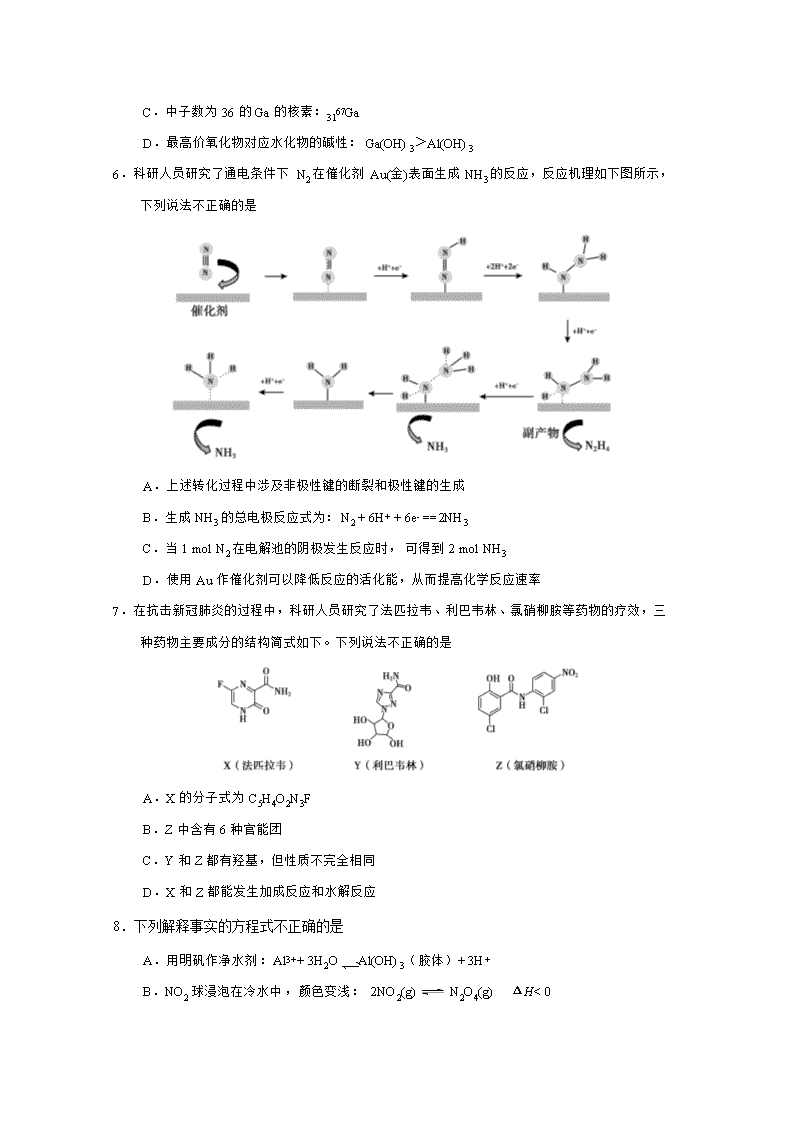
6.科研人员研究了通电条件下 N2 在催化剂 Au(金)表面生成 NH3 的反应,反应机理如下图所示,
下列说法不正确...的是
A.上述转化过程中涉及非极性键的断裂和极性键的生成
B.生成 NH3 的总电极反应式为:N2 + 6H+ + 6e- ==2NH3
C.当 1 mol N2 在电解池的阴极发生反应时,可得到 2 mol NH3
D.使用 Au 作催化剂可以降低反应的活化能,从而提高化学反应速率
7.在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三
种药物主要成分的结构简式如下。下列说法不.正确..的是
A.X 的分子式为 C5H4O2N3F
B.Z 中含有 6 种官能团
C.Y 和 Z 都有羟基,但性质不完全相同
D.X 和 Z 都能发生加成反应和水解反应
8.下列解释事实的方程式不正确...的是
A.用明矾作净水剂:Al3+ + 3H2O Al(OH)3(胶体)+ 3H+
B.NO2 球浸泡在冷水中,颜色变浅: 2NO2(g) N2O4(g) ΔH< 0
C.用醋酸除去水垢:2H++CaCO3 === Ca2++CO2↑+H2O
D.CO2 通入苯酚钠溶液中出现浑浊:
9.下列物质的实验室制取、检验及分离方法不合理...的是(夹持装置已略去,气密性已检验)。
A.制取并检验氨气 B.制取并检验 SO2 气体
C.制取并提纯乙酸乙酯 D.制取并检验乙炔
10.疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和 C2)、电源适配器和水瓶组
装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电
一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备
成功。关于该实验的说法不.正确..的是
A.C1 电极产生气泡原因:2H2O+2e-=== H2↑+2OH-
B.自制消毒剂的总反应为:NaCl+H2O === NaClO+H2↑
C.可以用两根铁钉代替铅笔芯完成实验
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
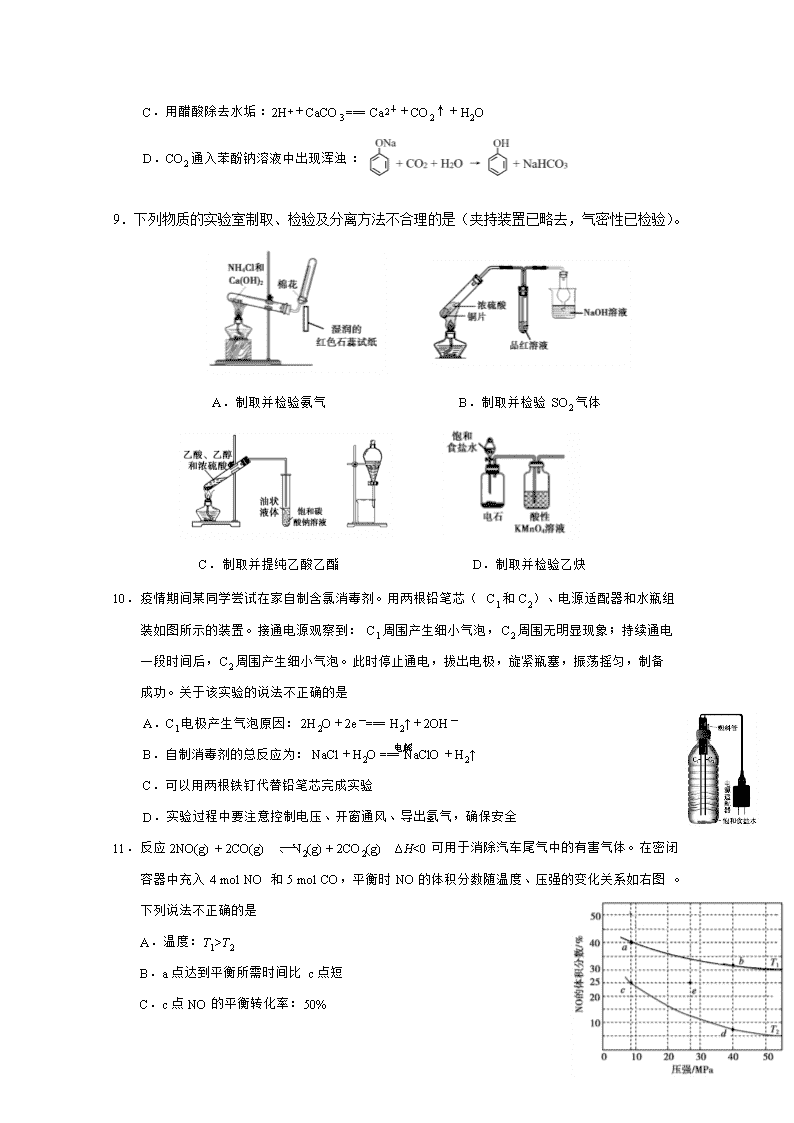
11.反应 2NO(g) + 2CO(g) N2(g) + 2CO2(g) ΔH<0 可用于消除汽车尾气中的有害气体。在密闭
容器中充入 4 mol NO 和 5 mol CO,平衡时 NO 的体积分数随温度、压强的变化关系如右图。
下列说法不.正确..的是
A.温度:T1>T2
B.a 点达到平衡所需时间比 c 点短
C.c 点 NO 的平衡转化率:50%
电解
D.若在 e 点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图
中的 c 点
12.维纶(聚乙烯醇缩甲醛纤维)可用于生产服装、绳索等。其合成路线如下:
下列说法不正确...的是
A.反应①是加聚反应
B.高分子 A 的链节中只含有一种官能团
C.通过质谱法测定高分子 B 的平均相对分子质量,可得其聚合度
D.反应③的化学方程式为:
13.25℃时,用一定浓度 NaOH 溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如图所示,
其中 b 点为恰好反应点。下列说法不正确...的是
A.溶液的导电能力与离子种类和浓度有关
B.b 点溶液的 pH=7
C.a→c 过程中,n(CH3COO-)不断增大
D.c 点的混合溶液中,c(Na+)>c(OH−)>c(CH3COO-)
14.用下图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系
以及溶解氧随时间变化关系的曲线如下。
下列说法不正确...的是
A.压强增大主要是因为产生了 H2
B.整个过程中,负极电极反应式为:Fe–2e- = Fe2+
C.pH= 4.0 时,不发生析氢腐蚀,只发生吸氧腐蚀
D.pH= 2.0 时,正极电极反应式为:2H+ + 2e- = H2↑ 和 O2 + 4e- + 4H+ = 2H2O
第二部分
本部分共 5 题,共 58 分。
15.(8 分)目前生物质能研究的方向之一是替代化石能源制备有机化工产品。
(1)化石原料合成丙烯腈(CH2=CH—CN):
写出反应 ii 的热化学方程式:______。
(2)生物质原料合成丙烯腈:
① 写出 ii 的化学方程式:_______。
② 丙烯腈与 1,3-丁二烯共聚生产的丁腈橡胶是现代工业重要的橡胶。写出合成丁腈
橡胶的化学方程式:______。
(3)生物质脂肪酸脱羧制备长链烷烃:H2 气氛,TiO2/Pt 为催化剂,光催化长链脂肪酸转化
为长链烷烃机理示意图如下:
① 油脂酸性水解可得高级脂肪酸和______(写结构简式)。
② TiO2 界面发生的电极反应式为______。
16.(10 分)Na2S2O3 应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)Na2S2O3 的实验室制法:装置图如下(加热和夹持装置略):
已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S == Na2S2O3
① 甲中发生反应的化学方程式为______。
② 实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的 Na2S2O3。一段时
间后,乙中再次出现少量浑浊,此时须立刻停止通入 SO2。结合离子方程式解释
此时必须立刻停止通入 SO2 的原因:______。
③ 丙中,NaOH 溶液吸收的气体可能有______。
(2)实际工业生产中制得的 Na2S2O3 溶液中
常混有少量 Na2SO3,结合溶解度曲线(右图),
获得 Na2S2O3•5H2O 的方法是______。
(3)Na2S2O3 的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
已知:I. ;II. Cu2+在碱性较强时受热会生成 CuO 沉淀。
① 将金矿石浸泡在 Na2S2O3、Cu(NH3)42+的混合溶液中,并通入 O2。浸金反应的
原理为:i. Cu(NH3)42+ + Au + 2S2O32− Cu(NH3)2+ + Au(S2O3)23−+ 2NH3
ii. 4Cu(NH3)2+ + 8NH3+ O2 + 2H2O == 4Cu(NH3)42+ + 4OH−
浸金过程 Cu(NH3)42+起到催化剂的作用,
浸金总反应的离子方程式为:______。
② 一定温度下,相同时间金的浸出率随体系
pH 变化曲线如右图,解释 pH>10.5 时,
金的浸出率降低的可能原因_______。(写出 2 点即可)
△
17.(14 分)抗肿瘤药物 7–氟喹啉衍生物的前体 Q 的合成路线如下:
(1)A 属于芳香烃,A 的名称是_______。
(2)B→D 的化学方程式是_______。
(3)D→E 的反应类型是_______。
(4)G 的结构简式是_______。
(5)下列关于 M 的说法正确的是_______(填序号)。
a.M 含有两种不同的官能团 b.M 存在顺反异构体
c.M 和 G 能用 2Br 的 4CCl 溶液鉴别 d.M 能与 NaOH 溶液反应
(6)已知:G + J → M + 2CH3CH2OH。J 的结构简式是_________。
(7)L 与 M 反应生成 Q 的过程如下:
已知:上述异构化反应中,只存在氢原子和不饱和键的位置变化。
Y 的分子中含有两个六元环。Y 的结构简式是________。
18.(12 分)无水氯化锰 2MnCl 在电子技术和精细化工领域有重要应用。一种由粗锰粉
(主要杂质为 Fe、Ni、Pb 等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的 pH 约为 5,测定离子的初始浓度。静置一段时间
后锰粉仍略有剩余,过滤;
II.向 I 的滤液中加入一定量盐酸,再加入 2 2H O 溶液,充分反应后加入 3MnCO 固体调
节溶液的 pH 约为 5,过滤;
III.向 II 的滤液中通入 2H S 气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水 MnCl2。
各步骤中对杂质离子的去除情况
2+Fe 2+Ni 2+Pb
初始浓度/mg·L–1 21.02 4.95 5.86
步骤 I 后/ mg·L–1 12.85 3.80 3.39
步骤 II 后/ mg·L–1 0.25 3.76 3.38
步骤 III 后/ mg·L–1 0.10(达标) 3.19(未达标) 0.12(达标)
已知:金属活动性 Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤 I 中:
① Fe2+浓度降低,滤渣中存在 3Fe OH 。结合离子方程式解释原因:_______。
② Pb2+浓度降低,分析步骤 I 中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步骤 II 中:
① 2 2H O 酸性溶液的作用:_______。
② 结合离子方程式说明 MnCO3 的作用: _______。
(4)步骤 III 通入 H2S 后, Ni2+不达标而 2+Pb 达标。推测溶解度:PbS_____NiS(填“>”
或“<”)。
(5)测定无水 2MnCl 的含量:将 a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍
过量 4 3NH NO ,使 2Mn 氧化为 3Mn 。待充分反应后持续加热一段时间,冷却后用 b
mol/L 硫酸亚铁铵 4 42 2NH Fe SO 滴定 3Mn ,消耗 c mL 硫酸亚铁铵。
(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
① 样品中 MnCl2 的质量分数是_____(已知:MnCl2 的摩尔质量是 126 g·mol-1)。
② “持续加热”的目的是使过量的 4 3NH NO 分解。若不加热,测定结果会______
(填“偏高”、“偏低”或“无影响”)。
19.(14 分)学习小组探究 AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
实验 方案和现象
ⅰ 加入 1mL 蒸馏水,再滴加 1 滴品红溶液,品红溶液较快褪色
ⅱ
加入少量 Ag2O 固体,产生白色沉淀 a。再加入 1mL 蒸馏水和
1 滴品红溶液,品红溶液褪色比 i 快
ⅲ
加入 1mL 较浓 AgNO3 溶液,产生白色沉淀 b。再滴加 1 滴品红
溶液,品红溶液褪色比 i 慢
(1)用离子方程式表示 i 中品红溶液褪色的原因:______。
(2)经检验,ii 中的白色沉淀 a 是 AgCl。产生 AgCl 的化学方程式是_______。
(3)ⅰ是 iii 的对比实验,目的是排除 iii 中______造成的影响。
(4)研究白色沉淀 b 的成分。进行实验 iv(按实验 iii 的方案再次得到白色沉淀 b,过
滤、洗涤,置于试管中):
① 设计对比实验证实白色沉淀 b 不只含有 AgCl,实验方案和现象是_______。
② FeCl2 溶液的作用是_______。
由此判断,白色沉淀 b 可能含有 AgClO。
(5)进一步研究白色沉淀 b 和实验 iii 品红溶液褪色慢的原因,进行实验 v:
① 结合离子方程式解释加入饱和 NaCl 溶液的目的:_______。
② 推测品红溶液褪色的速率:实验 iii 比实验 v______(填“快”或 “慢”)。
北京市朝阳区高三年级学业水平等级性考试练习一
化学试题参考答案 2020.4
(考试时间:90 分钟 满分:100 分 )
第一部分
每小题只有一个选项符合题意。14 个小题,每小题 3 分,共 42 分
题号 1 2 3 4 5 6 7 8 9 10
答案 C A B A B C B C D C
题号 11 12 13 14
答案 D D B C
第二部分
15.(8 分)
16.(10 分)
(1) ① Na2SO3 +H2SO4==Na2SO4+ SO2 ↑+ H2O
② 过量的 SO2 溶于水使溶液酸性增强,S2O32-+2H2SO3 ==S↓+ SO2↑+ H2O +2HSO3-
或 S2O32- +2H+== S↓+ SO2↑+ H2O。
③ SO2(H2S)、CO2
(2)将溶液蒸发浓缩、(趁热过滤)、降温结晶、过滤。
(3)① 4Au + 8S2O32- + O2 + 2H2O = 4Au(S2O3)23- + 4OH-
② 碱性较强时生成的 CuO 沉淀覆盖在金矿石表面,降低(浸出)反应速率;
pH>10.5 时,部分 Cu(NH3)42+转化成 CuO,降低了 Cu(NH3)42+浓度,降低(浸出)
反应速率;
碱性较强时氧气更易将 S2O32-氧化,降低(浸出)反应速率。
(其它答案合理给分)
17.(14 分)
(1)苯
(2) + Cl2
FeCl3
NO2 NO2Cl
+ HCl
(3)取代反应
(4)CH3CH2O C
O
CH2 C
O
OCH2CH3
(5)c d
(6)CH3CH2O CH
OCH2CH3
OCH2CH3
(7)
F N
H
O
COOCH2CH3
18.(12 分)
(1)Mn + 2HCl == MnCl2 + H2↑
(2)① 空气中的 O2 将部分 Fe2+氧化为 Fe(OH)3 沉淀
4Fe2+ + O2 + 10H2O == 4Fe(OH)3↓+ 8H+
② Pb2+ + Mn == Pb + Mn2+
(3)① 将剩余 Fe2+氧化为 Fe3+
② 调节 pH 使 Fe3+转化为 Fe(OH)3 沉淀除去
(4)<
(5) ①
② 偏高
19.(14 分)
(1)Cl2+H2O H+ + Cl- + HClO
(2)Ag2O + 2Cl2 + 2H2O == 2AgCl + HClO
(3)稀释对溶液颜色
(4)① 用纯净的 AgCl 沉淀代替白色沉淀 b,先滴加盐酸,再滴加 FeCl2 溶液(含 KSCN)
后,溶液不变红。
或: (其他答案合理给分)
② 检验白色沉淀 b 中是否含有氧化性粒子
(5)① AgClO(s) + Cl-(aq) AgCl(s) + ClO-(aq),使白色沉淀 b 中的 ClO-进入上层清液便
于检测
② 慢