- 872.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题讲座七 学考第28题——化学实验基础
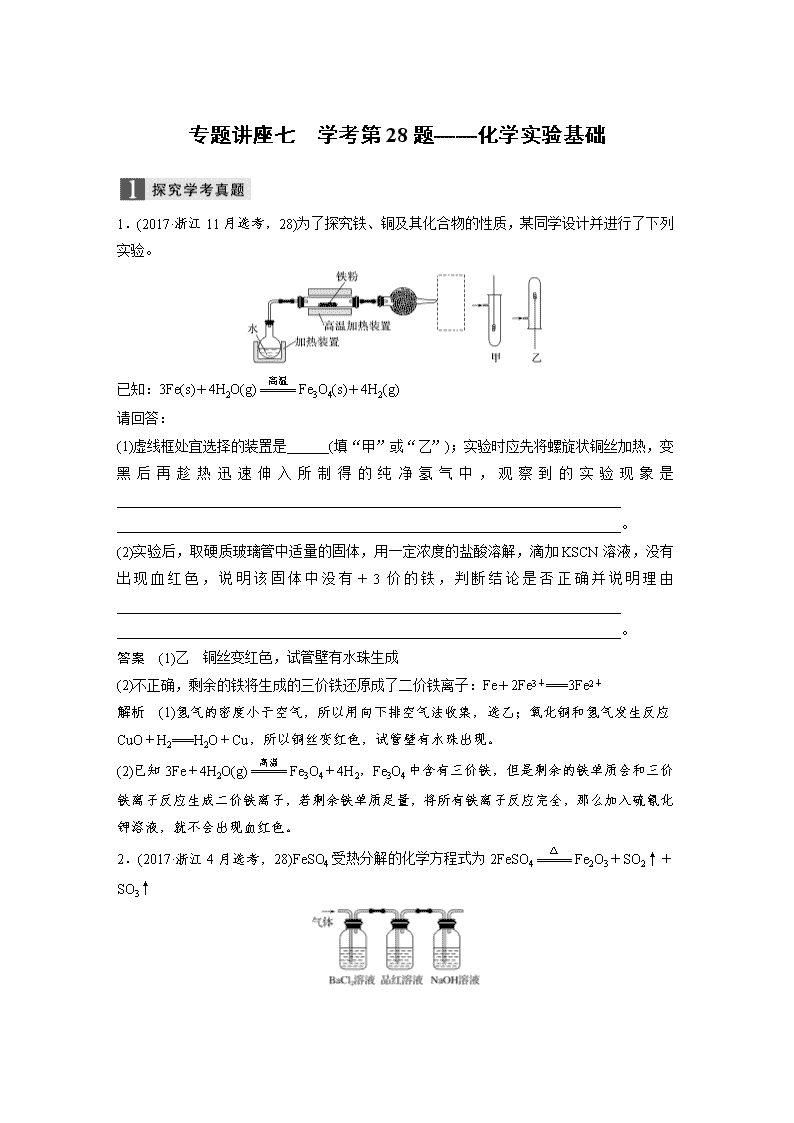
1.(2017·浙江11月选考,28)为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。
已知:3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g)
请回答:
(1)虚线框处宜选择的装置是______(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是________________________________________________________________________
________________________________________________________________________。
(2)实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁,判断结论是否正确并说明理由________________________________________________________________________
________________________________________________________________________。
答案 (1)乙 铜丝变红色,试管壁有水珠生成
(2)不正确,剩余的铁将生成的三价铁还原成了二价铁离子:Fe+2Fe3+===3Fe2+
解析 (1)氢气的密度小于空气,所以用向下排空气法收集,选乙;氧化铜和氢气发生反应CuO+H2===H2O+Cu,所以铜丝变红色,试管壁有水珠出现。
(2)已知3Fe+4H2O(g)Fe3O4+4H2,Fe3O4中含有三价铁,但是剩余的铁单质会和三价铁离子反应生成二价铁离子,若剩余铁单质足量,将所有铁离子反应完全,那么加入硫氰化钾溶液,就不会出现血红色。
2.(2017·浙江4月选考,28)FeSO4受热分解的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑
请回答:
(1)将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2。能说明SO2存在的实验现象是______________________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称量。
(2)设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)________。
答案 (1)品红溶液褪色 过滤
(2)取适量固体,加足量稀盐酸溶解。取反应后溶液滴加KSCN溶液,若显血红色,则有Fe3+(含Fe2O3)
解析 (1)SO2具有漂白性,能说明SO2存在的实验现象是品红溶液褪色;为测定BaSO4沉淀的质量,后续的操作步骤依次为过滤、洗涤、干燥、称量。(2)固体是氧化铁,可以通过检验铁离子验证,即实验方案是向固体成分中加入稀盐酸,取反应后溶液,滴加KSCN溶液,若有血红色出现,则表示溶液中存在Fe3+,产物中有Fe2O3存在。
3.(2016·浙江10月选考,28)用无水Na2CO3固体配制250 mL 0.100 0 mol·L-1的溶液。
请回答:
(1)在配制过程中不必要的玻璃仪器是________。
A.烧杯 B.量筒 C.玻璃棒 D.胶头滴管 E.容量瓶
(2)定容时的操作:当液面接近容量瓶刻度线时,_______________________________________,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(3)下列操作会使配得的Na2CO3溶液浓度偏低的是________。
A.称取相同质量的Na2CO3·10H2O固体进行配制
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
答案 (1)B
(2)用胶头滴管滴加蒸馏水至溶液凹面最低处正好与刻度线相切
(3)AC
解析 (1)在配制一定物质的量浓度溶液时,量筒可用也可不用。
(3)A项,若称取相同质量的Na2CO3·10H2O,造成Na2CO3的质量偏小,所配溶液浓度偏低;B项,定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高;C项,摇匀后,发现液面低于刻度线,若此时再加水,造成溶液体积偏大,所配溶液浓度偏低;D项,未清洗容量瓶,造成溶液有残留,所配溶液浓度偏高。
4.(2016·浙江4月选考,28)为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算。某同学设计的实验装置示意图如下:
请回答:
(1)仪器a的名称是________。
(2)装置B中冰水的作用是_________________________________________________________。
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是________(填字母)。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
答案 (1)干燥管 (2)使水蒸气变成液态的水 (3)AC
解析 该实验的原理:通过称量反应前后C装置(吸收NaHCO3加热分解后的CO2)的增重,来计算样品中NaHCO3的质量,进而计算样品中Na2CO3的质量及其质量分数。(1)仪器a的名称为干燥管。(2)为减少实验误差,需要将装置B中NaHCO3分解产生的水蒸气变为液态水,仅使CO2被装置C中的碱石灰吸收。(3)若样品分解不完全,则被C装置吸收的CO2量减少,即样品中的NaHCO3质量偏低,从而计算求得的样品中Na2CO3质量分数偏高,A正确;装置B、C之间缺少CO2的干燥装置,则使C装置的增重偏大,即样品中NaHCO3的质量偏大,从而Na2CO3的质量分数偏低,B错误;产生CO2的速率太快,没有被碱石灰完全吸收,使C装置的增重偏低,即样品中NaHCO3的质量偏低,从而使Na2CO3的质量分数偏高,C正确;反应完全后停止加热,通入过量的空气,空气中含有部分CO2,使C装置的增重偏高,即样品中NaHCO3的质量偏高,从而Na2CO3的质量分数偏低,D错误。
在本省学考中,第28题作为固定题型的实验题目,涉及的基本实验操作如仪器的连接、气密性检查等,及较高层次的实验方案设计与评价、误差分析等,检测学生的化学学科基本素养。
1.气体制备实验的基本思路
2.重要气体的发生装置
依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:
(1)固体+固体气体
发生装置:
制备气体:O2、NH3、CH4等
(2)固体+液体气体或液体+液体气体
发生装置:
制备气体:Cl2、C2H4等
(3)固体+液体(不加热)―→气体
发生装置:
制备气体:选择合适的药品和装置能制取中学化学中常见的所有气体。
3.气体的除杂方法
除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性、可燃性。除杂原则:(1)不损失主体气体;(2)不引入新的杂质气体;(3)在密闭装置内进行;(4)先除易除的气体。
一般可从以下几个方面考虑:①易溶于水的杂质可用水吸收;②酸性杂质可用碱性物质吸收;③碱性杂质可用酸性物质吸收;④水分可用干燥剂吸收;⑤能与杂质反应生成沉淀或可溶性的物质,也可用作吸收剂。
4.气体干燥净化装置
类型
液态干燥剂
固态干燥剂
固态干燥剂
固体加热
装置
Ⅰ
Ⅱ
Ⅲ
Ⅳ
常见干燥剂
浓H2SO4(酸性、强氧化性)
无水氯化钙(中性)
碱石灰(碱性)
除杂试剂Cu、CuO、Mg等
当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。
5.气体的收集方法
收集方法
收集气体的类型
收集装置
可收集的气体(举例)
排水法
难溶于水或微溶于水,又不与水反应的气体
O2、H2、Cl2(饱和NaCl溶液)、CO2(饱和NaHCO3溶液)、CO等
排
空
气
法
向上排空气法
密度大于空气且不与空气中成分反应
Cl2、SO2、CO2等
向下排空气法
密度小于空气且不与空气中的成分反应
H2、NH3等
6.尾气处理的原因和方法
(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。
(2)处理方法:一般根据气体的相关性质,使其转换为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施。
7.常见气体的检验
(1)可燃性气体的检验
(2)酸性气体的检验
(3)强氧化性气体的检验
8.根据原理选择装置
有以下三种实验装置
A
B
C
用下列实验原理制取常见气体,请选择相应的上述装置。
(1)2Na2O2+2H2O===4NaOH+O2↑_________________________________________________;
(2)2H2O22H2O+O2↑________________________________________________________;
(3)2KClO32KCl+3O2↑___________________________________________________;
(4)Zn+H2SO4===ZnSO4+H2↑__________________________________________________;
(5)CaCO3+2HCl===CaCl2+H2O+CO2↑________________________________________;
(6)2NaHCO3Na2CO3+H2O+CO2↑__________________________________________;
(7)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O_____________________________________。
答案 (1)C (2)C (3)A (4)C (5)C (6)A (7)B
9.根据性质除去杂质
为下列各组气体选择合适的除杂试剂(括号内为杂质气体)
(1)含有HCl杂质的气体
①CO2(HCl):________________________________________________________________;
②Cl2(HCl):________________________________________________________________。
(2)中性气体中含有酸性杂质气体
①O2(Cl2):________________________________________________________________;
②CO(CO2):_________________________________________________________________。
(3)酸性气体中含有其他酸性气体
CO2(SO2):__________________________________________________________________。
(4)含有O2杂质的气体
①CO2(O2):_________________________________________________________________;
②N2(O2):_______________________________________________________________。
答案 (1)①饱和NaHCO3溶液 ②饱和食盐水
(2)①NaOH溶液 ②NaOH溶液 (3)饱和NaHCO3溶液或KMnO4溶液 (4)①灼热铜网 ②灼热铜网
1.(2017·浙江省高三“超级全能生”选考科目8月联考A卷)实验室有一瓶久置的Na2SO3固体试剂,已部分变质,为测定其纯度,实验设计与操作如下,请回答问题:
(1)Na2SO3变质的原因(用化学方程式表示)_______________________________________ ______________________________________________________________________________。
(2)取一定量的样品溶于水,加入过量的BaCl2溶液,然后过滤(如图)、洗涤、干燥、称量,其中洗涤沉淀的具体操作为_____________________________________________________。
(3)实验时用BaCl2比用CaCl2好,写出两点理由:____________。
答案 (1)2Na2SO3+O2===2Na2SO4 (2)用玻璃棒引流,往漏斗中加入蒸馏水,浸没沉淀物,让水自然流下,重复2~3次 (3)一是用BaCl2作沉淀剂,BaSO4、BaSO3的相对分子质量大,生成沉淀质量大,称量误差小;二是用CaCl2作沉淀剂,CaSO4微溶,有误差
解析 (1)本题考查Na2SO3的性质,Na2SO3中S显+4价,以还原性为主,容易被氧气氧化成Na2SO4,化学方程式为2Na2SO3+O2===2Na2SO4。(2)考查实验基本操作,洗涤沉淀的方法:用玻璃棒引流,往漏斗中加入蒸馏水,浸没沉淀物,让水自然流下,重复2~3次。(3)考查沉淀剂的选择,用BaCl2作沉淀剂,因为Ba的相对原子质量大于Ca,因此BaSO4、BaSO3的相对分子质量大,生成沉淀的质量大,称量误差小;用CaCl2作沉淀剂,CaSO4微溶,有误差。
2.(2017·浙江省稽阳联谊学校高三8月联考)为了测定某铁碳合金中铁的质量分数,某化学兴趣小组设计了图示实验装置。
(1)写出碳与浓硫酸反应的化学方程式______________________________________________。
(2)C中品红溶液的作用__________________________________________________________。
(3)该小组同学设计的实验装置存在缺陷,下列因素可能导致铁的质量分数测量值偏高的是________。
A.A中反应不完全
B.E中碱石灰吸收空气中的CO2和H2O
C.反应生成的SO2部分被E中碱石灰吸收
D.反应完全后,还有CO2气体滞留在装置体系中
答案 (1)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(2)检验SO2在B中是否吸收完全 (3)AD
解析 (1)浓硫酸具有强氧化性,碳与浓硫酸反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。(2)为排除二氧化硫对二氧化碳测定的干扰,需要除去二氧化碳中的二氧化硫,即B中酸性高锰酸钾溶液的作用是除去二氧化硫,因此C中品红溶液的作用为检验SO2在B中是否吸收完全。(3)A中反应不完全,因此碳的质量减少,铁的质量增加,铁的质量分数测量值偏高,A正确;E中碱石灰吸收空气中的CO2和H2O导致E中质量增加,因此碳的质量增加,铁的质量减少,铁的质量分数测量值偏低,B错误;反应生成的SO2部分被E中碱石灰吸收导致E中质量增加,因此碳的质量增加,铁的质量减少,铁的质量分数测量值偏低,C错误;反应完全后,还有CO2气体滞留在装置体系中,因此碳的质量减少,铁的质量增加,铁的质量分数测量值偏高,D正确,答案选AD。
3.(2017·浙江省名校协作体高三上学期考试)某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成及含量,他们进行如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有____________。
(2)用以下装置可以说明产物有Fe3O4存在:检查装置的气密性,往装置中添加相应的药品,接下来的一步操作为____________________________。
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因___________________________________________________________。
答案 (1)Fe(或铁) (2)打开止水夹K (3)不可行。混合物有铁,铁能还原Fe3+,同时Fe2+也可能被氧化成Fe3+
解析 (1)还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引,应为铁或四氧化三铁,或为二者混合物,往黑色粉末中滴加盐酸,观察到有气泡产生,证明含有金属铁。
(2)按如图装置连接好仪器(图中夹持设备已略去),检查装置的气密性,往装置中添加药品,然后打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯。
(3)黑色粉末加入足量盐酸溶解后,滴入KSCN溶液,不变血红色可能有两种情况,一种是无铁离子存在,一种是有铁离子存在,但Fe3+和过量的铁反应生成亚铁离子,所以方案不正确。
4.(2017·丽水、衢州、湖州三地市高三9月教学质量检测)一定温度下,无水硫酸铜粉末受热分解生成CuO和气体A。气体A为SO2、SO3和O2中的一种或几种。请回答下列问题:
(1)气体A的合理组成为如下三种情况
①只有SO3;②________;③三种气体都有。
(2)只用一种试剂就能证明气体A中是否含有SO2,该试剂是______________。
A.石蕊溶液 B.品红溶液
C.BaCl2溶液 D.NaOH溶液
(3)若气体A中SO2、SO3和O2都有,用下图所示装置测定其中O2的体积。测定结果比实际值明显偏低,其原因是_____________________________________________________。
答案 (1)含有SO2和O2 (2)B (3)SO2与O2在NaOH溶液中发生反应:2SO2+O2+4OH-===2SO+2H2O,O2被吸收消耗,所测体积明显偏低
解析 (1)根据氧化还原反应的规律可知,如果产生SO2,则一定同时有氧气生成,即第二种假设是含有SO2和O2。(2)二氧化硫具有漂白性,能使品红溶液褪色,所以该试剂是品红溶液,答案选B。(3)由于SO2与O2在NaOH溶液中发生反应:2SO2+O2+4OH-===2SO+2H2O,O2被吸收消耗,因此所测体积显偏低。
5.(2017·浙江省“七彩阳光”联盟高三上学期期初联考)某同学欲配制两种一定物质的量浓度的NaOH溶液。
(1)用NaOH固体配制100 mL 1 mol·L-1 NaOH溶液有如下基本操作,C操作的名称是__________。
(2)该同学用上述1 mol·L-1 NaOH溶液配制50 mL 0.1 mol·L-1的NaOH溶液。下列仪器中不必要用到的有________。
①托盘天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管
(3)该同学在两次配制中,以下操作使所配溶液的物质的量浓度偏大的是________。
A.准取称取4.0 g NaOH,待溶解后立即转移到100 mL容量瓶中并定容
B.定容并摇匀,容量瓶正立后发现液面低于刻度线,继续定容
C.用少量的1 mol·L-1 NaOH溶液将50 mL容量瓶洗涤2~3次
D.向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至100 mL
答案 (1)定容 (2)① (3)AC
解析 (2)该同学用上述1 mol·L-1 NaOH溶液配制50 mL 0.1 mol·L-1的NaOH溶液。需要用到的仪器有烧杯、量筒、玻璃棒、50 mL容量瓶、胶头滴管,故不需要托盘天平,答案选①。(3) 准取称取4.0 g NaOH,待溶解后立即转移到100 mL容量瓶中并定容,溶液没有冷却至室温,体积偏小,浓度偏大,A项可选;定容并摇匀,容量瓶正立后发现液面低于刻度线,继续定容,则加入过多的水,浓度偏小,B项不选;用少量的1 mol·L-1 NaOH溶液将50 mL容量瓶洗涤2~3次,相当于先加入少量的氢氧化钠溶液,浓度偏大,C项可选;向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至100 mL,加入过量的水,浓度偏小,D项不选。
相关文档
- 2021届高考化学一轮复习化学平衡状2021-07-027页
- 2020届高考化学一轮复习化学反应速2021-07-0218页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0215页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0219页
- 2020版高考一轮复习化学通用版学案2021-07-029页
- 2020届高考化学一轮复习化学反应与2021-07-028页
- 2020届高考化学一轮复习化学反应进2021-07-0215页
- 2020版高考一轮复习化学通用版学案2021-07-0210页
- 2020年高考化学一轮复习化学反应速2021-07-028页
- 2020届高考化学一轮复习化学实验方2021-07-0212页