- 1.69 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
《
物质结构与性质
》
选修
3
第十一章
题型突破
13
物质结构与性质的综合应用
物质结构与性质的综合应用题是高考命题选考题中的经典题型,该题型命题形式和命题角度灵活,涵盖知识广,有关核外电子的排布规律、元素的电离能、电负性的变化规律及其应用、化学键类型的判断、价层电子对互斥模型、杂化轨道类型以及微粒的立体构型的判断、晶体的类型及性质、配位数、晶胞模型的分析及计算等都是物质结构选考模块的必考点,其中有关晶胞模型的分析及计算是该题型解题的难点,同时该题型还能够很好地考查学生分析问题和解决问题的能力,以及空间想象和逻辑思维能力,题目难度一般较大,复习备考时要引起特别关注。该题型解题的关键是深刻理解物质结构的相关理论,构建解决问题的思维模型,以结构决定性质为抓手,找准问题的切入点进行解题。
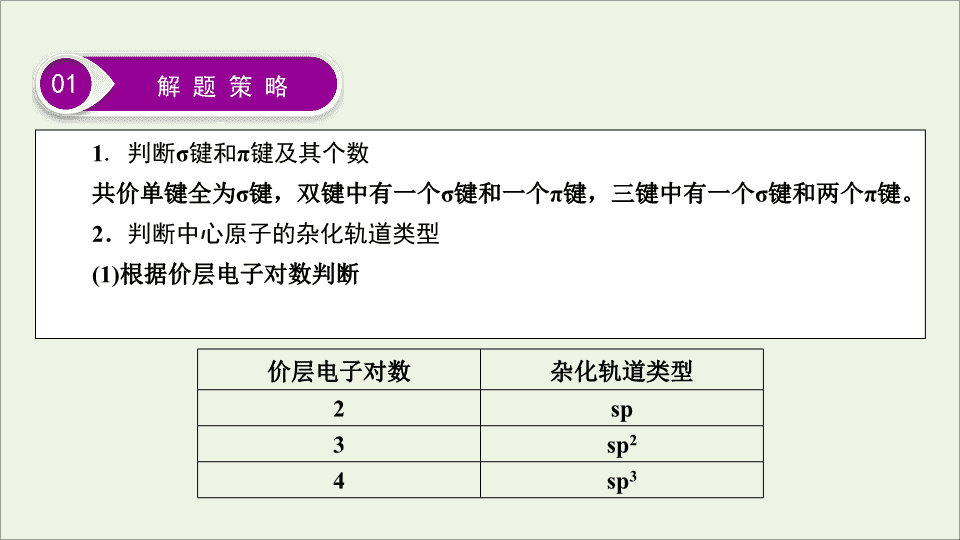
1
.
判断
σ
键和
π
键及其个数
共价单键全为
σ
键,双键中有一个
σ
键和一个
π
键,三键中有一个
σ
键和两个
π
键。
2
.
判断中心原子的杂化轨道类型
(1)
根据价层电子对数判断
01
解 题 策 略
价层电子对数
杂化轨道类型
2
sp
3
sp
2
4
sp
3
4
.
晶体结构中的有关计算
(1)
确定晶体的化学式:根据晶胞的结构特点利用均摊法确定。
①图示:
[
示例
1]
某镍白铜合金的立方晶胞结构如图所示,该晶胞的质量为
________g
。
[
示例
2]
(2016
·
全国卷
Ⅲ
,
37)
GaAs
晶体的密度为
ρ g
·
cm
-
3
,其晶胞结构如图所示。
Ga
和
As
的摩尔质量分别为
M
Ga
g
·
mol
-
1
和
M
As
g
·
mol
-
1
,原子半径分别为
r
Ga
pm
和
r
As
pm
,阿伏加德罗常数值为
N
A
,则
GaAs
晶胞中原子的体积占晶胞体积的百分率为
_____________________________
。
[
示例
3]
(2018
·
全国卷
Ⅰ
,
35(5))
Li
2
O
具有反萤石结构,晶胞如图所示。已知晶胞参数为
0.466 5 nm
,阿伏加德罗常数的值为
N
A
,则
Li
2
O
的密度为
_______________________ g
·
cm
﹣3
(
列出计算式
)
。
[
示例
4]
Cu
与
F
形成的化合物的晶胞结构如图所示,若晶体密度为
a
g
·
cm
-
3
,则
Cu
与
F
最近距离为
______________________pm
。
(
阿伏加德罗常数用
N
A
表示,列出计算表达式,不用化简;图中○为
Cu
,●为
F)
02
真 题 示 例
1
.
(2018
·
全国卷
Ⅲ
,
35)
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn
原子核外电子排布式为
________________________________________
。
(2)
黄铜是人类最早使用的合金之一,主要由
Zn
和
Cu
组成。第一电离能
I
1
(Zn)_____
I
1
(Cu)(
填
“
大于
”
或
“
小于
”
)
。原因是
___________________________ _______________
。
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
或
[Ar]3d
10
4s
2
大于
Zn
核外电子排布为全满结构,
较难失电子
(3)ZnF
2
具有较高的熔点
(872 ℃)
,其化学键类型是
________
;
ZnF
2
不溶于有机溶剂而
ZnCl
2
、
ZnBr
2
、
ZnI
2
能够溶于乙醇、乙醚等有机溶剂,原因是
____________ ___________________________________________________________________
。
(4)《
中华本草
》
等中医典籍中,记载了炉甘石
(ZnCO
3
)
入药,可用于治疗皮肤炎症或表面创伤。
ZnCO
3
中,阴离子空间构型为
________________
,
C
原子的杂化形式为
________
。
离子键
ZnF
2
为离子化合物,极性大,
ZnCl
2
、
ZnBr
2
、
ZnI
2
的化学键以共价键为主,极性较小
平面三角形
sp
2
(5)
金属
Zn
晶体中的原子堆积方式如图所示,这种堆积方式称为
_______________________
。六棱柱底边边长为
a
cm
,高为
c
cm
,阿伏加德罗常数的值为
N
A
,
Zn
的密度为
____________________g
·
cm
-
3
(
列出计算式
)
。
解析
(1)
锌的核外有
30
个电子,因此其核外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
,也可写作
[Ar]
3d
10
4s
2
。
(2)
锌的价层电子排布式为
3d
10
4s
2
,为全满稳定结构,较难失去电子,铜的价层电子排布式为
3d
10
4s
1
,较易失去一个电子,因此锌的第一电离能大于铜的第一电离能。
六方最密堆积
(A
3
型
)
(3)
由
ZnF
2
的熔点为
872 ℃
可知,
ZnF
2
应为离子晶体,因此化学键类型为离子键。
ZnF
2
为离子化合物,极性较大,不溶于有机溶剂;
ZnCl
2
、
ZnBr
2
、
ZnI
2
的化学键以共价键为主,极性较小,能够溶于有机溶剂。
(4)C
原子价层电子对数
n
=
(4
+
3
×
0
+
2)/2
=
3
,因此
C
原子为
sp
2
杂化,
CO
的空间构型为平面三角形。
2
.
(2017
·
全国卷
Ⅲ
,
35)
研究发现,在
CO
2
低压合成甲醇反应
(CO
2
+
3H
2
===CH
3
OH
+
H
2
O)
中,
Co
氧化物负载的
Mn
氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co
基态原子核外电子排布式为
____________
。元素
Mn
与
O
中,第一电离能较大的是
________
,基态原子核外未成对电子数较多的是
________
。
(2)CO
2
和
CH
3
OH
分子中
C
原子的杂化形式分别为
______
和
________
。
(3)
在
CO
2
低压合成甲醇反应所涉及的
4
种物质中,沸点从高到低的顺序为
_________________________
,原因是
_______________________________________ ______________________________________________________________________
。
(4)
硝酸锰是制备上述反应催化剂的原料,
Mn(NO
3
)
2
中的化学键除了
σ
键处,还存在
____________________
。
[Ar]3d
7
4s
2
O
Mn
sp
sp
3
H
2
O
>
CH
3
OH
>
CO
2
>
H
2
H
2
O
与
CH
3
OH
均为极性分子,
H
2
O
中氢键比甲醇多;
CO
2
与
H
2
均为非极性分子,
CO
2
相对分子质量较大,范德华力较大
解析
(1)Co
是
27
号元素,其基态原子核外电子排布式为
[Ar]
3d
7
4s
2
或
1s
2
2s
2
2p
6
3s
2
3p
6
3d
7
4s
2
。元素
Mn
与
O
中,由于
O
是非金属元素而
Mn
是金属元素,所以
O
的第一电离能大于
Mn
的。
O
基态原子核外电子排布式为
1s
2
2s
2
2p
4
,其核外未成对电子数是
2
,而
Mn
基态原子核外电子排布式为
[Ar]
3d
5
4s
2
,其核外未成对电子数是
5
,因此
Mn
的基态原子核外未成对电子数比
O
的多。
(2)CO
2
和
CH
3
OH
的中心原子
C
的价层电子对数分别为
2
和
4
,所以
CO
2
和
CH
3
OH
分子中
C
原子的杂化形式分别为
sp
和
sp
3
。
(3)
由于水和甲醇均为极性分子,二氧化碳和氢气均为非极性分子,所以水和甲醇的沸点高于二氧化碳和氢气的沸点;由于水分子中两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇的沸点;由于二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。
(4)
硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中
N
原子与
3
个氧原子形成
3
个
σ
键,硝酸根中存在氮氧双键,所以还存在
π
键。
03
即 时 训 练
3d
2
4s
2
N
>
C
>
H
N(
或氮
)
19
N
A
(
或
19×6.02×10
23
或
1.1438×10
24
)
sp
3
、
sp
2
乙酸钠
(
或
CH
3
COONa)
乙酸钠固体是离子晶体,乙酰氯固体是分子晶体
>
6
解析
(1)
钛是
22
号元素,其基态原子电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
2
4s
2
,价电子排布式为
3d
2
4s
2
。
(2)①
构成
4
—
二甲氨基吡啶的原子有
C
、
N
、
H
,
C
、
N
同处于第二周期,随着原子序数增大,同周期从左到右电负性增大,而
H
位于第一周期,电负性较小,所以电负性
N>C>H
。同一周期,从左到右各元素的第一电离能总体呈增大的趋势,但是当原子的价电子层原子轨道为全满或者半满时状态稳定,所以它们的第一电离能比相邻的原子都要大,即
N
的第一电离能比相邻的
C
大,而
H
位于第一周期第一电离能较小,因此三种元素的第一电离能最大的是
N
元素。②根据
4
—
二甲氨基吡啶的结构,可知
1 mol
该分子中的
σ
键共有
19 mol
。分子中甲基上的
C
原子的杂化方为
sp
3
杂化,杂环上
C
原子的杂化方为
sp
2
杂化。
2
.
(2019
·
安徽皖北联考
)
有
A
、
B
、
C
、
D
、
E
五种原子序数依次增大的元素
(
原子序数均小于
30)
。
A
的基态原子
2p
能级有
3
个单电子;
C
的基态原子
2p
能级有
1
个单电子;
E
原子最外层有
1
个单电子,其次外层有
3
个能级且均排满电子;
D
与
E
同周期,价电子数为
2
。则:
(1)B
元素的氢化物的沸点是同族元素氢化物中最高的,原因是
______________________
。
(2)A
、
B
、
C
三种元素的氢化物稳定性由强到弱的顺序为
__________________(
用化学式表示
)
。
(3)A
的最简单氢化物分子的立体构型为
___________
,其中
A
原子的杂化类型是
______
杂化。
H
2
O
分子间存在氢键
HF
>
H
2
O
>
NH
3
三角锥形
sp
3
(4)A
的单质中
σ
键的个数为
______
,
π
键的个数为
______
。
(5)
写出基态
E
原子的价电子排布式:
________
。
(6)C
和
D
形成的化合物的晶胞结构如图所示,已知晶体的密度为
ρ
g
·
cm
-
3
,
N
A
为
阿伏加德罗常数的值,则晶胞边长
a
=
________cm(
用
ρ
、
N
A
的计算式表示
)
。
1
2
3d
10
4s
1