- 366.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
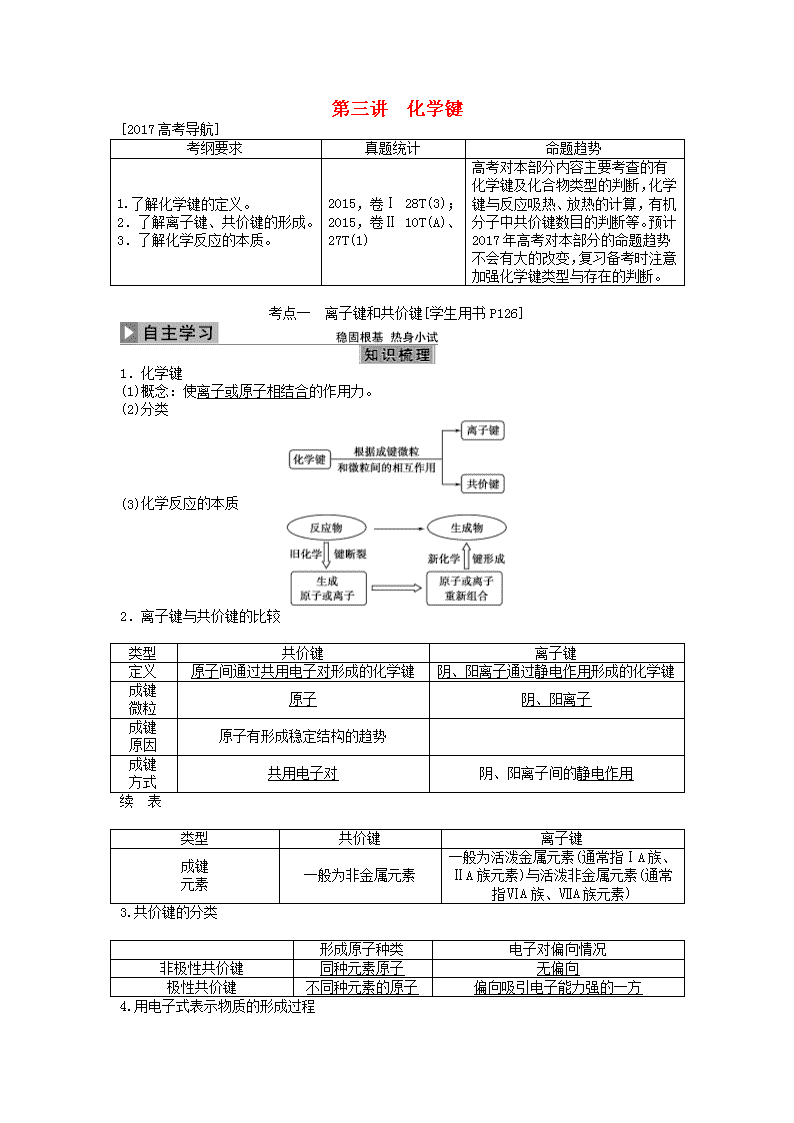
第三讲 化学键
[2017高考导航]
考纲要求
真题统计
命题趋势
1.了解化学键的定义。
2.了解离子键、共价键的形成。
3.了解化学反应的本质。
2015,卷Ⅰ 28T(3);
2015,卷Ⅱ 10T(A)、27T(1)
高考对本部分内容主要考查的有化学键及化合物类型的判断,化学键与反应吸热、放热的计算,有机分子中共价键数目的判断等。预计2017年高考对本部分的命题趋势不会有大的改变,复习备考时注意加强化学键类型与存在的判断。
考点一 离子键和共价键[学生用书P126]
1.化学键
(1)概念:使离子或原子相结合的作用力。
(2)分类
(3)化学反应的本质
2.离子键与共价键的比较
类型
共价键
离子键
定义
原子间通过共用电子对形成的化学键
阴、阳离子通过静电作用形成的化学键
成键
微粒
原子
阴、阳离子
成键
原因
原子有形成稳定结构的趋势
成键
方式
共用电子对
阴、阳离子间的静电作用
续 表
类型
共价键
离子键
成键
元素
一般为非金属元素
一般为活泼金属元素(通常指ⅠA族、ⅡA族元素)与活泼非金属元素(通常指ⅥA族、ⅦA族元素)
3.共价键的分类
形成原子种类
电子对偏向情况
非极性共价键
同种元素原子
无偏向
极性共价键
不同种元素的原子
偏向吸引电子能力强的一方
4.用电子式表示物质的形成过程
(1)Na2S:
(2)CO2:· ·+2· ·―→··C··
1.判断正误(正确的打“√”,错误的打“×”)
(1)形成离子键的阴、阳离子间只存在静电吸引力。( )
(2)某些金属与非金属原子间能形成共价键。( )
(3)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键。( )
答案:(1)× (2)√ (3)×
2.(1)用电子式表示下列离子化合物:
Na2O2、Na2O、MgCl2、NaOH、NH4Cl。
(2)用电子式表示下列物质:
Cl2、N2、H2O、CO2。
答案:(1)Na+[]2-Na+、Na+[]2-Na+、[C]-Mg2+[C]-、Na+[H]-、
[HN H]+[C]-。
(2)CC、N⋮⋮N、HH、··C··。
名师点拨
(2016·最新调研题)
二氯化二硫(S2Cl2)是广泛应用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易水解,并产生能使品红溶液褪色的气体。下列说法错误的是( )
A.S2Cl2的结构中各原子均达到8电子稳定结构
B.S2Cl2为含有极性键和非极性键的共价化合物
C.若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2
D.S2Cl2与H2O反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
[解析] 从S2Cl2的分子结构可知,硫原子之间形成1对共用电子对,每个硫原子与氯原子形成1对共用电子对,各原子均达到8电子稳定结构,A正确;S2Cl2中S—S键为非极性键,S—Cl键为极性键,B正确;对于由结构相似的分子组成的物质,其相对分子质量越大,熔沸点越高,C错误;S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为SO2,在反应过程中硫元素一部分升高到+4价,一部分降低到0价,反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl,D正确。
[答案] C
白磷、BF3、PCl3、PCl5、H2O2等分子是否满足所有原子最外层为8电子稳定结构?
答案:白磷和PCl3满足,BF3、PCl5、H2O2不满足。
判断分子中各原子是否达到8电子的稳定结构,主要有两种方法:
(1)经验规律法
凡符合最外层电子数+|化合价|=8的皆为8电子稳定结构。
(2)试写结构法
判断某化合物中的某元素最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如①H2O:O原子最外层有6个电子,H2O中每个O原子又与两个H原子形成两个共价键,所以H2O中的O原子最外层有6+2=8个电子,但H2O中的H原子最外层只有2个电子;②N2:N原子最外层有5个电子,N与N之间形成三个共价键,所以N2中的N原子最外层达到8电子稳定结构。
题组一 离子键、共价键概念辨析
1.(2016·长春一中月考)下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.含有离子键的化合物一定是离子化合物
C.所有金属与所有非金属之间都能形成离子键
D.在化合物Na2O2中,阴、阳离子的个数比为1∶1
解析:选B。离子键就是使阴、阳离子结合成化合物的静电作用,包括静电吸引和静电排斥,A错误;含有离子键的化合物一定是离子化合物,B正确;有些金属与非金属之间不能形成离子键,如AlCl3,C错误;在化合物Na2O2中,阴、阳离子分别是O、Na+,个数比是1∶2,D错误。
2.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )
A.CH4 B.CH2===CH2
C.CO2 D.N2
解析:选C。CH4、CH2===CH2中氢不满足8电子稳定结构,A、B项错;N2中只含有非极性键且为单质,D项错。
题组二 电子式的书写
3.(教材改编)写出下列物质的电子式。
(1)原子:Na:__________,Cl:__________。
(2)简单离子:Na+:________,F-:__________。
(3)复杂离子:NH:____________,OH-:____________。
(4)离子化合物
MgF2:____________,K2O:____________,
MgO:____________。
(5)非金属单质及共价化合物
O2:__________,H2O2:____________,CH2===CH2:____________。
(6)羟基:____________,甲基:____________。
答案:(1)Na· ··C ·
(2)Na+ []-
(3)[HN H]+ [H]-
(4)[]-Mg2+[]- K+[]2-K+
Mg2+[]2-
(5)·· HH HC,··C,H
(6)H · HC ·
4.(2016·长沙高三模拟)下列表达方式正确的是( )
A.CS2的电子式:S··C··S
B.MgCl2的电子式:Mg2+[]
C.S2-的结构示意图:
D.中子数为20的氯原子:20Cl
解析:选C。A项S原子未标出未成键电子;B项两个Cl-要分开;D项应为Cl。
电子式书写时常见的错误
(1)漏写未参与成键的电子,如N2:N⋮⋮N,应写为N⋮⋮N。
(2)化合物类型不清楚,漏写或多写[ ]及错写电荷数,如NaCl:Na+;HF:H+[]-,应写为NaCl:
Na+[]-;HF:H。
(3)书写不规范,错写共用电子对,如N2的电子式为
N⋮⋮N;不能写成N··N,更不能写成
或· ·。
(4)不考虑原子最外层有几个电子,均写成8电子结构,如CH的电子式为[H,HH]+而不能写成
[HH]+。
(5)不考虑AB2型离子化合物中2个B是分开写还是一起写,如CaBr2、CaC2的电子式分别为
[]-Ca2+[]-、Ca2+[C⋮⋮C]2-。
考点二 化学键与物质类别、物质变化的关系[学生用书P128]
1.化学键与物质类别
(1)化学键的存在
(2)化学键与物质类别的关系
①只含有共价键的物质
a.同种非金属元素构成的单质,如I2、N2、P4、金刚石、晶体硅等。
b.不同非金属元素构成的共价化合物,如HCl、NH3、SiO2、CS2等。
②只含有离子键的物质
活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等。
③既含有离子键又含有共价键的物质
如Na2O2、NH4Cl、NaOH、Na2SO4等。
④无化学键的物质
稀有气体(单原子分子),如氩气、氦气等。
2.物质的溶解或熔化与化学键变化的关系
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,发生电离,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,发生电离,其分子内的共价键被破坏,如HCl、H2SO4等。
③某些共价化合物溶于水后,其分子内的化学键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
(3)单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
3.化学键对物质化学性质的影响
N2分子中有很强的N≡N,故在通常状况下,N2很稳定;H2S、HI等分子中的共价键较弱,故它们受热时易分解。
1.判断正误(正确的打“√”,错误的打“×”)
(1)1 mol KHSO4加热熔化可电离出阳离子的个数为2NA。( )
(2)共价化合物溶于水,分子内共价键被破坏;单质溶于水,分子内共价键不被破坏。( )
(3)共价化合物熔点都低于离子化合物。( )
(4)分子内共价键越强,分子越稳定,其熔、沸点也越高。( )
(5)含有阳离子的化合物一定含有阴离子。( )
(6)(2014·高考安徽卷)三聚氰酸(NOHNOHHO)分子中既含极性键,又含非极性键。( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)×
2.(教材改编)有以下9种物质:①Ne;②NH4Cl;③KNO3;④NaOH;⑤Cl2;⑥SO2;⑦H2S;⑧Na2O2;⑨MgCl2。
请用上述物质的数字序号填空:
(1)只存在离子键的是________。
(2)只存在共价键的是________。
(3)只存在共价键的电解质是________。
(4)既存在离子键又存在共价键的是________。
(5)不存在化学键的是________。
答案:(1)⑨ (2)⑤⑥⑦ (3)⑦ (4)②③④⑧ (5)①
3.(2016·中国人民大学附中一模)下列关于化学键与化合物的叙述正确的是( )
①离子化合物中一定含有金属元素 ②共价化合物中一定不含有金属元素 ③离子化合物中一定含有离子键 ④离子化合物中一定不含有共价键 ⑤离子化合物中可能含有共价键 ⑥共价化合物中可能含有离子键 ⑦共价化合物中一定不含有离子键
A.①⑤⑥⑦ B.②③④
C.③⑤⑦ D.②③⑥⑦
解析:选C。离子化合物中不一定含有金属元素,可能只含非金属元素,如铵盐,①错误;共价化合物中可能含有金属元素,如氯化铝,②错误;离子化合物中一定含有离子键,可能含有共价键,如Na2O2,③正确,④错误,⑤正确;共价化合物中只含共价键,一定不含离子键,⑥错误,⑦正确。
名师点拨
(1)离子化合物和共价化合物的判断方法
①根据化学键的类型来判断
凡含有离子键的化合物一定是离子化合物;只含有共价键的化合物是共价化合物。
②根据化合物的类型来判断
大多数碱性氧化物、强碱和盐都属于离子化合物(AlCl3除外);非金属氢化物、非金属氧化物、含氧酸都属于共价化合物。
③根据化合物的性质来判断
一般熔、沸点较低的化合物是共价化合物。熔融状态下能导电的化合物是离子化合物,如NaCl;不能导电的化合物是共价化合物,如HCl。
(2)有化学键断裂的变化不一定是化学变化,如NaCl熔化变成自由移动的Na+和Cl-,HCl溶于水电离成H+和Cl-等,只有旧化学键的断裂没有新化学键的形成,没有发生化学变化。
(2015·高考上海卷)将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )
A.2种 B.3种
C.4种 D.5种
[解析] Na2O、NaOH、Na2S、Na2SO4都含有离子键,加热熔化时,需要克服相同类型的作用力,而Na是金属晶体,熔化时破坏的是金属键。
[答案] C
1.所有物质中都存在化学键吗?
答案:不是所有物质中都存在化学键,稀有气体中无化学键。
2.(1)形成离子键的静电作用指的是阴、阳离子间的静电吸引吗?
(2)形成离子键的元素一定是金属元素和非金属元素吗?仅由非金属元素组成的物质中一定不含离子键吗?
答案:(1)既有阴、阳离子间的静电吸引,也有原子核与原子核之间、电子与电子之间的相互排斥。
(2)都不一定,如铵盐全是由非金属元素形成的,其中的化学键就有离子键。
题组一 化学键与物质类别
1.下列每组中各物质内既有离子键又有共价键的一组是( )
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
解析:选C。A中H2SO4内只有共价键;B中MgO内只有离子键;D中HCl内只有共价键,Al2O3、MgCl2内只有离子键。
2.(2015·高考上海卷)某晶体中含有极性键,关于该晶体的说法错误的是( )
A.不可能有很高的熔沸点
B.不可能是单质
C.可能是有机物
D.可能是离子晶体
解析:选A。二氧化硅晶体中含有极性键,具有较高的熔沸点,故A错误;单质形成的原子晶体中含有非极性键,故B正确;冰醋酸晶体中含有极性键,故C正确;NaOH中含有极性键,是离子晶体,故D正确。
题组二 化学键的断裂与形成
3.下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的反应是( )
A.NH4ClNH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
解析:选D。A中无离子键的形成,也无非极性键的断裂和形成;B中无离子键的断裂,也无非极性键的断裂和形成;C中无非极性键的形成;D中Na2O2含有离子键、非极性键,CO2中含极性键,Na2CO3中含离子键、极性键,O2中含非极性键。
4.下列关于化合物的说法正确的是( )
A.只含有共价键的物质一定是共价化合物
B.由两种原子组成的纯净物一定是化合物
C.共价化合物熔化时破坏共价键
D.熔化状态下不导电的化合物一定是共价化合物
解析:选D。只含有共价键的物质也可能是单质,A错误;由两种原子组成的纯净物也可能是单质,如HD,B错误;大部分共价化合物熔化时不破坏共价键,如冰融化,C错误。
5.从化学键的观点看,化学反应的实质是“旧键的断裂与新键的形成”,据此你认为下列变化属于化学反应的是( )
A.对空气进行降温加压
B.金刚石变成石墨
C.NaCl熔化
D.碘溶于CCl4中
解析:选B。A项中既无化学键断裂又无化学键形成;B项先断裂金刚石中的共价键再形成石墨中的共价键;C项只断裂NaCl中的离子键无新化学键形成;D项无化学键的断裂和形成。
(1)理解3个概念:
①化学键;②离子键;③共价键。
(2)牢记两种化合物的一般类别
①离子化合物:强碱,大多数盐,活泼金属氧化物。
②共价化合物:酸,弱碱,极少数盐,非金属氧化物和氢化物。
(3)记住3类特例
①含有共价键的离子化合物常见的有NaOH、Na2O2、NH4Cl等。②活泼金属元素与活泼非金属元素形成的共价化合物:AlCl3。③仅由非金属元素组成的离子化合物:NH4Cl、NH4NO3等。
(4)理解化学变化的本质反应物中化学键的断裂和生成物中化学键的形成。
一、选择题
1.(2015·高考上海卷)一般情况下,前者无法决定后者的是( )
A.原子核外电子排布——元素在周期表中的位置
B.弱电解质的相对强弱——电离常数的大小
C.分子间作用力的大小——分子稳定性的高低
D.物质内部储存的能量——化学反应的热效应
解析:选C。根据原子核外电子排布可以推测元素在周期表中的位置,A正确;弱电解质的相对强弱可以决定其电离常数的大小,B正确;分子间作用力的大小不能决定分子稳定性的高低(由化学键决定),C错误;物质内部储存的能量可以决定化学反应的热效应,D正确。
2.(2016·兰州高三模拟)下列说法正确的是( )
A.NH4NO3中只含共价键
B.稀有气体分子中不含化学键
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
解析:选B。A项,NH4NO3中既含离子键又含共价键;B项,稀有气体为单原子分子,不含化学键;C项,干冰升华时CO2分子未被破坏,即其分子内的共价键未被破坏;D项,活泼金属元素Al与活泼非金属元素Cl形成共价化合物AlCl3。
3.(2016·承德高三质检)下列关于物质结构和化学用语的说法正确的是( )
A.78 g Na2O2晶体中所含阴、阳离子个数共为4NA(NA表示阿伏加德罗常数的值)
B.1个乙醇分子中存在8对共用电子对
C.NaOH和Na2O中所含的化学键类型完全相同
D.CCl4和AlCl3分子中所有原子的最外层都达到8电子稳定结构
解析:选B。A项,1 mol Na2O2中含有3 mol离子,即2 mol Na+和1 mol O,A错;B项,1个CH3CH2OH中共形成8个共价键,即存在8对共用电子对,B正确;C项,NaOH中含离子键和极性键,Na2O只含离子键,C错;D项,CCl4的分子中,每个原子都达到了8电子稳定结构,而AlCl3分子中,铝只满足6电子结构,D错。
4.下列表达正确的是( )
A.HClO的电子式为HC
B.H2S的电子式可表示为H+[]H+
C.用电子式表示Na2O的形成过程为2Na×+· ·―→2Na+[]2-
D.BaCl2的电子式为[C]-Ba2+[C]-
解析:选D。HClO的电子式应为HC,A错;H2S为共价化合物,电子式应为HH,B错;C中两个钠离子不能合并,正确的形成过程为―→
Na+[]2-Na+,C错。
5.下列说法不正确的是( )
①形成化学键的过程一定是化学变化
②物质有阳离子必有阴离子
③含有金属元素的离子一定为阳离子
④HCl溶于水电离出H+和Cl-,因此HCl中含有离子键
A.①②③④ B.②③④
C.②③ D.①②③
解析:选A。①NaCl溶液蒸发结晶过程中形成了离子键,但属于物理变化;②金属晶体中只有阳离子和自由电子;③AlO、MnO等阴离子中含有金属元素;④HCl分子中H与Cl之间存在共用电子对,HCl中只含共价键,不含离子键。
6.(2016·西安高三模拟)下列关于化学键的说法正确的是( )
①原子间的相互作用叫化学键 ②两个非金属原子间不可能形成离子键 ③强电解质中一定存在离子键 ④形成化学键的过程是能量降低的过程 ⑤共价化合物、离子化合物中都存在共价键
A.①④ B.③④
C.②③ D.②④
解析:选D。①中相邻原子或离子间的强相互作用叫化学键。③中如H2SO4是属于共价化合物的强电解质。⑤中并不是所有离子化合物中都存在共价键。
7.化学键使得一百多种元素构成了世界的万物。关于化学键的下列叙述中,正确的是( )
A.离子化合物中一定含有共价键,共价化合物中不含离子键
B.共价化合物中可能含离子键,离子化合物中只含离子键
C.构成单质的分子一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
解析:选D。离子化合物必含离子键,不一定含有共价键,但共价化合物必含共价键,一定不含离子键,A、B错误;稀有气体分子之间只含范德华力,分子内不含共价键,C错误;离子键中既存在静电吸引,也存在静电排斥,D正确。
8.(2016·武汉高三检测)将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4。下列关于NaHSO4的说法中正确的是( )
A.因为NaHSO4是离子化合物,因此其固体能够导电
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时既破坏离子键又破坏共价键
解析:选D。虽然NaHSO4是离子化合物,但其固体中不存在自由移动的阴、阳离子,因而不能导电;NaHSO4固体中阳离子(Na+)和阴离子(HSO)的个数比是1∶1;NaHSO4固体熔化时破坏的只是离子键,溶于水时电离成Na+、H+和SO,破坏的是离子键和共价键。
9.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,且有良好的超导性。下列关于K3C60的组成和结构的分析正确的是( )
A.K3C60中既有离子键,又有极性键
B.该物质在熔融状态下能导电
C.该物质的化学式可写成KC20
D.C60与12C互为同素异形体
解析:选B。A项K3C60中含有离子键,不可能含有极性键;B项离子化合物在熔融状态下能导电;C项该物质的化学式不能写成KC20;D项C60是单质,12C是核素。
二、非选择题
10.氮化钠(Na3N)是科学家制备的一种重要的化合物,与水作用可产生NH3。
请根据材料完成下列问题:
(1)Na3N的电子式是________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别为______________、__________________。
(3)Na3N与水的反应属于________反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:r(Na+)__________r(N3-)(填“>”“=”或“<”)。
解析:首先根据Na3N构成元素的活泼性确定其所属的化合物类型。Na3N与盐酸的反应可理解为Na3N与H2O反应所得的产物再与盐酸反应。
(1)钠位于ⅠA族,是活泼金属,易失去一个电子形成Na+,氮位于ⅤA族,易得到3个电子,形成N3-,故Na+与N3-可形成离子化合物。
(2)Na3N与盐酸反应时,N3-与H+结合成NH3,NH3进一步与HCl反应生成NH4Cl,Na+与Cl-形成NaCl,故有2种盐生成。
(3)Na3N与水反应属于复分解反应,方程式为Na3N+3H2O===3NaOH+NH3↑。
(4)Na+与N3-属于核外电子排布相同的粒子,钠的核电荷数大于氮的核电荷数,故r(Na+)”),其原因是________________________________________________________________________
(用离子方程式表示)。
解析:无色单质气体为H2、N2和O2,三者两两反应可生成NO、H2O、NH3等分子,由乙、丙分子中X的原子个数比为2∶3推知X为H,由甲与Y单质在常温下混合有明显现象推知Y为O,Z为N。丁为HNO3,戊为 NH4NO3,在NH4NO3晶体中既含离子键,又含共价键,NH4NO3水解显酸性。
答案:(1)氢
(2)NO 4NH3+5O24NO+6H2O
(3)①c ②< NH+H2ONH3·H2O+H+
相关文档
- 2021届高考化学一轮复习化学平衡状2021-07-027页
- 2020届高考化学一轮复习化学反应速2021-07-0218页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0215页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0219页
- 2020版高考一轮复习化学通用版学案2021-07-029页
- 2020届高考化学一轮复习化学反应与2021-07-028页
- 2020届高考化学一轮复习化学反应进2021-07-0215页
- 2020版高考一轮复习化学通用版学案2021-07-0210页
- 2020年高考化学一轮复习化学反应速2021-07-028页
- 2020届高考化学一轮复习化学实验方2021-07-0212页