- 836.00 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安徽省肥东县第二中学2019-2020学年高二上学期期中考试试题
一、单选题(本大题共18小题,共54.0分)
1.中国传统文化对人类文明贡献巨大,我国古代就已经广泛应用了相关的化学知识,下列关于古代化学的应用和记载中,说法不合理的是( )
A. 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
B. 我国古代人民常用明矾水除去铜器上的铜锈
C. 锡青铜铜锡合金文物在潮湿环境中的腐蚀比干燥环境中快
D. 晋代炼丹家、医学家葛洪所著抱扑子一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
【答案】D
【详解】A. 可燃物燃烧时放出热量,所以能量变化主要是化学能转化为热能,A项正确;
B. 明矾中含有铝离子,铝离子水解使溶液显酸性,Cu2(OH)2CO3能与酸性溶液反应,所以可用明矾水除去铜器上的铜锈,B项正确;
C. 锡青铜是铜锡合金,在潮湿环境中,铜锡合金会形成原电池,发生吸氧腐蚀,所以锡青铜(铜锡合金)文物在潮湿环境中的腐蚀比干燥环境中快,C项正确;
D. 丹砂为硫化汞,不稳定,加热发生HgS Hg+S,温度降低时,又可发生Hg + S = HgS,二者反应条件不同,不符合可逆反应概念,D项错误;
答案选D。
2.已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3 kJ·mol-1
(2)C(s)+O2(g)=CO2(g)ΔH2=-393.5 kJ·mol-1
(3)H2(g)+1/2O2(g)=H2O(l)ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A. ΔH=-488.3 kJ·mol-1 B. ΔH=-244.15 kJ·mol-1
C. ΔH=-977.6 kJ·mol-1 D. ΔH=+488.3 kJ·mol-1
【答案】A
【详解】根据盖斯定律分析,反应②×2-反应①+反应③
×2即可得热化学方程式为:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=-393.5×2+870.3-285.8×2= -488.3kJ·mol-1,答案选A。
3.下列说法或表示方法中正确的是( )
A. 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH= -285.8kJ/mol
C. Ba(OH)2•8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D. 已知中和热为57.3kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ
【答案】D
【详解】A.硫蒸气比硫固体所含能量高,等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多,故A错误;
B.燃烧热是指1mol可燃物燃烧放出的热量,热化学方程式中氢气是2mol,故B错误;
C.氯化铵和八水合氢氧化钡反应吸热,△H>0,故C错误;
D.浓硫酸溶于水放热,故将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ,故D正确;
故答案为D。
4.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
下列说法不正确的是( )
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
【答案】D
【解析】分析:A项,生成CH3COOH的总反应为CH4+CO2CH3
COOH,原子利用率为100%;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂;C项,根据图示,①的总能量高于②的总能量,①→②放出能量并形成C-C键;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高平衡转化率。
详解:A项,根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A项正确;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂,B项正确;C项,根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,C项正确;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D项错误;答案选D。
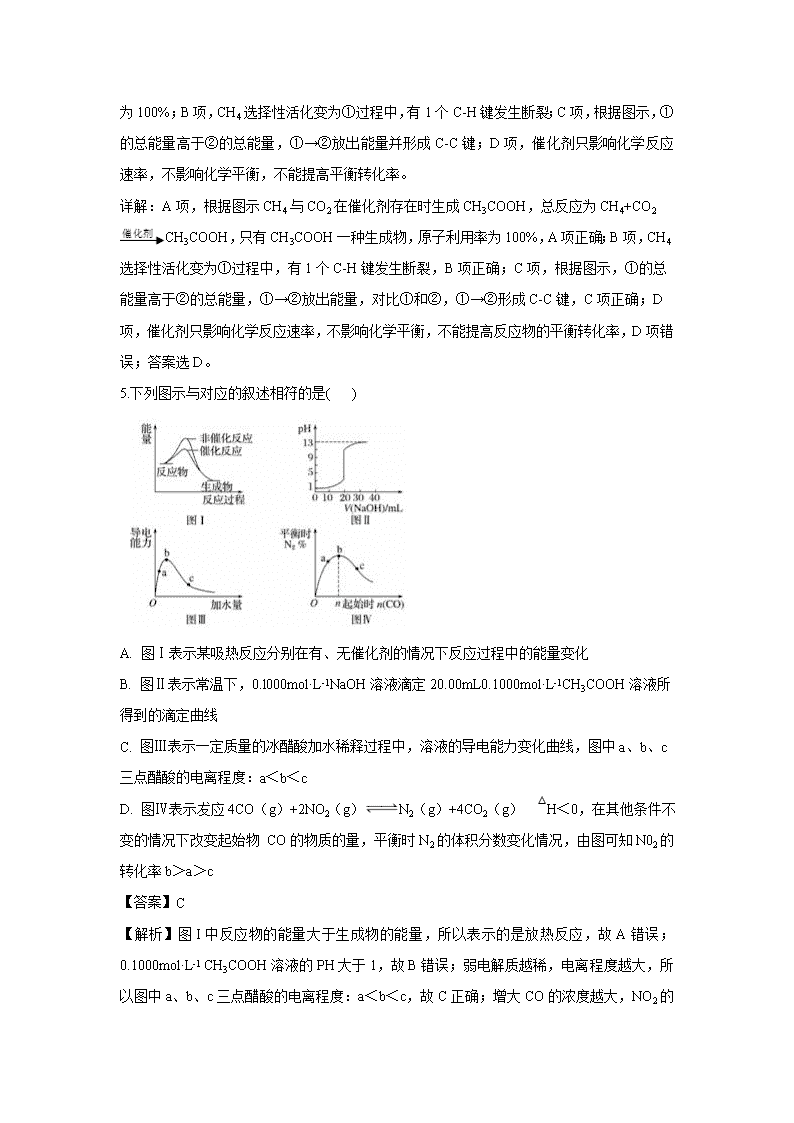
5.下列图示与对应的叙述相符的是( )
A. 图Ⅰ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.l000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示犮应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物 CO的物质的量,平衡时N2的体积分数变化情况,由图可知N02的转化率b>a>c
【答案】C
【解析】图I中反应物的能量大于生成物的能量,所以表示的是放热反应,故A错误;0.1000mol·L-1 CH3COOH溶液的PH大于1,故B错误;弱电解质越稀,电离程度越大,所以图中a、b、c三点醋酸的电离程度:a<b<c,故C正确;增大CO的浓度越大,NO2
的转化率越大,所以NO2的转化率c>b>a,故D错误。
6.某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g);△H<0.上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
A. 时加入了催化剂 B. 时降低了温度
C. 时增大了压强 D. 时间内转化率最高
【答案】C
【详解】A.由图可知,t2时刻,改变条件,正、逆反应速率同等程度增大,平衡不移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是改变压强,故改变条件为使用催化剂,故A正确,不符合题意;
B.t3时刻,改变条件,正、逆反应速率降低,且逆反应速率降低更多,平衡向正反应移动,该反应正反应是放热反应,温度降低,平衡向正反应移动,故可能为降低温度,故B正确,不符合题意;
C.t5时刻,改变条件,正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是改变压强,该反应正反应是放热反应,升高温度,平衡向逆反应移动,故改变条件为升高温度,故C错误,符合题意;
D.t2时刻,使用催化剂,平衡不移动,X的转化率不变,t3时刻,降低温度,平衡向正反应移动,X的转化率增大,t5时刻,升高温度,平衡向逆反应移动,X的转化率降低,则t4~t5内转化率最高,故D正确,不符合题意;
本题答案选C。
7.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)( )
A. B.
C. D.
【答案】A
【详解】A.该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,故A正确;
B.增大压强平衡气体体积减小的方向移动,即向正反应方向移动,V正>V逆;且增大压强,正逆反应速率都增大;故B错误;
C.催化剂同等程度地改变正逆反应速率,平衡不发生移动,所以达到平衡,C的浓度相同;故C错误;
D.该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,而图像中的温度高时,A的转化率较大。但根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,同个温度下的曲线趋势正确;故D错误;
答案选A。
8.某浓度的氨水中存在下列平衡:,若想增大的浓度,而不增加的浓度,应采取的措施是( )
适当升高温度 加入固体 通入 加入少量盐酸。
A. ①② B. ②③ C. ③④ D. ②④
【答案】D
【详解】①一水合氨的电离是吸热过程,升高温度,平衡正向移动,所以NH4+与OH-的浓度均增加,故①不符合题意;
②加入固体,溶液中NH4+浓度增加,平衡逆向移动,OH-的浓度减小,故②符合题意;
③通入氨气,即增加一水合氨浓度,平衡正向移动,溶液中NH4+与OH-的浓度均增加,故③不符合题意;
④加入少量盐酸,OH-与盐酸反应,OH-浓度减小,平衡正向移动,溶液中NH4+浓度增加,故④符合题意;
综上所述,②④符合题意,本题应选D。
9.298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是( )
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
【答案】D
【详解】A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,而石蕊的变色范围为5-8,无法控制滴定终点,应选择甲基橙作指示剂,故A错误;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20.0mL,故B错误;
C.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制,水的电离程度很小,该点溶液中离子浓度大小顺序是c(NH4+)=c(Cl-)>c(H+)=c(OH-),故C错误;
D.N点为氨水溶液,氨水浓度为0.10mol•L-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3 mol/L,c(H+)=mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故D正确;故选D。
10.时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
A. 水的电离程度:a点小于b点
B. a点溶液的导电性大于b点溶液
C. 恰好完全中和时,所需NaOH物质的量:
D. HA的酸性强于HB
【答案】D
【详解】pH相同的酸,稀释相同倍数时,酸性较强的酸的pH变化大,酸性较弱的酸的pH变化小,据此得出酸性:HA>HB。
A. a点pH大于b点,即a点的c(H+)小于b点,则酸的电离对水的电离的抑制程度:a点小于b点,所以水的电离程度:a点大于b点,A项错误;
B. 在这两种酸溶液中,c(H+)≈c(A−),c(H+)≈c(B−),而a点的c(H+)小于b点的c(H+),故a点的c(A−)小于b点的c(B−),即a点的离子浓度小于b点的离子浓度,故a点的导电能力小于b点,B项错误;
C. 在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在稀释前两种酸溶液的浓度:c(HA)