- 4.89 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
4
讲 离子反应 氧化还原反应
【考纲点击】
1.
了解离子反应的概念,离子反应发生的条件。
2.
掌握常见离子的检验方法。
3.
能正确书写化学方程式和离子方程式,并能进行有关计算。
4.
了解氧化还原反应的本质,了解常见的氧化还原反应。
5.
掌握常见氧化还原反应的配平和相关计算。
考点
1
离子反应
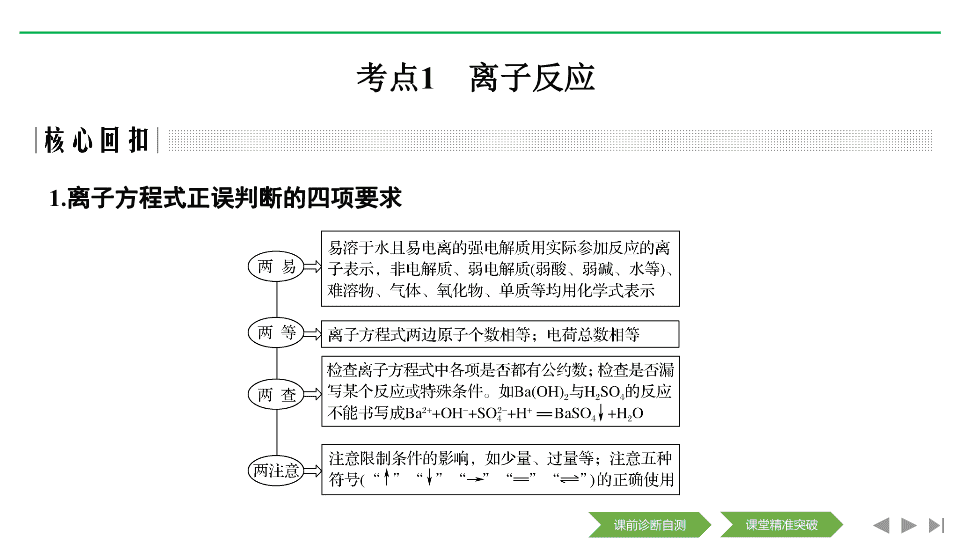
1.
离子方程式正误判断的四项要求
2.
离子共存的四大题设
“
陷阱
”
条件类型
常见表述
误点点拨
常见的限制条件
“
无色
”
Cu
2
+
、
Fe
2
+
、
Fe
3
+
、
MnO
等有色离子不能大量存在
“
pH
=
1
”
或
“
pH
=
13
”
溶液显酸性或碱性
“
因发生氧化还原反应而不能大量共存
”
只能是氧化性离子和还原性离子不共存,并不是其他离子反应,同时要注意溶液酸碱性的影响
“
透明
”
“
透明
”
也可
“
有色
”
角度一 离子方程式的正误判断
1.
(2019·
天津理综,
2)
下列离子方程式能用来解释相应实验现象的是
(
)
答案
A
2.
(2018·
江苏化学,
7)
下列指定反应的离子方程式正确的是
(
)
答案
A
角度二 离子共存
3.
(2019·
江苏化学,
4)
室温下,下列各组离子在指定溶液中能大量共存的是
(
)
答案
A
4.
(2017·
江苏化学,
9)
常温下,下列各组离子在指定溶液中能大量共存的是
(
)
答案
B
角度三 离子推断
答案
BC
题组一 离子方程式的正误判断
1.
(2019·
铁岭市五校联考
)
下列反应的离子方程式正确的是
(
)
解析
A
项,硝酸少量,
Fe
转化为
Fe
2
+
,错误;
C
项,醋酸为弱酸,不能拆,错误;
D
项,电解
MgCl
2
溶液,阴极上
H
2
O
反应不拆,且产生的
OH
-
与
Mg
2
+
反应生成
Mg(OH)
2
沉淀,漏部分反应,错误。
答案
B
2.
(2019·
山东济南质检
)
下列反应的离子方程式正确的是
(
)
答案
A
3.
(2019·
湖南长沙质检
)
下列离子方程式书写正确的是
(
)
答案
A
题后悟道
离子方程式正误判断审题要点
题组二 离子共存
4.
(2019·
山东济宁质检
)
常温下,下列各组离子在指定溶液中一定能大量共存的是
(
)
答案
D
5.
常温下,下列各组离子在指定溶液中一定能大量共存的是
(
)
答案
D
A.3
种
B.4
种
C.5
种
D.6
种
答案
C
题后悟道
离子共存问题思维模型
题组三 离子推断
(1)
取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
(2)
在
(1)
所得溶液中加入过量
NH
4
HCO
3
溶液,有气体生成,同时产生白色沉淀甲;
(3)
在
(2)
所得溶液中加入过量
Ba(OH)
2
溶液并加热也有气体生成,同时产生白色沉淀乙。
则下列离子在原溶液中一定存在的有
(
)
答案
A
8.
在
Na
+
浓度为
0.9
mol·L
-
1
的某澄清溶液中,还可能含有下表中的若干种离子:
答案
B
题后悟道
电荷守恒法确定离子
定量推断最后一种离子存在的方法:如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带正电荷总数等于阴离子所带负电荷总数。
题组四 与量有关的离子方程式
9.
写出下列反应的离子方程式:
(1)
向
NaOH
溶液中通入少量
CO
2
____________________________________________________________
(2)
向
AlCl
3
溶液中滴加过量
NaOH
溶液
____________________________________________________________
(3)
向
NaAlO
2
溶液中通入少量
CO
2
____________________________________________________________
(4)
向
NaAlO
2
溶液中通入过量
CO
2
____________________________________________________________
(5)
向
Na
2
CO
3
溶液中滴加少量硫酸
____________________________________________________________
10.
写出下列反应的离子方程式:
(1)NaHCO
3
溶液分别与
①
少量澄清石灰水,
②
过量澄清石灰水
____________________________________________________________
____________________________________________________________
。
(2)
向
NaHSO
4
溶液中滴加
Ba(OH)
2
溶液至溶液恰好呈中性
____________________________________________________________
。
(3)
向明矾溶液中滴加
Ba(OH)
2
溶液
①
沉淀的物质的量最大,
②
沉淀的质量最大
____________________________________________________________
。
11.
写出下列反应的离子方程式:
(1)
向
FeBr
2
溶液中通入过量
Cl
2
____________________________________________________________
(2)
向
FeBr
2
溶液中通入少量
Cl
2
____________________________________________________________
(3)
向
FeBr
2
溶液中通入
Cl
2
(
n
FeBr
2
∶
n
Cl
2
=
1
∶
1)
____________________________________________________________
答案
(1)2Fe
2
+
+
4Br
-
+
3Cl
2
===2Fe
3
+
+
2Br
2
+
6Cl
-
(2)2Fe
2
+
+
Cl
2
===2Fe
3
+
+
2Cl
-
(3)2Fe
2
+
+
2Br
-
+
2Cl
2
===2Fe
3
+
+
Br
2
+
4Cl
-
题后悟道
“
以少定多
”
法书写比例关系型离子方程式
先根据题给条件判断
“
少量物质
”
,以少量物质的离子计量数
(
充分反应
)
确定所需
“
过量物质
”
的离子数目。向
Ca(HCO
3
)
2
溶液中加入过量
NaOH
溶液的离子方程式的书写方法为
考点
2
氧化还原反应
1.
氧化还原反应概念间的关系
2.
氧化还原反应中的
“
四大规律
”
3.
常见氧化剂、还原剂及对应产物
(1)
常见的氧化剂被还原后的生成物:
(2)
常见的还原剂被氧化后的生成物:
角度一 氧化还原反应的基本概念
1.
(2016·
上海化学,
13)
O
2
F
2
可以发生反应:
H
2
S
+
4O
2
F
2
―→
SF
6
+
2HF
+
4O
2
,下列说法正确的是
(
)
A.
氧气是氧化产物
B.O
2
F
2
既是氧化剂又是还原剂
C.
若生成
4.48 L HF
,则转移
0.8 mol
电子
D.
还原剂与氧化剂的物质的量之比为
1
∶
4
解析
氧元素的化合价由+
1
价降低到
0
价,化合价降低被还原,氧气是还原产物,
A
项错误;
O
2
F
2
中氧元素的化合价降低,氟元素化合价不变,故
O
2
F
2
在反应中作氧化剂,
B
项错误;未说明状况,无法求得
HF
的物质的量,无法计算电子转移的数目,
C
项错误;该反应中
O
2
F
2
为氧化剂,
H
2
S
为还原剂,二者物质的量之比为
4
∶
1
,
D
项正确。
答案
D
角度二 氧化还原反应的规律应用
A.
+
4 B.
+
5
C.
+
6 D.
+
7
答案
C
答案
D
角度三 氧化还原反应的计算
答案
2
∶
7
(2)
(2015·
全国卷
Ⅱ
)
工业上可用
KClO
3
与
Na
2
SO
3
在
H
2
SO
4
存在下制得
ClO
2
,该反应氧化剂与还原剂物质的量之比为
________
。
答案
2
∶
1
H
3
PO
2
及
NaH
2
PO
2
均可将溶液中的
Ag
+
还原为银,从而可用于化学镀银。
①H
3
PO
2
中,
P
元素的化合价为
________
。
②
利用
H
3
PO
2
进行化学镀银反应中,氧化剂与还原剂的物质的量之比为
4∶1
,则氧化产物为
________(
填化学式
)
。
解析
①
在化合物中,各元素正、负化合价的代数和为零,故
H
3
PO
2
中
P
元素化合价为+
1
价。
②
设氧化产物中
P
元素的化合价为+
x
价,依题意并根据得失电子守恒有
4
×
[(
+
1)
-
0]
=
1
×
[
+
x
-
(
+
1)]
,解得
x
=
5
,故氧化产物为
H
3
PO
4
。
答案
①
+
1
②
H
3
PO
4
(3)
(2014·
全国卷
Ⅰ
)
(4)
[2016·
课标全国
Ⅰ
,
28(5)]
“
有效氯含量
”
可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
Cl
2
的氧化能力。
NaClO
2
的有效氯含量为
________
。
(
计算结果保留两位小数
)
解析
NaClO
2
在杀菌消毒的过程中被还原为
Cl
-
,则
1 mol NaClO
2
得到电子的物质的量为
4 mol
,
1 mol Cl
2
被还原为
Cl
-
时得到电子的物质的量为
2 mol
,故
1 g NaClO
2
得到电子的物质的量为
4/90.5 mol
,根据
“
有效氯含量
”
的定义可知,
NaClO
2
的有效氯含量为
1.57
。
答案
1.57
答案
0.5
角度四 信息氧化还原反应方程式的书写
题组一 氧化还原反应的基本概念
1.
研究发现
CuSO
4
和
FeS
2
在一定条件下可发生如下反应:
14CuSO
4
+
5FeS
2
+
12H
2
O===7Cu
2
S
+
5FeSO
4
+
12H
2
SO
4
。下列说法正确的是
(
)
答案
C
2.
含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如
2Co
3
O
4
+
6ClF
3
===6CoF
3
+
3Cl
2
+
4X
。下列有关该反应的说法正确的是
(
)
A.X
是还原产物
B.ClF
3
中氯元素为-
3
价
C.
反应生成
3 mol Cl
2
时转移
18 mol
电子
D.Co
3
O
4
在反应中作氧化剂
解析
根据元素守恒,
X
是
O
2
,氧气是氧化产物,
A
项错误;
ClF
3
中氯元素为+
3
价,
B
项错误;氯元素由+
3
价降为
0
价,反应生成
3 mol Cl
2
时转移
18 mol
电子,
C
项正确;
Co
3
O
4
中
Co
元素、氧元素化合价均升高,所以
Co
3
O
4
在反应中作还原剂,
D
项错误。
答案
C
题后悟道
题组二 氧化还原反应
“
强弱规律
”
的应用
3.
已知
Co
2
O
3
在酸性溶液中易被还原成
Co
2
+
,
Co
2
O
3
、
Cl
2
、
FeCl
3
、
I
2
的氧化性依次减弱。下列反应在水溶液中不可能发生的是
(
)
A.3Cl
2
+
6FeI
2
===2FeCl
3
+
4FeI
3
B.Cl
2
+
FeI
2
===FeCl
2
+
I
2
C.Co
2
O
3
+
6HCl===2CoCl
2
+
Cl
2
↑
+
3H
2
O
D.2Fe
3
+
+
2I
-
===2Fe
2
+
+
I
2
解析
Fe
3
+
能氧化
I
-
,所以不可能生成
FeI
3
,
A
错误;
D
正确;
B
项,当
Cl
2
少量时,
I
-
先被氧化,正确;
C
项,由于
Co
2
O
3
的氧化性强于
Cl
2
,所以
Co
2
O
3
能氧化
Cl
-
得到
Cl
2
,而
Co
2
O
3
被还原为
Co
2
+
,正确。
答案
A
4.
(2019·
东北育才一模
)
为验证还原性
SO
2
>
Fe
2
+
>
Cl
-
,三组同学分别进行了下图实验,并对溶液
1
和溶液
2
中所含离子进行了检验,能证明上述还原性顺序的实验组有
(
)
A.
只有甲
B.
甲、乙
C.
甲、丙
D.
甲、乙、丙
答案
C
5.
(2019·
山东潍坊质检
)
二氧化硒
(SeO
2
)
是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓
HNO
3
或浓
H
2
SO
4
反应生成
SeO
2
以回收
Se
。涉及如下化学反应:
①
SeO
2
+
4KI
+
4HNO
3
===Se
+
2I
2
+
4KNO
3
+
2H
2
O
②
Se
+
2H
2
SO
4
(
浓
)===2SO
2
↑
+
SeO
2
+
2H
2
O
③
Se
+
4HNO
3
(
浓
)===SeO
2
+
4NO
2
↑
+
2H
2
O
下列有关叙述正确的是
(
)
A.SeO
2
、
H
2
SO
4
(
浓
)
、
I
2
的氧化性由强到弱的顺序是
H
2
SO
4
(
浓
)
>
SeO
2
>
I
2
B.
反应
①
中
Se
是氧化产物,
I
2
是还原产物
C.
反应
①
中每有
0.6 mol I
2
生成,转移电子数目为
2.4
N
A
D.
反应
②
、
③
中等量的
Se
消耗浓
H
2
SO
4
和浓
HNO
3
的物质的量之比为
2
∶
1
解析
根据氧化剂的氧化性强于氧化产物的氧化性可知,反应
①
中氧化性:
SeO
2
>
I
2
,反应
②
中氧化性:
H
2
SO
4
(
浓
)
>
SeO
2
,故
A
项正确;反应
①
中每生成
2 mol I
2
转移电子数为
4
N
A
,则生成
0.6 mol I
2
转移的电子数应为
1.2
N
A
,该反应中
Se
是还原产物,
I
2
是氧化产物,故
B
、
C
均错误;反应
②
、
③
中等量的
Se
消耗浓
H
2
SO
4
和浓
HNO
3
的物质的量之比为
1
∶
2
,
D
项错误。
答案
A
题后悟道
假设法突破氧化还原反应能否进行
先假设选项中的化学反应能够发生,依据此反应判断出还原性
(
或氧化性
)
的强弱,然后再与题目提供的还原性
(
或氧化性
)
强弱顺序对照,若二者表示的还原性
(
或氧化性
)
强弱顺序一致,则此反应能够发生;若不一致,则此反应不能进行。
题组三 氧化还原反应
“
先后律
”
的应用
6.
向仅含
Fe
2
+
、
I
-
、
Br
-
的溶液中通入过量的氯气,溶液中四种离子的物质的量与氯气的物质的量的关系如图所示,已知
b
-
a
=
5
,线
Ⅳ
表示一种含氧酸根离子的变化情况,且线
Ⅰ
和线
Ⅳ
表示的物质中含有相同的元素。下列说法正确的是
(
)
答案
D
7.
在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是
(
)
答案
D
题后悟道
反应先后两大规律
题组四 氧化还原反应
“
守恒律
”
的应用
8.
多硫化钠
Na
2
S
x
(
x
≥
2)
在结构上与
Na
2
O
2
、
FeS
2
、
CaC
2
等有相似之处。
Na
2
S
x
在碱性溶液中可被
NaClO
氧化为
Na
2
SO
4
,而
NaClO
被还原为
NaCl
,反应中
Na
2
S
x
与
NaClO
的物质的量之比为
1
∶
16
,则
x
的值是
(
)
A.5 B.4 C.3 D.2
答案
A
答案
A
10.(1)
在
CuSO
4
溶液中加入一定量的
Na
2
SO
3
和
NaCl
溶液加热,生成
CuCl
沉淀,写出生成
CuCl
的离子方程式
________________________________
____________________________________________________________
。
(2)
过量的
H
2
CrO
4
被
N
2
H
4
还原为
Cr
3
+
,同时放出无污染的气体,写出发生反应的离子方程式
____________________________________________________________
____________________________________________________________
;
氧化产物与还原产物的物质的量之比为
________
。
(3)
除去废液中的
AsCl
3
,是用次磷酸钠
(NaH
2
PO
2
)
还原
AsCl
3
,产生了棕色单质砷沉淀和
H
3
PO
3
。该反应的化学反应方程式为
______________________
____________________________________________________________
,
氧化剂和还原剂的物质的量之比为
________
,氧化产物是
________
。
(4)FeS
被水溶液中
Cl
2
氧化,氧化后的溶液中滴加
BaCl
2
有不溶解于盐酸的白色沉淀生成,则水溶液中
FeS
与
Cl
2
反应的离子方程式为
_______________
____________________________________________________________
。
题组五 新信息氧化还原反应方程式的书写
11.(1)
(2019·
山东日照一模
)
草酸钪
[Sc
2
(C
2
O
4
)
3
]
在空气中
“
灼烧
”
生成
Sc
2
O
3
的化学方程式为
____________________________________________________________
____________________________________________________________
。
(2)
(2019·
山东潍坊一模
)
从某废催化剂
(
含
ZnO
、
CuO
、
Fe
2
O
3
、石墨及
MnO
2
等
)
中回收金属并制取活性氧化锌的工艺流程如下
(
已知:
Zn
及其氧化物、氢氧化物的性质与
Al
及其相应化合物性质类似
)
:
“
氧化
”
时
Mn
2
+
被氧化的离子方程式为
_________________________
____________________________________________________________
。
“
中和、沉淀
”
时,若
pH
过高,则碱式碳酸锌的产率偏小。写出其反应的离子方程式
(
任写一个即可
)
:
______________________________________
____________________________________________________________
。
12.(1)
(2019·
山东青岛一模
)
三氯化六氨合钴
[Co(NH
3
)
6
]Cl
3
是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。下图是某科研小组以含钴废料
(
含少量
Fe
、
Al
等杂质
)
制取
[Co(NH
3
)
6
]Cl
3
的工艺流程:
写出加
“
适量
NaClO
3
”
发生反应的离子方程式
__________________
____________________________________________________________
。
(2)
(2019·
山东泰安一模
)
氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以
[Zn(NH
3
)
4
]
2
+
、
[Cu(NH
3
)
4
]
2
+
、
[Cd(NH
3
)
4
]
2
+
、
[AsCl
5
]
2
-
的形式存在。
“
氧化除杂
”
中,
[AsCl
5
]
2
-
转化为
As
2
O
5
胶体吸附聚沉除去,溶液始终接近中性,该反应的离子方程式为
_________________________________________
。
题后悟道
信息氧化还原反应方程式书写思维流程
析题干信息与流程图确定反应物、生成物
(1)
由流程图知氧化剂为
NaClO
3
,由
CoCl
2
·6H
2
O
知
Co
2
+
未被氧化,还原剂为
Fe
2
+
。由化合价知识可知还原产物为
Cl
-
,氧化产物为
Fe
3
+
。
(2)
由流程图可知氧化剂
H
2
O
2
―→
H
2
O
,由题干信息知还原剂为
[AsCl
5
]
2
-
―→
As
2
O
5
(
胶体
)
。