- 652.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时分层提升练 十二
硫及其重要化合物
一、选择题
1.(2019·孝感模拟)红葡萄酒营养丰富(含葡萄糖、氨基酸、维生素C等),常添加微量的二氧化硫,浓度一般小于40 mg·L-1,其目的是 ( )
A.二氧化硫有还原性,防止红葡萄酒中某营养成分被氧化
B.二氧化硫有氧化性,使红葡萄酒中维生素C还原
C.二氧化硫有酸性,是红葡萄酒的酸味添加剂
D.二氧化硫有漂白性,漂白红葡萄酒中其他颜色
【解析】选A。红葡萄酒中添加微量的二氧化硫,利用二氧化硫的还原性,防止红酒中的某些营养成分被氧化。
2.(2019·海南高考)我国古代典籍中有“石胆……浅碧色,烧之变白色者真”的记载,其中石胆是指 ( )
A.CuSO4·5H2O B.FeSO4·7H2O
C.ZnSO4·7H2O D.KAl(SO4)2·12H2O
【解析】选A。CuSO4·5H2O为蓝色,加热失去结晶水之后,变成白色的CuSO4,A项正确。
3.下列有关硫元素及其化合物的说法或描述正确的是 ( )
A.SO2使品红溶液褪色,与氯水使有色布条褪色,原理相同
B.大量燃烧化石燃料排放的废气中含SO2,造成大气污染,使雨水pH=5.6形成酸雨
C.SO2通入CuSO4与NaCl混合溶液产生白色沉淀CuCl,体现SO2的还原性
D.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
【解析】选C。SO2的漂白性是SO2与有色物质结合生成无色物质,氯水漂白是由于HClO的强氧化性,A错误;大量燃烧化石燃料排放的废气中含SO2,造成大气污染,使雨水pH<5.6形成酸雨,B错误;生成CuCl白色沉淀,铜的化合价降低,必然有一种元素的化合价升高,只能是SO2中+4价的硫被氧化,C正确;Cu与浓硫酸反应时,随着反应的进行,硫酸的浓度降低,稀硫酸不与铜反应,生成的SO2小于0.45 mol,D错误。
4.(2019·绵阳模拟)硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,溴水褪色,乙变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是 ( )
A.SO3 H2SO4 H2SO3 H2S S
B.SO2 H2SO3 H2SO4 SO2 SO3
C.SO3 H2SO4 H2SO3 SO2 Na2S2O3
D.SO2 H2SO3 H2SO4 H2S S
【解析】选D。硫黄在空气中燃烧生成SO2(甲),SO2溶于水得溶液H2SO3(乙),向乙溶液中滴加溴水生成H2SO4和HBr,在丙里加入Na2S生成气体H2S(丁),把H2S通入H2SO3得到沉淀S(戊)。
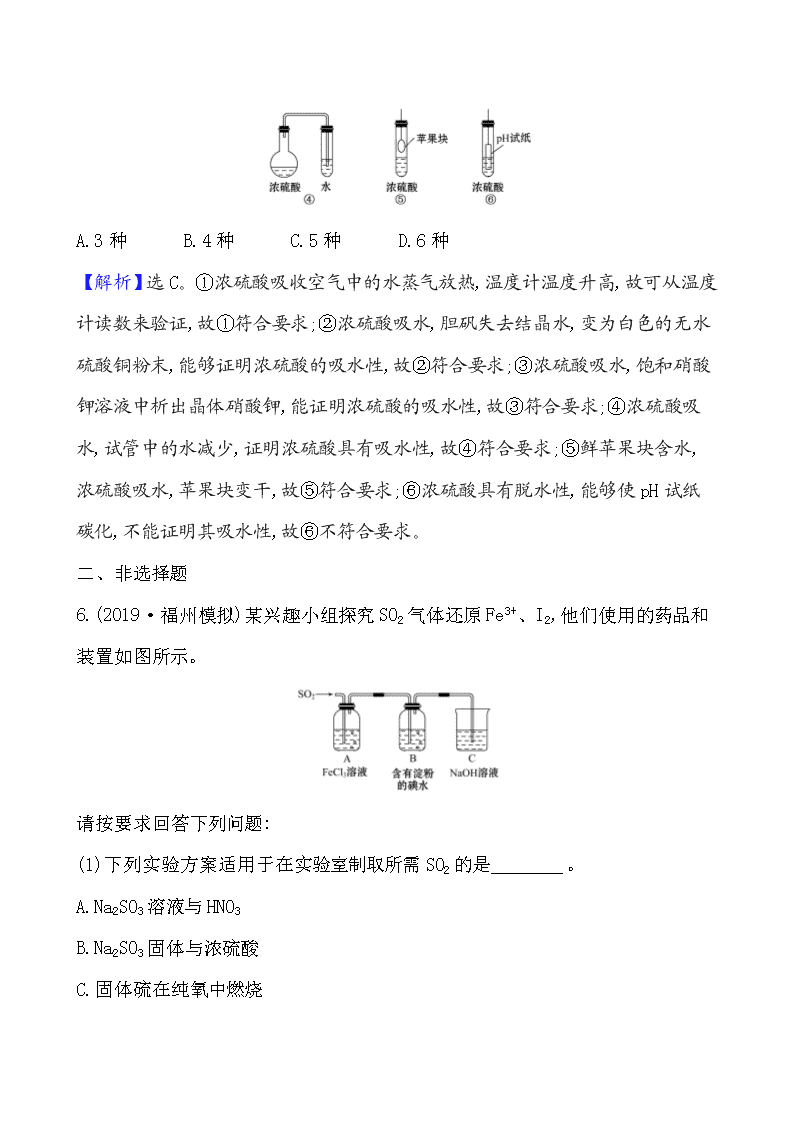
5.(2019·安阳模拟)在实验探究课上,同学们积极思考,设计以下实验方案用以验证浓硫酸的吸水性,其中在理论上可行的方案有几种 ( )
A.3种 B.4种 C.5种 D.6种
【解析】选C。①浓硫酸吸收空气中的水蒸气放热,温度计温度升高,故可从温度计读数来验证,故①符合要求;②浓硫酸吸水,胆矾失去结晶水,变为白色的无水硫酸铜粉末,能够证明浓硫酸的吸水性,故②符合要求;③浓硫酸吸水,饱和硝酸钾溶液中析出晶体硝酸钾,能证明浓硫酸的吸水性,故③符合要求;④浓硫酸吸水,试管中的水减少,证明浓硫酸具有吸水性,故④符合要求;⑤鲜苹果块含水,浓硫酸吸水,苹果块变干,故⑤符合要求;⑥浓硫酸具有脱水性,能够使pH试纸碳化,不能证明其吸水性,故⑥不符合要求。
二、非选择题
6.(2019·福州模拟)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示。
请按要求回答下列问题:
(1)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
(2)装置C的作用是____________________。如果有560 mL SO2气体(已折算为标准状况)进入C装置中,则C中50 mL NaOH溶液的物质的量浓度至少为________mol·L-1才能达到目的。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、________、洗涤、自然干燥。在这一系列操作中没有用到的仪器有(填序号)
_____________________________。
A.蒸发皿 B.分液漏斗 C.漏斗 D.玻璃棒 E.冷凝管
(4)在上述装置中通入过量的SO2,请设计实验验证SO2与Fe3+发生了氧化还原反应 _____________________________________________ __。
(5)本实验中能表明SO2的还原性比I-的还原性强的现象是_______________ _____, 其反应的离子方程式为______________________________________。
【解析】(1)A.硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错误;B.浓硫酸虽具有强氧化性,但不能氧化亚硫酸钠,故B正确;C.固体硫在纯氧中燃烧,操作不容易控制,故C错误。
(2)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫;如果有560 mL SO2气体(已折算为标准状况)物质的量==0.025 mol,进入C装置中发生反应为SO2+NaOH NaHSO3,则C中消耗氢氧化钠物质的量为0.025 mol,50 mL NaOH溶液的浓度至少为=0.5 mol·L-1。
(3)通过加热浓缩、冷却结晶、过滤、洗涤、自然干燥等操作即可从A中所得溶液提取晶体;蒸发使用仪器:A.蒸发皿;D.玻璃棒;过滤使用仪器:C.漏斗;D.玻璃棒。
(4)取反应后A中试液少许,加入KSCN溶液,不变红,说明溶液里不含有Fe3+,再加入新制的氯水,溶液变红,可知反应后A溶液中含有Fe2+,即可证明SO2与Fe3+发生了氧化还原反应。
(5)I2+SO2+2H2O2HI+H2SO4,则二氧化硫能使含有淀粉的碘水褪色,即说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,发生反应的离子方程式为SO2+I2+2H2OS+2I-+4H+。
答案:(1)B (2)除去尾气中的SO2,防止污染空气 0.5
(3)过滤 BE
(4)取反应后A中试液少许,加入KSCN溶液,不变红,再加入新制的氯水,溶液变红(合理即可)
(5)B中溶液的蓝色褪去 SO2+I2+2H2OS+2I-+4H+
7.(2019·长治模拟)某兴趣小组同学欲研究SO2的相关性质
(1)比较下表中的两组物质关系,第2组中物质X的化学式是________。
第1组
第2组
C、CO、CO2、H2CO3、Na2CO3、NaHCO3
S、SO2、SO3、X、Na2SO4、NaHSO4
(2)利用如图装置来检验SO2的性质。
①装置a中的现象是__________________; ______________(填“能”或“不能”)说明SO2有漂白性。
②若装置e中有40 mL 2.5 mol·L-1 NaOH溶液,反应后溶液增重4.8 g,则装置e中发生反应的总化学方程式是 __________________________________。
(3)该小组的甲、乙两位同学利用如图装置继续探究SO2及氯气漂白性:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液的颜色随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中品红溶液不褪色的原因:
__________________________________________(用离子方程式表示)。
②乙同学让品红溶液颜色变得越来越浅的方法是 __________________。
【解析】(1)第1组中碳元素的化合价依次升高,最后变成酸、正盐、酸式盐,第2组中硫元素的化合价升高到+6价,故X为硫酸。(2)①二氧化硫具有还原性,溴水具有氧化性,发生氧化还原反应,溴水褪色,不能说明SO2有漂白性。②若n(SO2)∶n(NaOH)=1∶2,发生反应:SO2+2NaOHNa2SO3+H2O;若n(SO2)∶n(NaOH)= 1∶1,发生反应:SO2+NaOHNaHSO3;装置e中有40 mL 2.5 mol·L-1 NaOH溶液,即n(NaOH)=0.1 mol,n(SO2)==0.075 mol;n(SO2)∶n(NaOH)=
0.075 mol∶0.1 mol=3∶4,所以产物为亚硫酸钠和亚硫酸氢钠;设生成亚硫酸钠物质的量为x mol、亚硫酸氢钠物质的量为y mol,则:x+y=0.075,2x+y=0.1,解得
x=0.025,y=0.05,即n(Na2SO3)∶n(NaHSO3)=1∶2,所以反应的化学方程式为3SO2+4NaOHNa2SO3+2NaHSO3+H2O。
(3)①氯气和二氧化硫在水溶液中恰好完全反应:Cl2+SO2+2H2O2HCl+H2SO4,生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色。②当通入的二氧化硫或氯气有剩余时,具有漂白性,能使品红溶液褪色。
答案:(1)H2SO4 (2)①溴水褪色 不能
②3SO2+4NaOHNa2SO3+2NaHSO3+H2O
(3)①SO2+Cl2+2H2OS+2Cl-+4H+
②控制SO2和Cl2进气的物质的量,使之不相等
一、选择题
1.(2019·成都模拟)有一白色粉末X,关于它的实验现象为:
则X的化学式可能为 ( )
A.Na2SO4 B.Na2CO3 C.(NH4)2SO4 D.Na2SO3
【解析】选D。用排除法,只有B、D项所示物质与H2SO4反应有气体产生;只有D项中产生的气体与NaOH反应生成盐可使溴水褪色,故只有D正确。
2.(2019·成都模拟)标准状况下,某同学向100 mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是 ( )
A.ab段反应是:SO2+2H2S3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol·L-1
D.b点对应的溶液导电性最强
【解析】选A。H2S具有还原性,SO2具有氧化性,二者发生反应2H2S+SO23S↓+2H2O,A正确;a处为H2S溶液,d处为H2SO3溶液,d处pH小于a处,可判断亚硫酸的酸性比氢硫酸酸性强,B错误;根据反应2H2S+SO23S↓+2H2O,由于通入112 mL SO2时pH=7,则n(H2S)=2n(SO2)=2×=0.01 mol,c(H2S)==
0.1 mol·L-1,C错误;b点pH=7,为纯水,导电性最弱,D错误。
【加固训练】
(2019·荆州模拟)将一定量的锌与100 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A为26.88 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1,则关于该反应下列叙述中错误的是 ( )
A.反应中共消耗Zn 91 g
B.气体A中SO2和H2的体积比为1∶1
C.硫酸分子的氧化性强于H+
D.反应中共转移2.4 mol电子
【解析】选A。测得反应后溶液中c(H+)=0.1 mol·L-1,说明硫酸有剩余,Zn完全反应,发生的反应是Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O,可能发生Zn+H2SO4
ZnSO4+H2↑,假设生成SO2的物质的量为x mol,则氢气物质的量为(-x) mol,消耗硫酸物质的量为(100×10-3×18.5-1×) mol,则有:(100×10-3×18.5-
1×)=2x+(-x),解得x=0.6,产生氢气物质的量为0.6 mol,A.根据上述反应,消耗Zn的质量为(0.6+0.6)×65 g=78 g,故A错误;B.根据上述分析,产生SO2和氢气体积比为0.6∶0.6=1∶1,故B说法正确;C.因为先产生SO2,后产生H2,说明硫酸分子的强氧化性强于H+,故C说法正确;D.根据A选项分析,转移电子物质的量为78× mol =2.4 mol,故D说法正确。
【方法规律】
锌和浓硫酸反应,先发生浓硫酸和锌的反应:Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O,后发生稀硫酸和锌的反应:Zn+H2SO4ZnSO4+H2↑。根据化学方程式,有Zn~SO2,Zn~H2,即参加反应的锌与生成气体的物质的量相等。
二、非选择题
3.二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O28SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2被催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:
______________________________________________________________。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是____________________________。
③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图所示装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 ___________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为__ ___________________________。
【解析】(1)反应中铁元素和硫元素的化合价均升高,两种元素均被氧化,11 mol O2参加反应生成8 mol SO2时转移电子44 mol,故转移2.75 mol电子时,生成的SO2在标准状况下的体积为×8×22.4 L=11.2 L。(2)①打开分液漏斗旋塞前,首先要打开分液漏斗上口的活塞,以利于分液漏斗中的液体顺利滴下。②反应停止后还要继续通入一段时间氧气,目的是将产物SO3以及未反应的SO2
全部赶至吸收装置。③装置D中增加的质量为SO3的质量,装置E中的沉淀为BaSO4,根据硫元素守恒,被氧化的SO2的物质的量为 mol,未被氧化的SO2的物质的量为 mol,故SO2的转化率为×100%。
(3)①SO2能将S2-氧化,生成硫单质。②方案Ⅰ,Cl-与Ag+反应可得到AgCl白色沉淀;方案Ⅱ中氯水可使品红溶液褪色;方案Ⅲ中产生白色沉淀可证明SO2与Cl2发生了氧化还原反应,反应的离子方程式为SO2+Cl2+2H2O4H++S+2Cl-。
答案:(1)Fe、S 11.2
(2)①打开分液漏斗上口的活塞,转动分液漏斗的旋塞,缓慢滴加
②使残留在装置中的SO2和SO3被充分吸收
③×100%
(3)①试管a中出现淡黄色浑浊
②Ⅲ SO2+Cl2+2H2O4H++S+2Cl-
4.(2019·北京高考)化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
①浓H2SO4与Cu反应的化学方程式是________________________________。
②试剂a是____________________________________________________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分
①写出Ag2SO3溶于氨水的离子方程式:___________________________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是_______________________________________________。
(3)根据沉淀F的存在,推测S的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,S被氧化为S进入D。
实验三:探究S的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________;取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______________________________________________。
②实验三的结论:_______________________________________________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是______________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和S生成。
(6)根据上述实验所得结论:________________________________。
【解析】(1)①铜和浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。
②由于反应时逸出的SO2气体可能带出少量硫酸,所以试剂a应为除杂试剂,可用饱和NaHSO3溶液。
(2)①Ag2SO3溶于氨水得到Ag(NH3,离子方程式为:Ag2SO3+4NH3·H2O 2Ag(NH3+S+4H2O。
②推测沉淀D为BaSO3,加过量稀盐酸溶解得滤液E和少量沉淀F,则E中可能含有溶解的SO2,可加入双氧水溶液,若加入双氧水溶液,可以将亚硫酸(或亚硫酸根离子)氧化为硫酸根离子,从而生成白色的硫酸钡沉淀,则证明B中含有Ag2SO3。
(3)①加入过量盐酸产生白色沉淀,说明含有Ag+;Ag2SO4微溶于水,若产生Ag2SO4,则溶液中会有微量S,加入BaCl2产生硫酸钡沉淀,与实验现象不符。
②由实验三可以得出:实验一中SO2未被氧化;实验二中S被氧化为S进入D。
(4)根据以上分析,二氧化硫与硝酸银溶液反应生成亚硫酸银沉淀,离子方程式为:2Ag++SO2+H2O Ag2SO3↓+2H+。
(6)该实验的结论为:二氧化硫与硝酸银溶液既能发生沉淀反应生成亚硫酸银,又能发生氧化还原反应,沉淀反应的速率大于氧化还原反应的速率。
答案:(1)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
②饱和NaHSO3溶液
(2)①Ag2SO3+4NH3·H2O2Ag(NH3+S+4H2O ②H2O2溶液,产生白色沉淀
(3)①Ag+ Ag2SO4溶解度大于BaSO4,没有BaSO4沉淀时,必定没有Ag2SO4
②途径1不产生S,途径2产生S
(4)2Ag++SO2+H2O Ag2SO3↓+2H+
(6)实验条件下:SO2与AgNO3溶液生成Ag2SO3的速率大于生成Ag和S的速率(或碱性溶液中S更易被氧化为S)
关闭Word文档返回原板块