- 246.00 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学实验基础
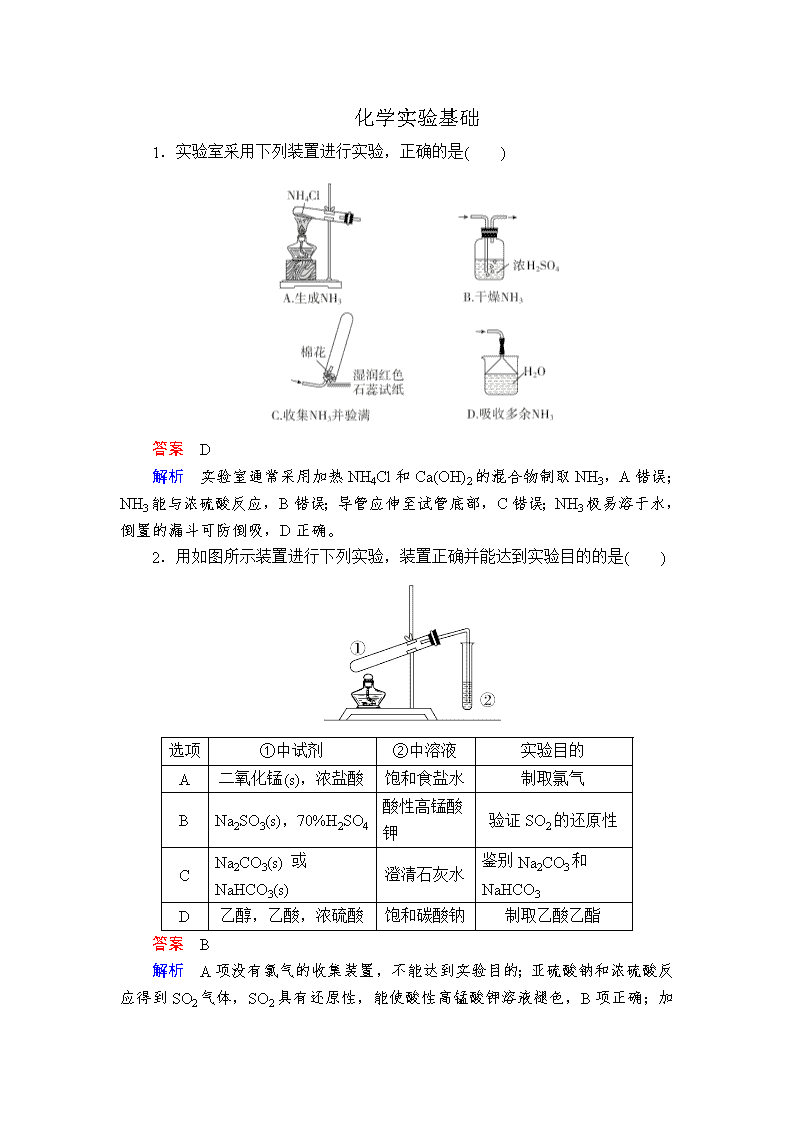
1.实验室采用下列装置进行实验,正确的是( )
答案 D
解析 实验室通常采用加热 NH4Cl 和 Ca(OH)2 的混合物制取 NH3,A 错误;
NH3 能与浓硫酸反应,B 错误;导管应伸至试管底部,C 错误;NH3 极易溶于水,
倒置的漏斗可防倒吸,D 正确。
2.用如图所示装置进行下列实验,装置正确并能达到实验目的的是( )
选项 ①中试剂 ②中溶液 实验目的
A 二氧化锰(s),浓盐酸 饱和食盐水 制取氯气
B Na2SO3(s),70%H2SO4
酸性高锰酸
钾
验证 SO2 的还原性
C
Na2CO3(s) 或
NaHCO3(s)
澄清石灰水
鉴别 Na2CO3 和
NaHCO3
D 乙醇,乙酸,浓硫酸 饱和碳酸钠 制取乙酸乙酯
答案 B
解析 A 项没有氯气的收集装置,不能达到实验目的;亚硫酸钠和浓硫酸反
应得到 SO2 气体,SO2 具有还原性,能使酸性高锰酸钾溶液褪色,B 项正确;加
热固体时,大试管口应略向下倾斜,C 项错误;制取乙酸乙酯时,为防止倒吸,
导管不能插入饱和碳酸钠溶液液面以下,D 项错误。
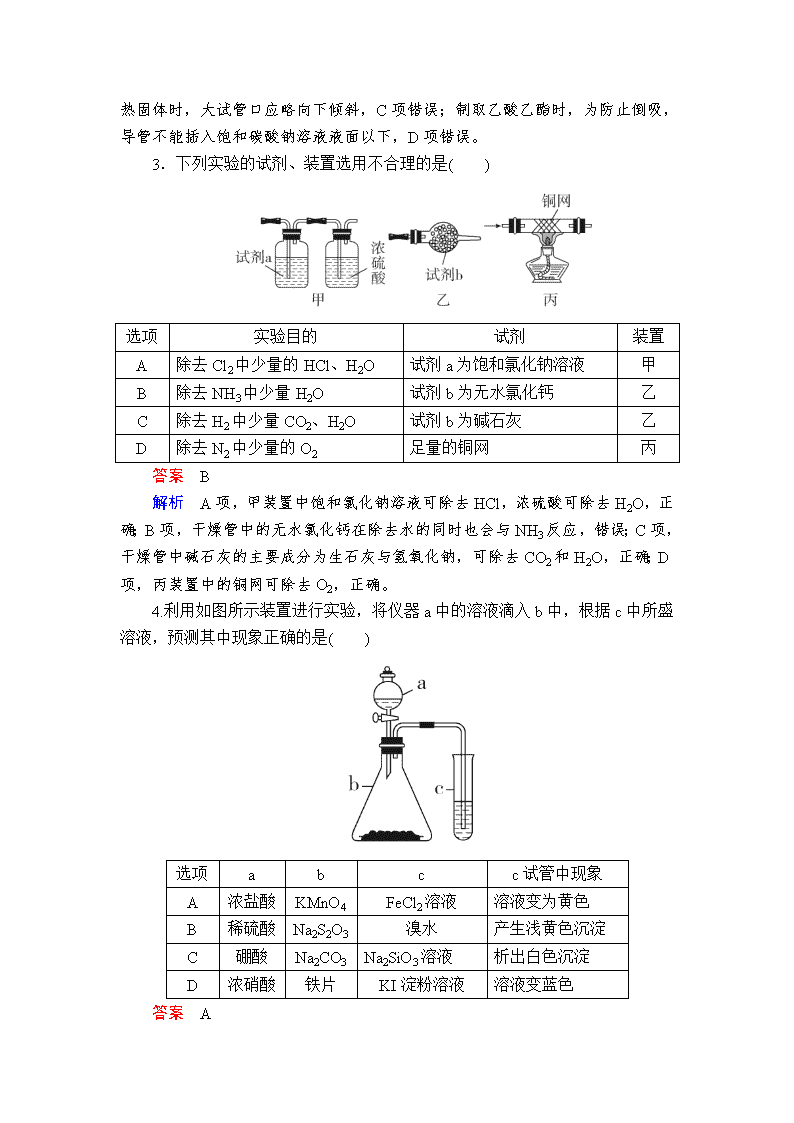
3.下列实验的试剂、装置选用不合理的是( )
选项 实验目的 试剂 装置
A 除去 Cl2 中少量的 HCl、H2O 试剂 a 为饱和氯化钠溶液 甲
B 除去 NH3 中少量 H2O 试剂 b 为无水氯化钙 乙
C 除去 H2 中少量 CO2、H2O 试剂 b 为碱石灰 乙
D 除去 N2 中少量的 O2 足量的铜网 丙
答案 B
解析 A 项,甲装置中饱和氯化钠溶液可除去 HCl,浓硫酸可除去 H2O,正
确;B 项,干燥管中的无水氯化钙在除去水的同时也会与 NH3 反应,错误;C 项,
干燥管中碱石灰的主要成分为生石灰与氢氧化钠,可除去 CO2 和 H2O,正确;D
项,丙装置中的铜网可除去 O2,正确。
4.利用如图所示装置进行实验,将仪器 a 中的溶液滴入 b 中,根据 c 中所盛
溶液,预测其中现象正确的是( )
选项 a b c c 试管中现象
A 浓盐酸 KMnO4 FeCl2 溶液 溶液变为黄色
B 稀硫酸 Na2S2O3 溴水 产生浅黄色沉淀
C 硼酸 Na2CO3 Na2SiO3 溶液 析出白色沉淀
D 浓硝酸 铁片 KI淀粉溶液 溶液变蓝色
答案 A
解析 浓盐酸和 KMnO4 反应生成 Cl2,Cl2 通入 FeCl2 溶液中,发生反应:
Cl2+2FeCl2===2FeCl3,因此 c 中溶液变为黄色,A 项正确。稀硫酸和 Na2S2O3
发生反应:H2SO4+Na2S2O3===Na2SO4+H2O+S↓+SO2↑,SO2 通入溴水中发
生反应:SO2+Br2+2H2O===H2SO4+2HBr,因此 c 试管中无浅黄色沉淀生成,
B 项错误;硼酸的酸性比碳酸弱,硼酸加入 Na2CO3 溶液中,不产生 CO2,因此
Na2SiO3 溶液中无白色沉淀析出,C 项错误;常温下浓硝酸使铁片钝化,无 NO2
气体生成,因此 KI淀粉溶液不会变蓝色,D 项错误。
5.利用实验器材(规格和数量不限)能完成相应实验的一项是( )
选项 实验器材(省略夹持装置) 相应实验
A 烧杯、玻璃棒、蒸发皿 CuSO4 溶液的浓缩结晶
B 烧杯、玻璃棒、胶头滴管、滤纸 用盐酸除去 BaSO4 中少量 BaCO3
C 烧杯、玻璃棒、胶头滴管、容量瓶
用固体 NaCl 配制 0.5 mol·L-1 的溶
液
D
烧杯、玻璃棒、胶头滴管、分液漏
斗
用溴水和 CCl4 除去 NaBr 溶液中少
量 NaI
答案 D
解析 CuSO4 溶液的浓缩结晶需要酒精灯、蒸发皿和玻璃棒,缺少酒精灯,
故 A 错误;BaCO3 可溶于盐酸,BaSO4 不溶于盐酸,充分反应后进行过滤即可,
缺少漏斗,故 B 错误;用固体 NaCl 配制 0.5 mol·L-1 的溶液,根据配制溶液的体
积选择合适的容量瓶,用托盘天平称取 NaCl 固体,缺少托盘天平,故 C 错误;
溴水将 NaI 氧化成 I2,再用 CCl4 萃取生成的 I2 和过量的 Br2 并进行分液,不缺少
实验器材,D 正确。
6.下列实验装置正确且能达到实验目的的是( )
A.用图 1 所示装置制取少量 Cl2
B.图 2 所示装置可证明非金属性:Cl>C>Si
C.图 3 所示装置中水不能持续流下,说明装置气密性良好
D.用图 4 所示装置测定镁铝合金中铝的质量分数
答案 D
解析 MnO2 与浓盐酸共热制取 Cl2,A 项错误;非金属性越强,其最高价氧
化物对应的水化物的酸性越强,但 HCl 不是 Cl 的最高价含氧酸,因此不能用于
判断 Cl 的非金属性强弱,B 项错误;橡皮管的作用是使烧瓶内和分液漏斗上方
的压强相等,有利于水持续流下,因此不会出现水不能持续流下的情况,C 项错
误;铝和 NaOH 溶液发生反应:2Al+2OH-+2H2O===2AlO-
2 +3H2↑,而镁不
与 NaOH 溶液反应,故经过滤、洗涤、干燥、称量可得镁的质量,然后用镁铝合
金的总质量减去镁的质量即可得到铝的质量,从而可求出铝的质量分数,D 项正
确。
7.下列实验设计的步骤及现象均正确的是( )
选项 实验目的 实验步骤及现象
A 证明氯水有酸性 试样――――――――→
滴加紫色石蕊溶液
溶液变红色,且长时间不变
B
检验某红棕色气体是
否为溴蒸气 试样――――――――→
通入淀粉 KI 溶液
观察溶液是否变蓝
C
证明酸性条件下 H2O2
氧化性比 I2 强
NaI 溶液――――――――→
加入 30%H2O2 溶液
―――――――→
加入稀硝酸及淀粉
溶液变
蓝色
D
提纯含有少量乙酸的
乙酸乙酯
试样 ―――――――――――→
加入过量饱和 Na2CO3 溶液
――――――→
静置分液
较纯净
乙酸乙酯
答案 D
解析 A 项,氯水中的 HClO 具有漂白性,滴入紫色石蕊溶液先变红后褪色,
错误;B 项,NO2 气体干扰检验,错误;C 项,HNO3 本身具有强氧化性,应用
H2SO4 酸化,错误。
8.物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
选
项
物质及其杂质 检验 除杂
A Cl2(HCl) 湿润的淀粉KI 试纸 饱和食盐水
B NO(NO2)
观察颜色或湿润的淀粉
KI 试纸
水
C CO2(HCl) AgNO3 溶液(含稀硝酸)
饱和 Na2CO3 溶
液
D
NaHCO3 溶液
(Na2CO3)
Ca(OH)2 溶液 过量 CO2
答案 B
解析 A 项,湿润的淀粉KI 试纸只能检验 Cl2,不能检验 HCl,错误;B 项,
NO2 为红棕色,可通过观察气体颜色检验,NO2 溶于水生成 NO 和硝酸(遇到湿润
的淀粉KI 试纸变色),也可以用水除杂,正确;C 项,含稀硝酸的 AgNO3 溶液
可鉴别溶液中的 Cl-,混合气体通入含稀硝酸的 AgNO3 溶液中产生白色沉淀,
CO2 和 HCl 均与 Na2CO3 溶液反应,不能除杂,应选饱和 NaHCO3 溶液除杂,错
误;D 项,二者均可与 Ca(OH)2 溶液反应生成白色沉淀,不能检验杂质 Na2CO3,
但 Na2CO3 溶液与 CO2 反应生成 NaHCO3,可除杂,错误。
9.下表中根据实验操作和现象所得出的结论正确的是( )
选项 实验操作 实验现象 结论
A
蘸有浓氨水的玻璃
棒靠近 X
有白烟产生 X 一定是浓盐酸
B
KIO3 溶液中加入 HI
溶液,并加入淀粉
溶液变蓝色 KIO3 的氧化性比 I2 的
强
C
强酸性溶液 Y 中加
入 Ba(NO3)2 溶液,
静置后
再加入 KSCN 溶液
先有白色沉淀,后溶液
又变红
Y 中一定含有 SO 2-
4 和
Fe3+
D
C2H5OH 与浓硫酸
混合后加热到 170
℃
制得的气体使酸 KMn
O4 溶液褪色
一定是制得的乙烯使
酸性KMnO4溶液褪色
答案 B
解析 能与氨气反应产生白烟的有浓盐酸、浓硝酸等,A 项错误;KIO3 与
HI 发生反应:IO-
3 +5I-+6H+===3I2+3H2O,所以 KIO3 的氧化性比 I2 的强,B
项正确;溶液中含有 Fe2+和 SO 2-
4 时也有题述现象(在酸性条件下 NO -
3 能把 Fe2+
氧化成 Fe3+),C 项错误;气体中还含有乙醇、SO2 等,乙醇和 SO2 都能使酸性高
锰酸钾溶液褪色,D 项错误。
10.下列实验操作、实验现象和实验结论均正确的是( )
选项 实验操作 实验现象 实验结论
A
向一定浓度 CuSO4 溶液中通入
H2S 气体
出现黑色沉淀 H2S 酸性比 H2SO4
强
B
常温下,相同铝片分别投入足
量稀、浓硫酸中
浓硫酸中铝片先溶
解完
反应物浓度越大,
反应速率越大
C
2 mL 0.1 mol·L-1 MgCl2 溶液
中滴加 2 滴 1 mol·L-1 NaOH 溶
液,再滴加 2 滴 0.1 mol·L-1
FeCl3 溶液
先生成白色沉淀,
后生成红褐色沉淀
Ksp[Mg(OH)2]>Ksp[
Fe(OH)3]
D
向 2 mL 2% CuSO4 溶液中加入
几滴 1%NaOH 溶液,振荡后加
入几滴有机物 X 溶液,加热
未出现砖红色沉淀 X 不可能是葡萄糖
答案 C
解析 向 CuSO4 溶液中通入 H2S 气体,出现黑色沉淀,发生反应:CuSO4
+H2S===CuS↓+H2SO4,该反应能发生是因为生成了不溶于 H2SO4 的 CuS 沉淀,
H2SO4 的酸性比 H2S 强,A 错误;常温下,浓硫酸能使铝片钝化,铝片的表面形
成一层致密氧化膜,阻止内部铝进一步反应,故稀硫酸中铝片先溶解完,B 错误;
先生成白色沉淀,后生成红褐色沉淀,说明 Mg(OH)2 沉淀转化为 Fe(OH)3 沉淀,
故 Ksp[Mg(OH)2] >Ksp[Fe(OH)3],C 正确;葡萄糖与新制氢氧化铜的反应,需要在
较强的碱性条件下进行,配制新制氢氧化铜时 NaOH 要过量,D 错误。
11.利用如图所示装置进行下列实验,将 X 溶液逐滴加入到 Y 固体中,下
列关于试管中的现象描述不正确的是( )
选
项 X 溶液 Y 固体 Z 溶液 现象
A 稀硫酸 Na2O2 氢硫酸
产生淡黄
色沉淀
B 浓氨水 碱石灰
硝酸银
溶液
先产生白
色沉淀,后
沉淀消失
C 浓硝酸 Cu 硅酸钠 产生白色
溶液 沉淀
D 浓盐酸 MnO2
淀粉
KI
溶液
溶液变蓝
答案 D
解析 稀硫酸与过氧化钠反应生成氧气,氧气将 H2S 氧化生成硫单质,试管
中产生淡黄色沉淀,A 正确;浓氨水与碱石灰反应生成氨气,氨气与硝酸银溶液
反应先生成氢氧化银白色沉淀,继续通入氨气生成银氨络离子,沉淀溶解,B 正
确;铜与浓硝酸反应产生二氧化氮,二氧化氮溶于水生成硝酸,硝酸与硅酸钠溶
液反应生成硅酸白色沉淀,C 正确;浓盐酸与二氧化锰制取氯气的反应需在加热
条件下进行,D 错误。