- 810.20 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第16讲 元素周期律和元素周期表
目标要求 1.认识元素性质与元素在周期表中位置的关系。2.结合有关数据和实验事实认识原子结构、元素性质呈周期性变化的规律,构建元素周期律。3.知道元素周期表的结构,以第3周期的钠、镁、铝、硅、磷、硫、氯以及碱金属和卤族元素为例,了解同周期和同主族元素性质的递变规律。体会元素周期律(表)在学习元素化合物知识与科学研究中的重要作用。4.认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性变化的原因。5.知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
1.元素周期表的结构
(1)原子序数
按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
(2)编排原则
①周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
②族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵列。
(3)元素周期表的结构
元素周期表
理解应用
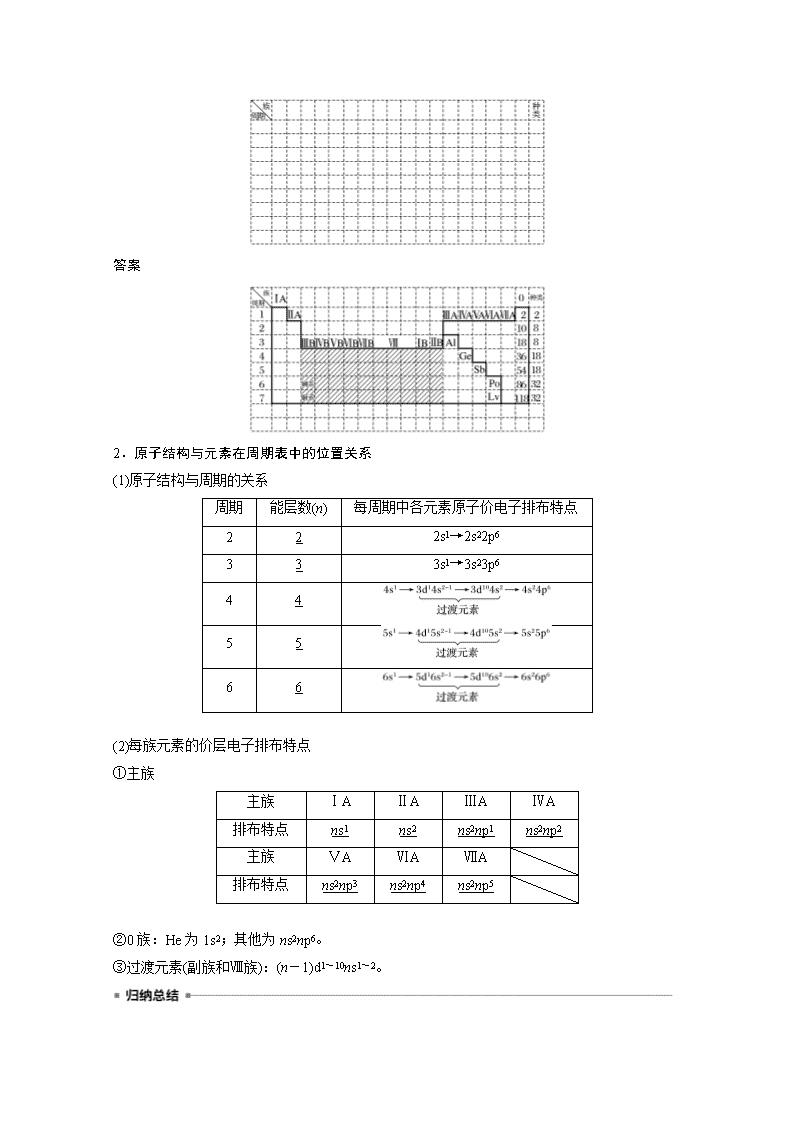
请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题:
(1)标出族序数。
(2)画出金属与非金属的分界线,写出分界线处金属的元素符号,并用阴影表示出过渡元素的位置。
(3)写出各周期元素的种类。
(4)写出稀有气体元素的原子序数。
答案
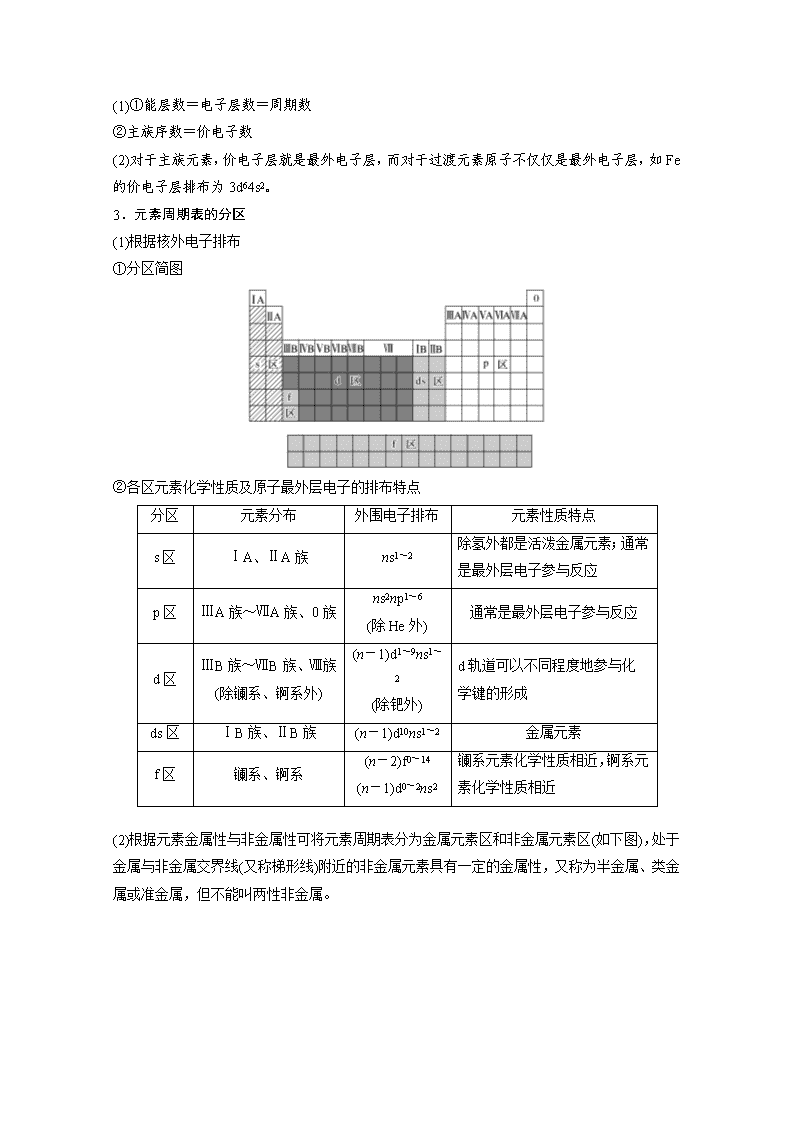
2.原子结构与元素在周期表中的位置关系
(1)原子结构与周期的关系
周期
能层数(n)
每周期中各元素原子价电子排布特点
2
2
2s1→2s22p6
3
3
3s1→3s23p6
4
4
5
5
6
6
(2)每族元素的价层电子排布特点
①主族
主族
ⅠA
ⅡA
ⅢA
ⅣA
排布特点
ns1
ns2
ns2np1
ns2np2
主族
ⅤA
ⅥA
ⅦA
排布特点
ns2np3
ns2np4
ns2np5
②0族:He为1s2;其他为ns2np6。
③过渡元素(副族和Ⅷ族):(n-1)d1~10ns1~2。
(1)①能层数=电子层数=周期数
②主族序数=价电子数
(2)对于主族元素,价电子层就是最外电子层,而对于过渡元素原子不仅仅是最外电子层,如Fe的价电子层排布为3d64s2。
3.元素周期表的分区
(1)根据核外电子排布
①分区简图
②各区元素化学性质及原子最外层电子的排布特点
分区
元素分布
外围电子排布
元素性质特点
s区
ⅠA、ⅡA族
ns1~2
除氢外都是活泼金属元素;通常是最外层电子参与反应
p区
ⅢA族~ⅦA族、0族
ns2np1~6
(除He外)
通常是最外层电子参与反应
d区
ⅢB族~ⅦB族、Ⅷ族(除镧系、锕系外)
(n-1)d1~9ns1~2
(除钯外)
d轨道可以不同程度地参与化学键的形成
ds区
ⅠB族、ⅡB族
(n-1)d10ns1~2
金属元素
f区
镧系、锕系
(n-2)f0~14
(n-1)d0~2ns2
镧系元素化学性质相近,锕系元素化学性质相近
(2)根据元素金属性与非金属性可将元素周期表分为金属元素区和非金属元素区(如下图),处于金属与非金属交界线(又称梯形线)附近的非金属元素具有一定的金属性,又称为半金属、类金属或准金属,但不能叫两性非金属。
(1)元素周期表中位于金属与非金属分界线附近的元素属于过渡元素(×)
(2)第ⅠA族全部是金属元素(×)
(3)两短周期元素原子序数相差8,则周期数一定相差1(√)
(4)s区全部是金属元素(×)
(5)第4周期元素中,锰原子价电子层中未成对电子数最多(×)
(6)价电子排布为5s25p1的元素位于第5周期ⅠA族,是s区元素(×)
(7)最外层有2个未成对电子的可能是ns2np2或ns2np4。短周期元素中分别为C、Si和O、S(√)
深度思考
(1)根据第4周期元素原子核外电子排布特点,回答下列问题:
①价电子层有2个未成对电子的有________;有3个未成对电子的有________。
②未成对电子数与周期数相等的元素价电子排布式________。
答案 ①Ge、Se、Ti、Ni As、V、Co ②3d64s2
(2)第4周期中,未成对电子数最多的元素是________(填名称)。
①它位于________族。
②核外电子排布式是________________________________________________________。
③它有________个能层,________个能级,________种运动状态不同的电子。
④价电子排布式:________,价电子轨道表示式:__________________________________。
⑤属于________区。
答案 铬 ①ⅥB
②1s22s22p63s23p63d54s1(或[Ar]3d54s1)
③4 7 24
④3d54s1 ⑤d
题组一 元素周期表结构
1.长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
A.第9列元素中没有非金属元素
B.只有第2列的元素原子最外层电子排布式为ns2
C.第4周期第9列元素是铁元素
D.第10、11列为ds区
答案 A
解析 第9列元素是Ⅷ族元素,都是金属元素,没有非金属元素,A项正确;第2列元素原子的最外层电子排布式为ns2,此外He的核外电子排布式是1s2,B项错误;第4周期第9列元素是Co元素,C项错误;第11、12列元素为ds区,D项错误。
2.(2020·南京月考)如图为元素周期表中前4周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( )
A.5x+10 B.5x
C.5x+14 D.5x+16
答案 A
元素周期表中元素原子序数的序差规律
(1)同周期ⅡA族与ⅢA族元素的原子序数之差有以下三种情况:第2、3周期(短周期)相差1,第4、5周期相差11,第6、7周期相差25。
(2)相邻周期,同一主族元素的原子序数可能相差2、8、18、32。若A、B是同主族相邻周期元素,A、B所在周期分别有m和n种元素。如图:
当A、B在ⅠA或ⅡA族时,y=x+m。A、B在ⅢA~0族时,y=x+n。
题组二 原子结构与周期表的关系
3.某元素原子外围电子排布式为3d54s2,其应在( )
A.第4周期ⅡA族 B.第4周期ⅡB族
C.第4周期ⅦA族 D.第4周期ⅦB族
答案 D
解析 价电子排布式为3d54s2的元素,原子核外电子排布式为[Ar]3d54s2的元素,其质子数为25,为Mn元素,则25-2-8-8=7,处于第4周期第7列,故处于周期表中第4周期ⅦB族。
4.(2019·济宁期末)下列有关金属钛的叙述不正确的是( )
A.钛的原子序数为22
B.钛位于元素周期表第4周期
C.钛原子核外电子排布式为1s22s22p63s23p63d4
D.钛属于过渡元素
答案 C
解析 依据元素周期表结构,钛是22号元素,选项A正确;钛位于第4周期ⅣB族,它属于过渡元素,选项B、D正确;依据构造原理,4s能级能量低于3d能级,故应首先排满4s后再排3d,正确的核外电子排布式为1s22s22p63s23p63d24s2,选项C不正确。
5.M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)写出M、R的价电子排布式:M________、R____________________________________。
(2)写出X、Y的价电子轨道表示式:X__________________、Y________________。
(3)写出Z的核外电子排布式:__________________,Z的核外未成对电子数为_________。
答案 (1)2s22p4 3s1
(2)
(3)1s22s22p63s23p63d54s1(或[Ar]3d54s1) 6
解析 根据题目给出的M、R和X的信息确定,M是氧元素,R是钠元素,X是硫元素。根据M、R、X、Y为原子序数依次增大的短周期主族元素确定Y是氯元素。根据Z的基态原子4s和3d轨道半充满,则Z元素原子的核外有24个电子,是铬元素。
1.电离能
(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号:I1,单位:kJ·mol-1。
(2)电离能的应用规律
①判断元素金属性的强弱
第一电离能越小,金属越容易失去电子,金属性越强;反之越弱。
②判断元素的化合价(I1、I2……表示各级电离能)
如果某元素的In+1≫In,则该元素的常见化合价为+n。如钠元素I2≫I1,
所以钠元素的化合价为+1。
③判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐级增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
④反映元素原子的核外电子排布特点
同周期元素从左向右,元素的第一电离能并不是逐渐增大的,当元素原子的核外电子排布是全空、半充满和全充满状态时,第一电离能就会反常的大。
理解应用
(1)按要求回答下列问题
①第3周期所有元素的第一电离能(I1)大小顺序为___________________(用元素符号表示)。
②Na的逐级电离能中有________次突跃。分别是哪级电离能发生突跃?________、________。
③F、Cl、Br、I的第一电离能由大到小的顺序为____________________________________,电负性由大到小的顺序为________________。
答案 ①Na<Al<Mg<Si<S<P<Cl<Ar
②2 I2≫I1 I10≫I9
③F>Cl>Br>I F>Cl>Br>I
(2)已知某主族元素的逐级电离能为I1=500 kJ·mol-1、I2=4 600 kJ·mol-1,I3=6 900 kJ·mol-1,I4=9 500 kJ·mol-1,可推知该元素可能在哪一族?最高化合价可能为多少?
答案 ⅠA族,+1
(3)[2017·全国卷Ⅱ,35(2)]元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第2周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是________________________________________;
氮元素的E1呈现异常的原因是__________________________________________________。
答案 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N的2p能级处于半充满状态,具有稳定性,故不易结合一个电子
解析 根据图示,电子亲和能增大(除N外),同周期从左向右非金属性增强,得电子能力增强,因此同周期自左而右电子亲和能增大;氮元素的2p能级达到半充满状态,原子相对稳定,不易得到1个电子。
2.电负性
(1)含义:元素的原子在化合物中吸引键合电子能力的标度。元素的电负性越大,
表示其原子在化合物中吸引键合电子的能力越强。
(2)电负性的应用
理解应用
下表是某些元素的电负性值:
元素符号
Li
Be
B
C
O
F
Na
Al
Si
P
S
Cl
电负性值
1.0
1.5
2.0
2.5
3.5
4.0
0.9
1.5
1.8
2.1
2.5
3.0
(1)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围________________。
(2)请归纳元素的电负性和金属性、非金属性的关系是________________________________
_________________________________________________。
(3)推测AlF3、AlCl3、AlBr3是离子化合物还是共价化合物:
AlF3__________________,AlCl3_________________________,AlBr3__________________。
答案 (1)0.9~1.5
(2)非金属性越强,电负性越大;金属性越强,电负性越小
(3)离子化合物 共价化合物 共价化合物
3.原子结构与元素性质的递变规律
项目
同周期(从左→右)
同主族(从上→下)
原子核外电子排布
能层数相同,最外层电子数逐渐增多
最外层电子数相同,能层数递增
原子半径
逐渐减小(0族除外)
逐渐增大
元素主要化合价
最高正价由+1→+7(O、F除外),最低负价=由-4→
最高正价=主族序数(O、F除外)
-1
,非金属元素最低负价=主族序数-8
原子得失电子能力
得电子能力逐渐增强;失电子能力逐渐减弱
得电子能力逐渐减弱;失电子能力逐渐增强
第一电离能
增大的趋势
逐渐减小
电负性
逐渐增大
逐渐减小
元素的金属性、非金属性
金属性逐渐减弱;非金属性逐渐增强
金属性逐渐增强;非金属性逐渐减弱
元素周期律
4.对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如。
5.实验法比较元素金属性和非金属性
(1)元素的金属性比较
①依最高价氧化物对应水化物的碱性强弱比较:碱性强的对应元素金属性强。
②依单质与水、酸反应的难易或剧烈程度:越易反应或反应越剧烈,对应元素金属性越强。
③依单质的还原性强弱:还原性越强,对应元素的金属性越强。
④依阳离子氧化性的强弱:氧化性越弱,对应元素的金属性越强。
⑤依单质与同一物质反应的难易程度:越易进行反应,对应元素的金属性越强。
⑥依原电池正负极:一般来说,作负极的金属对应元素的金属性强。
(2)元素的非金属性比较
①依最高价氧化物对应水化物的酸性强弱比较:酸性强的对应元素非金属性强。
②依单质与H2反应的难易或剧烈程度:越易反应或反应越剧烈,对应元素非金属性越强。
③依单质的氧化性强弱:氧化性越强,对应元素的非金属性越强。
④依简单阴离子的还原性强弱:还原性越弱,对应元素的非金属性越强。
⑤依单质与同一物质反应的难易程度:越易进行反应,对应元素的非金属性越强。
⑥依置换反应:非金属性较强的元素单质能置换出非金属性较弱的元素单质。
题组一 微粒半径的比较
1.比较下列微粒半径大小(用“>”或“<”填空):
(1)Na________Mg________Cl。
(2)Li________Na________K。
(3)Na+________Mg2+________Al3+。
(4)F-________Cl-________Br-。
(5)Cl-________O2-________Na+________Mg2+。
(6)Fe2+________Fe3+。
答案 (1)> > (2)< < (3)> > (4)< < (5)> > > (6)>
“三看”法快速判断简单微粒半径的大小
一看电子层数:最外层电子数相同时,电子层数越多,半径越大。
二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
题组二 金属性、非金属性的比较(不定项选择题)
2.(2020·石家庄期末)下列有关性质的比较中正确的是( )
A.碱性:NaOHHCl>PH3
C.原子半径:S>O>F
D.酸性:HClO>HNO3>H2CO3
答案 BC
解析 金属性:Na>Mg>Al,故碱性:NaOH>Mg(OH)2>Al(OH)3,A项错误;非金属性:F>Cl>P,稳定性:HF>HCl>PH3,B项正确;同周期主族元素随原子序数增大,原子半径逐渐减小,因此原子半径:O>F,C项正确;元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,酸性应为HClO4>HNO3,而HClO是弱酸,D项错误。
3.下列叙述中金属M的活泼性肯定比金属N的活泼性强的是( )
A.M原子的最外层电子数比N原子的最外层电子数少
B.常温时,M能从水中置换出氢,而N不能
C.1 mol M从酸中置换H+生成的H2比1 mol N从酸中置换H+生成的H2多
D.M的氧化物对应水化物的碱性比N的氧化物对应水化物的碱性强
答案 B
解析 最外层电子数的多少以及从酸中置换出H2的多少与金属元素的金属性强弱无关,A、C两项错误;金属的活泼性越强,越易与水反应,常温时,M能从水中置换出氢,而N不能,说明金属的活泼性M比N强,B
项正确;由元素的最高价氧化物对应水化物的碱性强弱来判断金属性的强弱,D项错误。
4.下列事实不能说明元素的金属性或非金属性相对强弱的是( )
选项
事实
结论
A
与冷水反应,Na比Mg强烈
金属性:Na>Mg
B
Ca(OH)2的碱性强于Mg(OH)2
金属性:Ca>Mg
C
SO2与NaHCO3溶液反应生成CO2
非金属性:S>C
D
t ℃时,Br2+H22HBr K=5.6×107
I2+H22HI K=43
非金属性:Br>I
答案 C
解析 C项,根据事实可知,H2SO3比H2CO3酸性强,但H2SO3不是最高价含氧酸,故不能说明非金属性:S>C。
题组三 电离能与电负性的应用
5.(2019·青岛模拟)表1是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
表1
(1)元素p为26号元素,请写出其基态原子电子排布式:______________________。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
________________________________________________________________________。
(3)o、p两元素的部分电离能数据如表2:
元素
电离能/kJ·mol-1
o
p
I1
717
759
I2
1 509
1 561
I3
3 248
2 957
表2
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________________________。
(4)第3周期8种元素单质熔点高低的顺序如图1所示,其中电负性最大的是________(填图1中的序号)。
(5)表1中所列的某主族元素的电离能情况如图2所示,则该元素是__________(填元素符号)。
答案 (1)1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(2)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量 (3)Mn2+的3d轨道电子排布为半充满状态,比较稳定 (4)2 (5)Al
解析 (2)h为Mg元素,Mg单质在空气中燃烧发出耀眼的白光,电子从能量较高的轨道跃迁到能量较低的轨道时以光(子)的形式释放能量。(3)o元素为Mn,其基态原子电子排布式为1s22s22p63s23p63d54s2,Mn2+的基态电子排布式为1s22s22p63s23p63d5,其3d能级为半充满状态,相对比较稳定,当其失去第3个电子时比较困难,而Fe2+的基态电子排布式为1s22s22p63s23p63d6,其3d能级再失去一个电子即为半充满状态,故其失去第3个电子比较容易。(4)第3周期8种元素分别为钠、镁、铝、硅、磷、硫、氯、氩,其单质中钠、镁、铝形成金属晶体,熔点依次升高;硅形成原子晶体;磷、硫、氯、氩形成分子晶体,且常温下磷、硫为固体,氯气、氩为气体,8种元素熔点最低的为氩,其次为氯,其中电负性最大的为氯。(5)由图可知,该元素的电离能I4 远大于I3,故为第ⅢA族元素,应为Al。
1.(2019·海南,7)今年是门捷列夫发现元素周期律150周年,联合国将2019年定为“国际化学元素周期表年”。下列有关化学元素周期表的说法正确的是( )
A.元素周期表共有18列
B.ⅦA族元素的非金属性自上而下依次减弱
C.主族元素均呈现与其族数相同的最高化合价
D.第2周期主族元素的原子半径自左向右依次增大
答案 AB
解析
由于同一主族的元素从上到下,原子半径逐渐增大,原子获得电子的能力逐渐减弱,所以ⅦA族元素的非金属性自上而下依次减弱,B正确;主族元素一般呈现与其族数相同的最高化合价,O、F非金属性强,O没有与族序数相等的最高正化合价,F没有正价,C错误; 第2周期主族元素的原子半径自左向右依次减小,D错误。
2.(2019·浙江4月选考,14) 2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是( )
A.第35号元素的单质在常温常压下是液体
B.位于第4周期第ⅤA族的元素为非金属元素
C.第84号元素的最高化合价是+7
D.第7周期0族元素的原子序数为118
答案 C
解析 35号元素是溴元素,单质Br2在常温常压下是红棕色的液体,A项合理;位于第4周期第ⅤA族的元素是砷元素(As),为非金属元素,B项合理;第84号元素位于第6周期ⅥA族,为钋元素(Po),由于最高正价等于主族序数,所以该元素最高化合价是+6,C项不合理;第7周期0族元素是第7周期最后一个元素,原子序数为118,D项合理。
3.(2020·山东等级模拟考,6)X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。下列说法错误的是( )
A.X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B.Y的最高价氧化物的水化物为弱酸
C.Y、Z组成的分子可能为非极性分子
D.W是所在周期中原子半径最小的元素
答案 A
4.(2019·海南模考)X、Y是同周期的两种主族元素,他们的逐级电离能(I)数据如下表所示:
电离能/kJ·mol-1
I1
I2
I3
I4
I5
……
X
496
4 562
6 912
9 543
13 353
……
Y
738
1 451
7 733
10 540
13 630
……
下列有关说法正确的是( )
A.电负性:XINi的原因是_______________________________________________________。
(3)[2016·全国卷Ⅲ,37(2)节选]根据元素周期律,第一电离能Ga________As(填“大于”或“小于”)。
答案 (1)O (2)铜失去的是全充满的3d10电子,镍失去的是4s1电子 (3)小于
6.电负性
(1)[2019·全国卷Ⅲ,35(4)节选]NH4H2PO4中,电负性最高的元素是______。
(2)[2016·全国卷Ⅰ,37(4)]光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(3)[2015·全国卷Ⅱ,37(1)改编]O、Na、P、Cl四种元素中电负性最大的是____(填元素符号)。
答案 (1)O (2)O>Ge>Zn (3)O
7.原子半径或离子半径
(1)[2019·全国卷Ⅱ,35(3)]比较离子半径:F-____O2-(填“大于”“等于”或“小于”)。
(2)[2018·全国卷Ⅰ,35(2)]Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是________________________________________________________________________。
(3)[2016·全国卷Ⅲ,37(2)节选]根据元素周期律,原子半径Ga__________As。(填“大于”或“小于”)
答案 (1)小于 (2)Li+核电荷数较大 (3)大于
8.对角线规则
[2019·全国卷Ⅲ,35(1)]在周期表中,与Li的化学性质最相似的邻族元素是______,该元素基态原子核外M层电子的自旋状态______(填“相同”或“相反”)。
答案 Mg 相反