- 203.00 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020 届一轮复习人教版 化学能与电能 课时作业
学校:__________姓名:__________班级:__________考号:__________
1、有 A、B、C、D 四种金属,进行如下实验:①将 A 与 B 浸在稀硫酸中用导线相连,
A 逐渐溶解,B 上有气泡逸出;②将 A、D 分别投入等浓度盐酸中,D 比 A 反应剧烈;③
将 B 浸入 C 的盐溶液里,有金属 C 析出。据此判断它们的活动性由强到弱的顺序是
( )
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
2 、 一 种 基 于 酸 性 燃 料 电 池 原 理 设 计 的 酒 精 检 测 仪 , 负 极 上 的 反
应:CH3CH2OH-4e-+H2O====CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的 H+向负极移动
B.若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气
C.电池反应的化学方程式为 CH3CH2OH+O2====CH3COOH+H2O
D.正极上发生的反应为 O2+4e-+2H2O====4OH-
3、把 a、b、c、d 四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若
a、b 相连时 a 为负极;a、c 相连时 c 极上产生大量气泡;b、d 相连时 b 为正极;
c、d 相连时,电流由 d 到 c。则这四种金属的活动性顺序由大到小为( )
A. a>c>d>b B. a>b>c>d C. c>a>b>d D. b>d>c>a
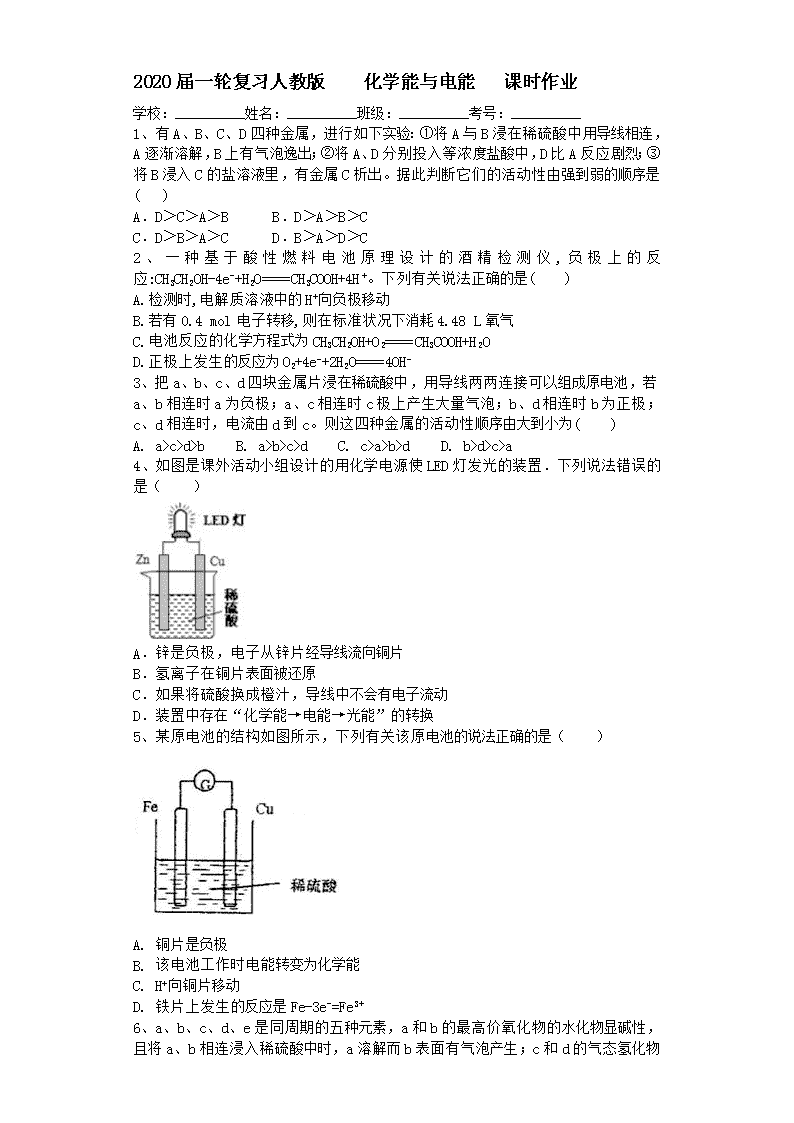
4、如图是课外活动小组设计的用化学电源使 LED 灯发光的装置.下列说法错误的
是( )
A.锌是负极,电子从锌片经导线流向铜片
B.氢离子在铜片表面被还原
C.如果将硫酸换成橙汁,导线中不会有电子流动
D.装置中存在“化学能→电能→光能”的转换
5、某原电池的结构如图所示,下列有关该原电池的说法正确的是( )
A. 铜片是负极
B. 该电池工作时电能转变为化学能
C. H+向铜片移动
D. 铁片上发生的反应是 Fe-3e-=Fe3+
6、a、b、c、d、e 是同周期的五种元素,a 和 b 的最高价氧化物的水化物显碱性,
且将 a、b 相连浸入稀硫酸中时,a 溶解而 b 表面有气泡产生;c 和 d 的气态氢化物
的还原性 d>c,五种元素的原子,得失电子后所形成的简单离子中,e 的离子半径
最小,则它们的原子序数由小到大的顺序是( )
A.a、b、e、d、c B.e、d、a、b、c
C.b、a、e、d、c D.a、b、d、c、e
7、一个原电池的总反应离子方程式是 Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确
( )
A B C D
正极 Zn Ag Cu Cu
负极 Cu Cu Zn Zn
电解质溶液 CuCl2 H2S04 CuSO4~ FeCl2
8、如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
A.锌做负极发生氧化反应
B.供电时的总反应为:Zn+2H+═Zn2++H2↑
C.该装置可实现化学能转化为电能
D.产生 1 g H2,消耗锌的质量 65 g
9、某原电池总反应的离子方程式为 2Fe3++Fe====3Fe2+,能实现该反应的原电池是
( )
A.正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液
B.正极为 C,负极为 Fe,电解质为 FeSO4 溶液
C.正极为 Fe,负极为 Zn,电解质为 Fe2(SO4)3 溶液
D.正极为 Ag,负极为 Cu,电解质为 CuSO4 溶液
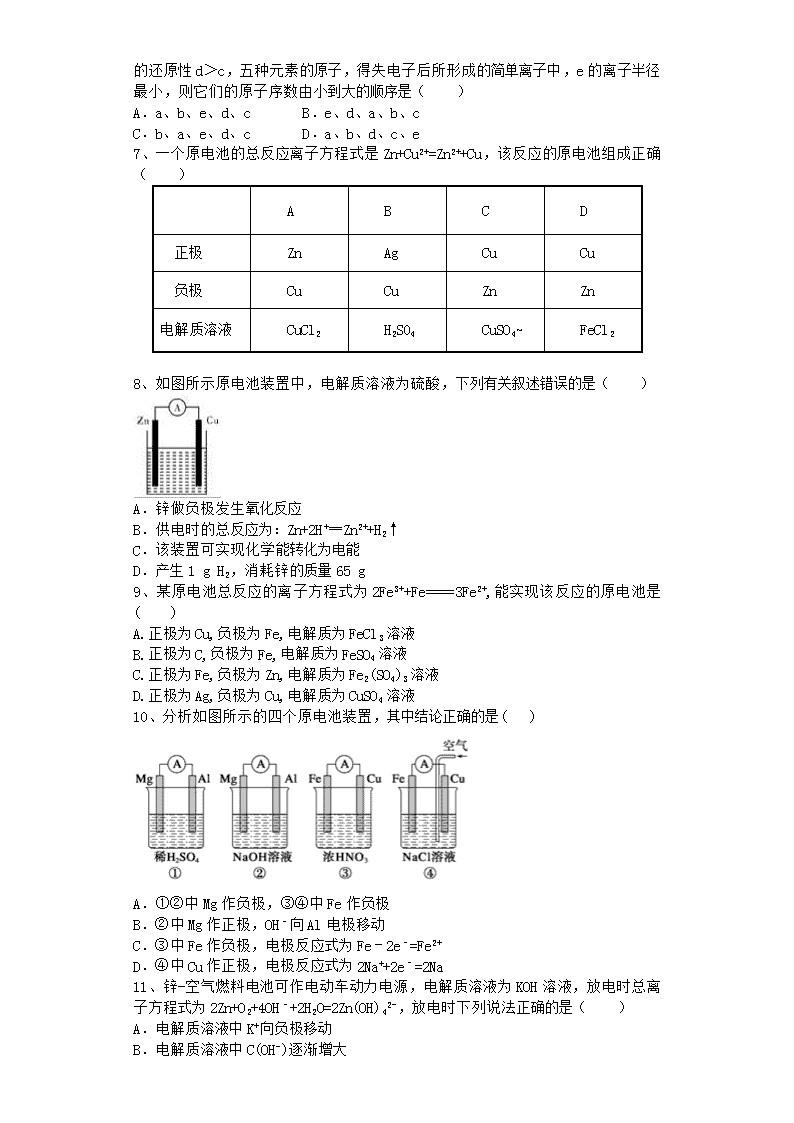
10、分析如图所示的四个原电池装置,其中结论正确的是( )
A.①②中 Mg 作负极,③④中 Fe 作负极
B.②中 Mg 作正极,OH﹣向 Al 电极移动
C.③中 Fe 作负极,电极反应式为 Fe﹣2e﹣=Fe2+
D.④中 Cu 作正极,电极反应式为 2Na++2e﹣=2Na
11、锌-空气燃料电池可作电动车动力电源,电解质溶液为 KOH 溶液,放电时总离
子方程式为 2Zn+O2+4OH–+2H2O=2Zn(OH)42-,放电时下列说法正确的是( )
A.电解质溶液中 K+向负极移动
B.电解质溶液中 C(OH-)逐渐增大
C.负极电极反应:Zn+4OH–-2e–=Zn(OH)42-
D.转移 4mol 电子时消耗氧气 22.4L
12、下列各个装置中能组成原电池的是( )
A. 稀硫酸 B. Cu2SO4 溶液
C. 酒精溶液 D. 稀硫酸
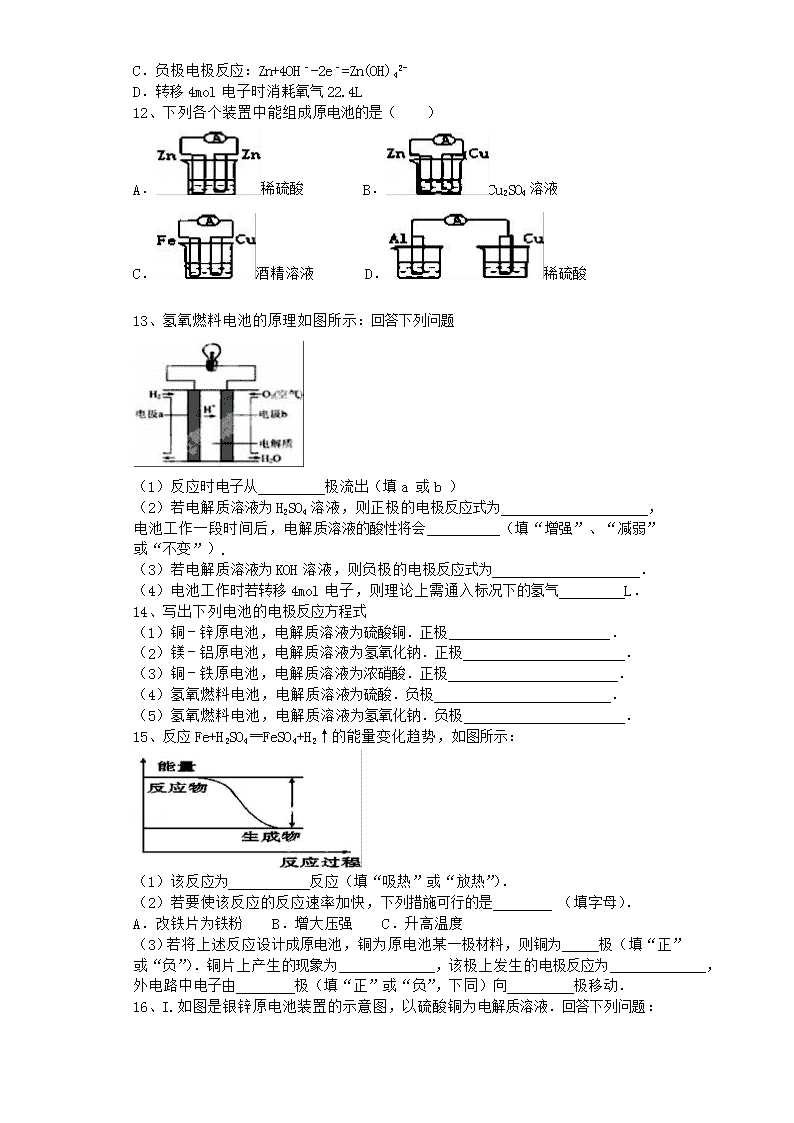
13、氢氧燃料电池的原理如图所示:回答下列问题
(1)反应时电子从 极流出(填 a 或 b )
(2)若电解质溶液为 H2SO4 溶液,则正极的电极反应式为 ,
电池工作一段时间后,电解质溶液的酸性将会 (填“增强”、“减弱”
或“不变”).
(3)若电解质溶液为 KOH 溶液,则负极的电极反应式为 .
(4)电池工作时若转移 4mol 电子,则理论上需通入标况下的氢气 L.
14、写出下列电池的电极反应方程式
(1)铜﹣锌原电池,电解质溶液为硫酸铜.正极 .
(2)镁﹣铝原电池,电解质溶液为氢氧化钠.正极 .
(3)铜﹣铁原电池,电解质溶液为浓硝酸.正极 .
(4)氢氧燃料电池,电解质溶液为硫酸.负极 .
(5)氢氧燃料电池,电解质溶液为氢氧化钠.负极 .
15、反应 Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
(1)该反应为 反应(填“吸热”或“放热”).
(2)若要使该反应的反应速率加快,下列措施可行的是 (填字母).
A.改铁片为铁粉 B.增大压强 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为 极(填“正”
或“负”).铜片上产生的现象为 ,该极上发生的电极反应为 ,
外电路中电子由 极(填“正”或“负”,下同)向 极移动.
16、I.如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
锌为__极,该电极上发生__反应(“氧化”或“还原”),电极反应式为__,该原电
池的总反应离子方程式为 。
II.(1)氮化钠的电子式是_____________。
(2)氮化钠与水反应的化学方程式是__________________。
(3)氮化钠与盐酸反应生成_______种盐。
(4)氮化钠中两种微粒的半径大小比较: r(Na+)___r(N3-)(填“大于”、“小
于”或“等于”)。
17、①如图是一个原电池示意图,该原电池的负极为 ,正极上发生
反应.(填“氧化”或“还原”)
②电子流向:由 极,经导线,流向 极.
③它是一种把 能转化为 能的装置.
④该原电池的反应方程式为: .
18、能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好
地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
( 1 ) 从 能 量 的 角 度 看 , 断 开 化 学 键 要 , 形 成 化 学 键
要 .
(2)在生产和生活中经常遇到化学能与电能的相互转化.如图是将 能转化
为 能的装置,负极电极反应式为 ,发生
反应(填“氧化”或“还原”,下同).正极现象 ,发生
反应;发生反应时,电子由 片流向 片.当导线中有 2mol 电子通
过时,正极上析出 g 氢气.
19、有 A、B 两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有
关性质。分别设计如图所示的原电池,请完成以下问题:
(1)负极材料:A 池 ,B 池 。
(2)电极反应式:
A 池正极 ;
B 池负极 。
(3)由上述实验分析“利用金属活动性顺序表直接判断原电池的正负极”_____
(填“可靠”或“不可靠”),若不可靠请提出另一方案 。
20、反应 Fe+H2SO4====FeSO4+H2↑的能量变化趋势如图所示:
(1)该反应为 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是 (填字母)。
A.改铁片为铁粉
B.改稀硫酸为 98%的浓硫酸
C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为 (填“正”
或“负”)极。铜片上的现象为 ,
该极上发生的电极反应为 ,外电路中电子由_________极(填
“正”或“负”,下同)向 极移动。
参考答案
1、答案:B
解:本题考查金属活泼性强弱的判断.①将 A 与 B 浸在稀硫酸中用导线相连,A 逐渐溶解,
B 上有气泡逸出,说明原电池中 A 做负极,B 做正极,金属活泼性 A>B;②将 A、D 分别
投入等浓度盐酸中,D 比 A 反应剧烈,说明 D 更活泼,金属活泼性 D>A;③将 B 浸入 C
的盐溶液里,有金属 C 析出,说明金属活泼性 B>C。综上可知答案选 B。
2、答案:C
正极反应为 O2+4H++4e-====2H2O,负极反应生成氢离子,正极上消耗氢离子,因此氢离子
应该向正极移动;由正极反应式中的比例关系可知,每转移 0.4 mol 电子,反应掉氧气
0.1 mol 即 2.24 L;将电池的正负极反应式相加即可得 C 项。
3、答案:A
解:由 a、b 相连时 a 为负极可判断 a 的活泼性大于 b;由 a、c 相连时 c 极上产生大量
气泡,说明 c 电极是正极,因此 a 的活泼性大于 c;由 b、d 相连时 b 为正极可判断 d 的
活泼性大于 b;由 c、d 相连时,电流由 d 到 c 可知 c 是负极,因此 c 的活泼性大于 d,
所以金属的活动性顺序由大到小为 a>c>d>b,答案选 A。
4、答案:C
解:A.锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,电子从负极锌片经导
线流向正极铜片,故 A 正确;
B.铜锌原电池中,Cu 作正极,溶液中的氢离子在正极上得电子生成氢气,所以 Cu 上有
气泡生成,电极反应式为:2H++2e﹣=H2,故 B 正确;
C.橙汁显酸性也能作电解质溶液,所以将硫酸换成橙汁,仍然构成原电池,所以导线
中有电子流动,故 C 错误;
D.原电池中化学能转化为电能,LED 灯发光时,电能转化为光能,故 D 正确;
故选 C.
5、答案:C
解:本题考查原电池原理。A.该装置中铁易失电子作负极,铜作正极,故 A 错误;
B.该装置为原电池,原电池工作时把化学能转化为电能,故 B 错误;C.原电池中,溶
液中阳离子向正极移动,所以 H+向铜片移动,故 C 正确;D.Fe 易失电子作负极,铁片
上发生的反应是 Fe-2e-═Fe2+,故 D 错误;故选 C。
6、答案:A
解:a 和 b 的最高价氧化物对应水化物呈碱性,则 a、b 为金属,将 a、b 相连浸入稀硫
酸中时,a 溶解而 b 表面有气泡产生,则金属性 a>b;
c 和 d 的气态氢化物的还原性 d>c,即 c、d 为非金属,且非金属性 d<c;
简单离子中 e 的离子半径最小,则 e 应为金属元素,且阳离子中所带电荷最多,
而同周期元素从左到右金属性减弱,非金属性逐渐增强,故原子序数 a<b<e<d<c,
故选 A.
7、答案:C
解:根据电池反应式知,Zn 失电子化合价升高作负极,不如锌活泼的金属或导电的非金
属作正极,铜离子得电子发生还原反应,则可溶性铜盐溶液作电解质溶液;A.应该是 Zn
作负极、Cu 作正极,故 A 错误;B.应该是 Cu 作负极、Ag 作正极,电解质溶液为硫酸,
无法发生自发的氧化还原反应,不能构成原电池,故 B 错误;C.Zn 作负极、Cu 作正极、
硫酸铜溶液作电解质溶液可以实现该原电池反应,故 C 正确;D.电解质溶液不是硫酸
铜,用的是 FeCl3,形成的原电池不吻合,故 D 错误;故选 C。
8、答案:D
解:A.锌为负极,Zn 失电子发生氧化反应,故 A 正确;
B.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,故 B 正确;
C.该装置为原电池,原电池是化学能转化为电能的装置,故 C 正确;
D.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,产生 1molH2,消耗锌的质量 65g,故 D
错误;
故选 D.
9、答案:A
由 2Fe3++Fe====3Fe2+ 得 出 负 极 反 应 式 为 Fe-2e-====Fe2+, 正 极 反 应 式 为
2Fe3++2e-====2Fe2+,可知负极材料为铁,正极材料为比铁不活泼的导体,电解质溶液中必
须有 Fe3+,A 正确。
10、答案:B
解:A、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负
极,③中金属铁在常温下遇浓硝酸钝化,不能形成原电池,故 A 错误;
B、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg
作为正极,电极反应式为 6H2O+6e﹣═6OH﹣+3H2↑,故 B 正确;
C、金属铁在常温下遇浓硝酸钝化,金属铜可以和浓硝酸之间反应,从而形成原电池,
金属铜是负极,Cu﹣2e﹣═Cu2+,故 C 错误;
D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧
腐蚀,正极上是氧气得电子的过程,故 D 错误.
故选:B.
11、答案:C
解:A.放电时是原电池,阳离子 K+向正极移动,故 A 错误;B.放电时总离子方程式为
2Zn+O2+4OH–+2H2O=2Zn(OH)42-,电解质溶液中 c(OH-)逐渐减小,故 B 错误;C.放电时,
负极反应式为 Zn+4OH--2e-═Zn(OH)42-,故 C 正确;D.放电时,每消耗标况下 22.4L 氧
气,转移电子 4mol,没有指明气体的状态,故 D 错误;故选 C。
12、答案:B
解:本题考查原电池和电解池的工作原理.
A、两电极的活泼性相同,故 A 错误;
B、符合原电池的构成条件,故 B 正确;
C、不能自发的进行氧化还原反应,故 C 错误;
D、不能形成闭合回路,故 D 错误;
故选 B.
13、答案:(1)a;
(2)O2+4e﹣+4H+═2H2O;减弱;
(3)H2﹣2e﹣+2OH﹣═2H2O;
(4)44.8.
解:(1)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,是电子流
出的电极,所以反应时电子从 a 极流出,故答案为:a;
(2)若电解质溶液为 H2SO4 溶液,则正极的电极反应式为 O2+4e﹣+4H+═2H2O;电池工作
一段时间后,电解质溶液的氢离子被消耗,所以酸性将会减弱;故答案为:O2+4e﹣+4H+═
2H2O;减弱;
(3)若电解质溶液为 KOH 溶液,则负极的电极反应式为 H2﹣2e﹣+2OH﹣═2H2O; 故答案
为:H2﹣2e﹣+2OH﹣═2H2O;
( 4) 电 池工 作时 若 转移 4mol 电子 , 根据 电极 反 应: H 2﹣2e﹣+2OH﹣ ═ 2H2O 或是
H2﹣2e﹣=2H+ ,;则理论上需通入标况下的氢气 2mol ,体积是 44.8 L ,故答案为:
44.8.
14、答案:(1)Cu2++2e﹣=Cu;
(2)2H2O+2e﹣=2OH﹣+H2↑;
(3)2NO3﹣+2e﹣+4H+=2NO2↑+2H2O;
(4)H2﹣2e﹣=2H+;
(5)H2﹣2e﹣+2OH﹣═2H2O.
解:本题考查电极反应和电池反应方程式.
(1)铜﹣锌原电池,电解质溶液为硫酸铜,Zn 易失电子作负极、Cu 作正极,正极上铜
离子得电子发生还原反应,电极反应式为 Cu2++2e﹣=Cu,
故答案为:Cu2++2e﹣=Cu;
(2)Mg、Al 和 NaOH 溶液构成的原电池中,Al 易失电子作负极、Mg 作正极,正极上得
电子发生还原反应,电极反应式为 2H2O+2e﹣=2OH﹣+H2↑,
故答案为:2H2O+2e﹣=2OH﹣+H2↑;
(3)Cu、Fe 和浓硝酸构成的原电池中,Cu 易失电子作负极、Fe 作正极,正极上硝酸根
离子得电子发生还原反应,电极反应式为 2NO3﹣+2e﹣+4H+=2NO2↑+2H2O,
故答案为:2NO3﹣+2e﹣+4H+=2NO2↑+2H2O;
(4)氢氧燃料酸性电池中,氢气失电子,则通入氢气的电极是负极,通入氧气的电极
是正极,负极上氢气失电子生成氢离子,电极反应式为 H2﹣2e﹣=2H+,
故答案为:H2﹣2e﹣=2H+;
(5)氢氧燃料碱性电池中,氢气失电子,则通入氢气的电极是负极,通入氧气的电极
是正极,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为 H2﹣2e﹣+2OH﹣═
2H2O,故答案为:H2﹣2e﹣+2OH﹣═2H2O.
15、答案:(1)放热;
(2)AC;
(3)正;有气泡产生;2H++2e﹣=H2↑;负;正.
解:(1)从图象可知,反应物总能量高于生成物总能量,所以该反应为放热反应,
故答案为:放热;
(2)A.改铁片为铁粉,增大了接触面积,反应速率增大,故 A 正确;
B.反应物为铁和硫酸反应,无气体,增大压强,对反应物浓度无影响,对速率无影响,
故 B 错误;
C.升高温度,反应速率增大,故 C 正确,故选 AC;
(3)铜、铁、稀硫酸构成的原电池中,铁易失电子发生氧化反应而作负极,负极上电
极反应式为 Fe﹣2e﹣=Fe2+;铜作正极,正极上氢离子得电子发生还原反应,电极反应式
为 2H++2e﹣=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,电子由
负极流向正极;
故答案为:正;有气泡产生;2H++2e﹣=H2↑;负;正.
16、答案:Ⅰ.负 ; 氧化 ; Zn﹣2e﹣=Zn2+ ; Zn+Cu2+=Zn2++Cu
Ⅱ.(1)
(2) Na3N+H2O=NH3+3NaOH
(3) 两
(4) 小于
解:I.锌的金属性强于铜,锌为负极,该电极上发生氧化反应,电极反应式为 Zn-2e-=
Zn2+,正极是银,溶液中铜离子得到电子,该原电池的总反应离子方程式为 Zn+Cu2+=
Zn2++Cu。
II.(1)氮化钠是离子化合物,电子式是 。
( 2 ) 氮 化 钠 与 水 反 应 生 成 氢 氧 化 钠 和 氨 气 , 反 应 的 化 学 方 程 式 是 Na3N+H2O =
NH3↑+3NaOH。
(3)氮化钠与盐酸反应生成氯化铵和氯化钠两种盐。
(4)氮化钠中两种微粒的核外电子排布相同,离子半径随原子序数的增大而减小,则 r
(Na+)小于 r(N3-)。
17、答案:① Zn;还原;
② Zn;Cu;
③ 化学;电;
④ Zn+H2SO4=ZnSO4+H2↑.
解:①Zn 较活泼,为原电池的负极,负极发生氧化反应,正极发生还原反应,故答案为:
Zn;还原;
②原电池工作时,电子由负极经导线流向正极,即从 Zn 经导线流向 Cu,故答案为:Zn;
Cu;
③原电池是将化学能转化为电能的装置,故答案为:化学;电;
④该原电池的总方程式为 Zn+H2SO4=ZnSO4+H2↑,故答案为:Zn+H2SO4=ZnSO4+H2↑.
18、答案:(1)吸收能量,释放能量;
(2)化学,电;Zn﹣2e﹣=Zn2+;氧化;产生气泡;还原;锌片;铜片;2g.
解:(1)在化学反应中,化学反应的实质是旧键的断裂和新键的生成,断开化学键要
吸收能量,形成化学键要释放能量,故答案为:吸收能量,释放能量;
(2)原电池是将化学能转化为电能的装置,其中活泼金属 Zn 做负极,发生氧化反应
Zn﹣2e﹣=Zn2+;正极氢离子得电子发生还原反应 2H++2e﹣=H2↑,当导线中有 2mol 电子
通过时,产生氢气是 1mol,质量是 2g.
故答案为:化学,电;Zn﹣2e﹣=Zn2+;氧化;产生气泡;还原;锌片;铜片;2g.
19、答案:(1)Mg Al
(2)2H++2e-====H2↑
Al-3e-+4OH-====Al +2H2O
(3)不可靠 将两种金属电极连上电流计而构成原电池,利用电流计检测电流的方向,从
而判断电子流动方向,由此确定原电池的正负极
装置 A 中,Mg、Al 都与 H2SO4 反应,由于 Mg 活泼作负极;装置 B 中只有 Al 与 NaOH 反应,
故 Al 作负极,电极反应为 Al-3e-+4OH-====Al +2H2O。
由 A、B 装置可知不能直接根据金属活动性顺序表判断原电池的正负极。但可以借助电
流计测定电流的方向,判断电子流动方向,确定原电池的正负极。
20、答案:(1)放热 (2)A、C
(3)正 产生无色气泡 2H++2e-====H2↑ 负 正
(1)据能量变化图像可知该反应是放热反应。
(2)增大固体的表面积或升高温度,反应速率加快;适当增大浓度反应速率也增大,但 98%
的浓硫酸能使铁钝化。
(3)该反应中铁是还原剂,作负极,比铁活泼性差的铜应作正极。铜片上,氢离子得到电子,
反应是 2H++2e-====H2↑,外电路电子由负极流向正极。