- 699.66 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
非选择题专项练(二)
三、非选择题:本题共5小题,共60分。
16.(2020山东德州一模)(11分)Fe、Co、Ni均为Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子中,电子填充的能量最高的能级符号为 。
(2)在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是 。
(3)铁氰化钾{K3[Fe(CN)6]}溶液是检验Fe2+常用的试剂。设NA表示阿伏加德罗常数的值,1 mol [Fe(CN)6]3-含σ键的数目为 。
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是 。配体N3-中心原子的杂化类型为 。CoO的熔点是1 935 ℃,CoS的熔点是1 135 ℃,试分析CoO的熔点较高的原因: 。
(5)NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为 。
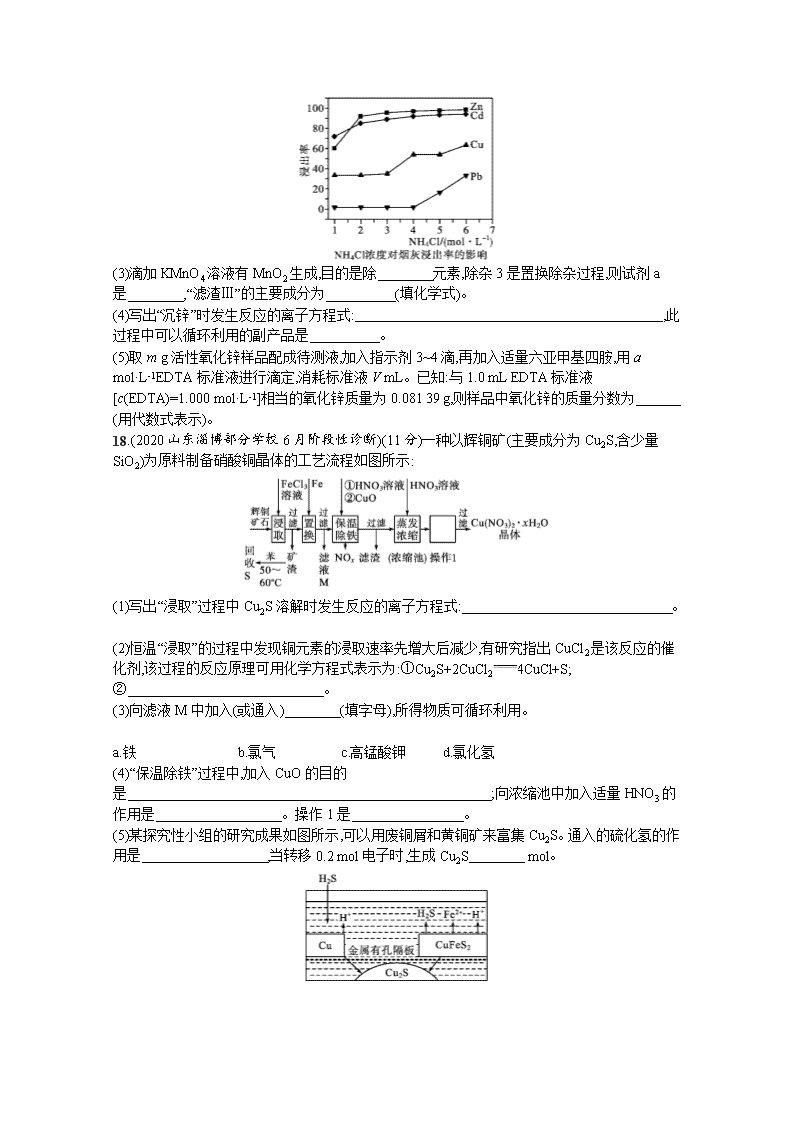
17.(2020山东济宁三模)(13分)铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
已知:活性炭净化主要是除去有机杂质。
(1)写出氯化铵的电子式: ,“净化”过程属于 (填“物理”或“化学”)变化。
(2)在反应温度为50 ℃,反应时间为1 h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为 mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为 。
(3)滴加KMnO4溶液有MnO2生成,目的是除 元素,除杂3是置换除杂过程,则试剂a是 ,“滤渣Ⅲ”的主要成分为 (填化学式)。
(4)写出“沉锌”时发生反应的离子方程式: ,此过程中可以循环利用的副产品是 。
(5)取m g活性氧化锌样品配成待测液,加入指示剂3~4滴,再加入适量六亚甲基四胺,用a mol·L-1EDTA标准液进行滴定,消耗标准液V mL。已知:与1.0 mL EDTA标准液[c(EDTA)=1.000 mol·L-1]相当的氧化锌质量为0.081 39 g,则样品中氧化锌的质量分数为 (用代数式表示)。
18.(2020山东淄博部分学校6月阶段性诊断)(11分)一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜晶体的工艺流程如图所示:
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式: 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl24CuCl+S;② 。
(3)向滤液M中加入(或通入) (填字母),所得物质可循环利用。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(4)“保温除铁”过程中,加入CuO的目的是 ;向浓缩池中加入适量HNO3的作用是 。操作1是 。
(5)某探究性小组的研究成果如图所示,可以用废铜屑和黄铜矿来富集Cu2S。通入的硫化氢的作用是 ,当转移0.2 mol电子时,生成Cu2S mol。
19.(2020山东淄博部分学校6月阶段性诊断)(13分)工业合成氨解决了人类的生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示,对图中线间距离窄小的部分,其能量差用的方式表示。由图可知合成氨反应N2(g)+3H2(g)2NH3(g)的ΔH= kJ· mol-1,反应速率最慢的步骤的化学方程式为 。
(2)工业合成氨反应为N2(g)+3H2(g)2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
则500 ℃时:
①平衡常数Kp(30 MPa) (填“<”“=”或“>”)Kp(100 MPa)。
②30 MPa时,氢气的平衡转化率为 (结果保留3位有效数字)。用平衡分压表示平衡常数Kp= (列出计算式即可,不必化简)。
(3)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观反应过程如图所示,其中电解质溶液为溶解有三氟甲磺酸锂和乙醇的有机溶液。
①阴极区生成NH3的电极反应式为 。
②下列说法正确的是 (填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
C.保持电流强度不变,升高溶液的温度,可以加快电解反应的速率
20.(2020山东潍坊三模)(12分)化合物H是合成抗胆碱药的一种中间体,合成路线如下:
ABC()DE(C10H12O2)FGH()
已知:++C2H5OH
回答下列问题:
(1)化合物A的结构简式是 ,E→F的反应类型是 。
(2)可证明G已经完全转化为H的物质是 (填代号)。
a.溴水 b.酸性KMnO4溶液
c.四氯化碳 d.钠
(3)D→E的化学方程式为 。
(4)写出符合下列条件的E的3种同分异构体的结构简式:
。
①含氧官能团与E不同;②与NaOH溶液完全反应时,二者的物质的量之比为1∶1;③苯环上有两种不同化学环境的氢,取代基上共有三种不同化学环境的氢。
(5)写出以环己烯和乙醇为原料合成的路线(其他试剂任选)。
参考答案
非选择题专练(二)
16.答案(1)3d (2)Fe2+中3d轨道没有达到半充满的稳定结构,而Fe3+中3d轨道达到半充满的稳定结构 (3)12NA (4)6 sp 两者均为离子晶体,但S2-半径大于O2-半径,CoO的晶格能大于CoS,因此CoO的熔点较高 (5)(1,12,12)
解析(1)铁的原子序数为26,价电子排布式为3d64s2,由构造原理可知能量最高的能级为3d。
(2)氧化亚铁中亚铁离子的价电子排布式为3d6,3d轨道没有达到半充满的稳定结构,氧化铁中铁离子的价电子排布式为3d5,3d轨道达到半充满的稳定结构,所以在空气中FeO稳定性小于Fe2O3。
(3)在配合物[Fe(CN)6]3-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个σ键,所以1mol该配合物中含有σ键的数目为12NA。
(4)在[Co(N3)(NH3)5]2+中,Co3+为中心离子,N3-和NH3为配体,配位数为6;配体N3-与二氧化碳的原子个数和价电子数相同,属于等电子体,等电子体具有相同的空间结构,二氧化碳的空间构型为直线形,则N3-的空间构型也为直线形,由空间构型可知N原子的杂化方式为sp杂化;CoO和CoS均为离子晶体,但S2-的半径大于O2-的半径,CoO的晶格能大于CoS,因此CoO的熔点较高。
(5)已知晶胞中原子坐标参数A为(0,0,0),B的原子坐标分别为(1,1,0),则以A为晶胞坐标原点,晶胞的边长为1,C原子在晶胞立方体的面心上,则C原子坐标参数为(1,12,12)。
17.答案(1)H··N··H··H··H+ ··Cl······- 物理 (2)4 ZnO+2NH4++2NH3·H2O[Zn(NH3)4]2++3H2O
(3)Fe Zn Cu、Zn
(4)2Zn2++4HCO3-Zn2(OH)2CO3↓+3CO2↑+H2O NH4Cl (5)0.08139aVm×100%或8.139aVm%
解析首先利用氯化铵和氨水浸取铜转炉烟灰,Pb元素转化为Pb(OH)Cl沉淀除去,Zn、Fe、Cu、As等元素进入溶液,加入氯化铁使As元素转化为FeAsO4沉淀除去,加入硫酸酸化的高锰酸钾,Fe元素全部被氧化成Fe3+,调节pH使Fe元素转化为沉淀除去;此时还有Cu元素会影响碱式碳酸锌的纯度,所以试剂a应除去铜元素,为了不引入新的杂质,可以加入过量的Zn单质置换出铜,从而将Cu除去;再加入活性炭净化;之后加入碳酸氢铵将Zn元素转化为碱式碳酸锌,煅烧后得到氧化锌。
(1)氯化铵由铵根和氯离子构成,其电子式为H··N··H··H··H+ ··Cl······-;活性炭吸附杂质可达到净化的目的,没有新物质生成,属于物理变化。
(2)浸取过程中需要使Zn元素尽可能多的进入溶液,而杂质离子要尽量少的进入溶液,同时为了加快反应速率,需要氯化铵的浓度尽量大一些,观察题图,可知当氯化铵的浓度为4 mol·L-1时,一方面锌元素的浸出率已经接近100%,氯化铵的浓度也较大,另一方面若浓度再高,铅元素将进入溶液,所以最适宜的浓度为4 mol·L-1。反应物有ZnO、氯化铵、一水合氨,产物有[Zn(NH3)4]2+,根据元素守恒可得离子方程式为ZnO+2NH4++2NH3·H2O[Zn(NH3)4]2++3H2O。
(3)滴加KMnO4溶液可将Fe2+氧化为Fe3+,再调节pH除去Fe3+,所以目的是除去Fe元素;根据分析可知试剂a应为Zn,滤渣Ⅲ的主要成分有置换出来的Cu和未反应的Zn。
(4)溶液中含有大量锌离子,加入碳酸氢铵后产生Zn2(OH)2CO3,说明碳酸氢根电离出的碳酸根和锌离子及氢氧根结合生成碱式碳酸锌沉淀,从而促进碳酸氢根的电离,电离出的氢离子又和碳酸氢根结合生成二氧化碳和水,所以离子方程式为2Zn2++4HCO3-Zn2(OH)2CO3↓+3CO2↑+H2O;根据前序步骤添加的物质,以及此过程发生的反应可知,此时溶液中的主要成分为氯化铵和少量硫酸铵,氯化铵可以循环使用。
(5)用a mol·L-1EDTA标准液进行滴定,消耗标准液V mL,与1.0 mL EDTA标准液[c(EDTA)=1.000 mol·L-1]相当的氧化锌质量为0.081 39 g,所以m(ZnO)=aV×0.081 39 g,其质量分数为0.08139aVm×100%或8.139aVm%。
18.答案(1)Cu2S+4Fe3+2Cu2++4Fe2++S (2)CuCl+FeCl3CuCl2+FeCl2 (3)b (4)调节溶液的pH,使铁完全转化为Fe(OH)3沉淀 抑制Cu2+的水解 冷却(降温)结晶 (5)催化剂 0.2
解析向辉铜矿加入氯化铁溶液溶解浸取,二氧化硅不反应,过滤得到矿渣用苯回收硫单质,说明Cu2S和FeCl3发生反应生成S单质,还生成氯化铜、氯化亚铁。在滤液中加入铁还原铁离子和铜离子,然后过滤,滤液M主要含有氯化亚铁,保温除铁是加入稀硝酸将亚铁离子氧化为铁离子,用氧化铜调节溶液的pH,使Fe3+转化为Fe(OH)3沉淀,过滤分离,滤液中主要含有硝酸铜,加入硝酸抑制铜离子水解,蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体。
(1)浸取过程中Fe3+将Cu2S氧化成Cu2+和硫单质,本身被还原为二价铁离子,根据电子守恒和元素守恒可得其离子方程式为Cu2S+4Fe3+2Cu2++4Fe2++S。
(2)根据CuCl2是该反应的催化剂,故最终产物为CuCl2,可得第②步反应为三氯化铁氧化氯化亚铜为氯化铜:CuCl+FeCl3CuCl2+FeCl2。
(3)滤液M中主要物质为氯化亚铁,通入氯气可生成氯化铁,实现循环使用,故答案为b。
(4)“保温除铁”过程要除去Fe3+,故需要加入氧化铜来调节pH,使Fe3+生成氢氧化铁沉淀;铜离子会水解,故在蒸发浓缩冷却结晶过程中需要加入硝酸来抑制其水解。
(5)从图中可知,反应前后硫化氢的质量和性质没有发生改变,应为催化剂;在该转化中Cu被氧化成Cu2S,CuFeS2被还原成Cu2S,根据电子守恒,当转移0.2mol电子时,可生成0.2molCu2S。
19.答案(1)-92 Nad+3HadNHad+2Had (2)①=
②33.3% (30×20%)2(30×20%)×(30×60%)3
(3)①N2+6C2H5OH+6e-2NH3+6C2H5O- ②AB
解析(1)由图可知,反应物[12N2(g)+32H2(g)]和生成物[NH3(g)]的能量差为46kJ·mol-1,则反应N2(g)+3H2(g)2NH3(g)的ΔH=2×(-46kJ·mol-1)=-92kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad+2Had)时,反应物破坏化学键消耗能量最大,则反应速率最慢,反应的化学方程式为Nad+3HadNHad+2Had。
(2)①对一个确定的可逆反应,化学平衡常数只受温度变化的影响,则500℃时,反应的平衡常数Kp(30MPa)=Kp(100MPa)。
②设平衡时参加反应的N2的物质的量为xmol,由题意建立如下三段式:
N2(g)+3H2(g)2NH3(g)
起始量/mol 1 3 0
变化量/mol x 3x 2x
平衡量/mol 1-x 3-3x 2x
由图可知,a点时氨气的物质的量分数为20%,则由三段式可得2x4-2x=20100,解得x=13,则氢气的平衡转化率为3x3×100%≈33.3%;由三段式数据可得N2的体积分数为1-x4-2x×100%=20%,H2的体积分数为3-3x4-2x×100%=60%,则用平衡分压表示平衡常数Kp=(30×20%)2(30×20%)×(30×60%)3。
(3)①从阴极区的微观反应过程示意图可知,N2与C2H5OH在阴极区得到电子发生还原反应生成NH3和C2H5O-,电极反应式为N2+6C2H5OH+6e-2NH3+6C2H5O-。②电解质溶液为溶解有三氟甲磺酸锂和乙醇的有机溶液,三氟甲磺酸锂并未参与阴极反应,其作用是电离出离子,使溶液中离子浓度增大,增强溶液导电性,A正确;从示意图可知,水在选择性透过膜上方,说明选择性透过膜可允许N2和NH3通过,不允许H2O透过,B正确;保持电流恒定,升高温度不改变电解反应速率,C错误。
20.答案(1) 取代反应 (2)d
(3)+C2H5OH
+H2O
(4)、
、
(5)
解析根据C的结构为,由ABC转化关系逆推可得B为,A为;C在酸性条件下水解生成D,则D的结构简式为,D与C2H5OH在浓硫酸及加热条件下发生酯化反应生成E,E
的分子式为C10H12O2,则E的结构简式为,HCOOC2H5与E发生题中已知信息反应生成F,则F的结构简式为,F在催化剂作用下与H2发生加成反应生成G,则G的结构简式为,G在一定条件下反应生成H,H的结构简式为,则G在一定条件下发生消去反应生成H()。
(1)化合物A的结构简式是,HCOOC2H5与E发生题中已知信息反应生成F,反应类型为取代反应。
(2)因为G的结构简式为,G中含有醇羟基,G完全转化为H,H的结构简式为,H中不再含醇羟基,可用金属钠检验,若不再产生气体,则说明G完全转化为H。
(3)D与C2H5OH发生酯化反应生成E,则化学方程式为+C2H5OH
+H2O。
(4)E的分子式为C10H12O2,结构简式为,含有酯基,根据题目要求,它的同分异构体不含酯基,与NaOH溶液完全反应时,二者的物质的量之比为1∶1,则可判定该结构中有一个酚羟基或一个羧基,还要满足苯环上有两种不同化学环境的氢,取代基上共有三种不同化学环境的氢,则先确定一个苯环和一个羧基,还有3个碳原子作为一个取代基,为满足苯环上有两种不同化学环境的氢,两个取代基只能处于对位,羧基上已经有一种氢,满足取代基上共有三种不同化学环境的氢,含3个碳原子取代基还有2种氢,符合要求的结构简式为,同理确定一个苯环和一个酚羟基,酚羟基与另一个取代基也处于对位,
才能满足苯环上有两种不同化学环境的氢,酚羟基上已经有一种氢,则另一个取代基还应有2种氢,符合要求的结构简式可写为和。
(5)由环己烯和乙醇为原料合成,环己烯是六元环,而目标物为五元环,必须开环,环己烯断键开环可利用酸性KMnO4溶液,环己烯被酸性KMnO4溶液氧化成二元羧酸,再与乙醇发生酯化反应生成酯,再根据已知信息反应即可合成目标产物。因而合成线路为。