- 450.33 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第 1 页 共 9 页
2019-2020 学年福州第一中学高三下学期
理科综合能力校模拟-化学
(完卷时间:150 分钟;满分:300 分)
【可能用到的相对原子质量】H-1 Li-7 C-12 O-16 Na-23 S-32 Cu-64 Zn-65 As-75
第 I 卷(选择题共 126 分)
一、选择题(本题共 13 小题,每题 6 分,共 78 分。在每小题给出的四个选项中,只有
一项是符合题目要求的。)
7.化学与人类生产、生活、科研密切相关,下列有关说法正确的是( )
A.蒸馏“地沟油”可以获得汽油
B.14C 可用于文物年代的鉴定,14C 和 12C 互为同素异形体
C.向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应
D.食品袋中放入装有硅胶和铁粉的透气小袋,目的是防止食品受潮、被氧化变质
8.下列说法不正确的是( )
A.甲苯和环己烯都能使酸性高锰酸钾溶液褪色
B.1 mol 能与含 2 mol NaOH 的烧碱溶液完全反应
C.丙烷和 2-甲基丙烷的一氯代物均为两种
D. 所具有的官能团种类有 4 种
9.设阿伏加德罗常数为 NA,下列说法不正确的是( )
A.常温常压下,30 g 乙烷气体中所含有的共价键数目为 6NA
B.含 1 mol Cl-的 NH4Cl 溶液中加入适量氨水使溶液呈中性,此时溶液中 NH4+数为 NA
C.室温下,21.0g 乙烯和丁烯的混合气体中含有的碳原子数目为 l.5NA
D.在电解精炼铜的过程中,当阴极析出 32g 铜单质时,电子转移数目为 NA
第 2 页 共 9 页
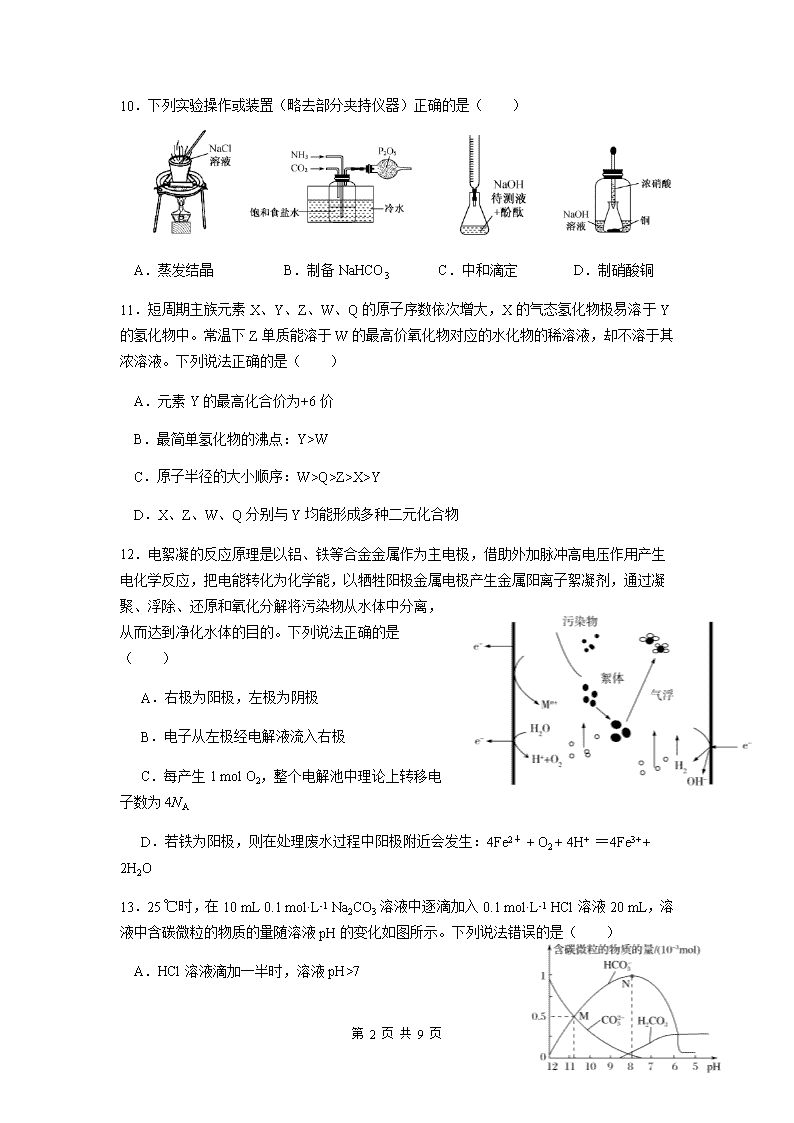
10.下列实验操作或装置(略去部分夹持仪器)正确的是( )
A.蒸发结晶 B.制备 NaHCO3 C.中和滴定 D.制硝酸铜
11.短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,X 的气态氢化物极易溶于 Y
的氢化物中。常温下 Z 单质能溶于 W 的最高价氧化物对应的水化物的稀溶液,却不溶于其
浓溶液。下列说法正确的是( )
A.元素 Y 的最高化合价为+6 价
B.最简单氢化物的沸点:Y>W
C.原子半径的大小顺序:W>Q>Z>X>Y
D.X、Z、W、Q 分别与 Y 均能形成多种二元化合物
12.电絮凝的反应原理是以铝、铁等合金金属作为主电极,借助外加脉冲高电压作用产生电
化学反应,把电能转化为化学能,以牺牲阳极金属电极产生金属阳离子絮凝剂,通过凝聚、
浮除、还原和氧化分解将污染物从水体中分离,从而
达到净化水体的目的。下列说法正确的是( )
A.右极为阳极,左极为阴极
B.电子从左极经电解液流入右极
C.每产生 1 mol O2,整个电解池中理论上转移电
子数为 4NA
D.若铁为阳极,则在处理废水过程中阳极附近会
发生:4Fe2+ + O2 + 4H+ =4Fe3+ + 2H2O
13.25 ℃时,在 10 mL 0.1 mol·L-1 Na2CO3 溶液中逐滴加入 0.1 mol·L-1 HCl 溶液 20 mL,溶
液中含碳微粒的物质的量随溶液 pH 的变化如图所示。下列说法错误的是( )
A.HCl 溶液滴加一半时,溶液 pH>7
B.H2CO3 的 Ka1 的数量级为 10-6
第 3 页 共 9 页
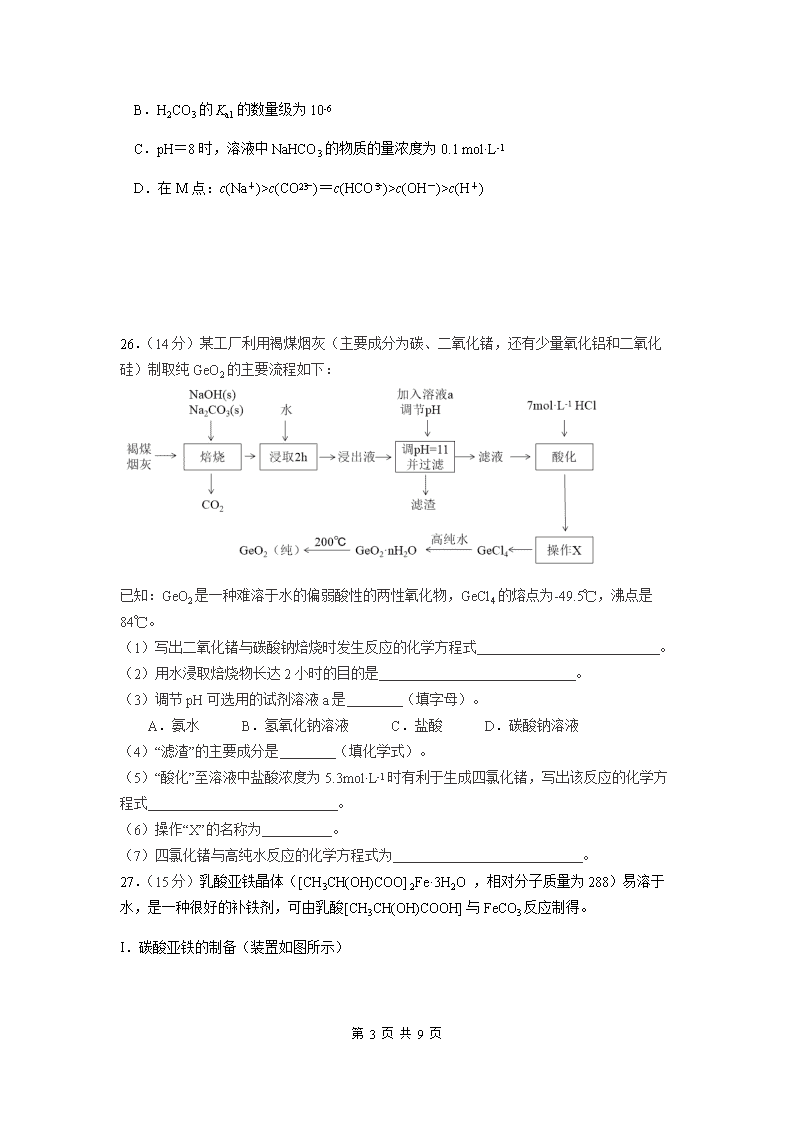
C.pH=8 时,溶液中 NaHCO3 的物质的量浓度为 0.1 mol·L-1
D.在 M 点:c(Na+)>c(CO2-
3 )=c(HCO-
3 )>c(OH-)>c(H+)
26.(14 分)某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化
硅)制取纯 GeO2 的主要流程如下:
已知:GeO2 是一种难溶于水的偏弱酸性的两性氧化物,GeCl4 的熔点为-49.5℃,沸点是 84℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式 。
(2)用水浸取焙烧物长达 2 小时的目的是 。
(3)调节 pH 可选用的试剂溶液 a 是 (填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)“滤渣”的主要成分是 (填化学式)。
(5)“酸化”至溶液中盐酸浓度为 5.3mol·L-1 时有利于生成四氯化锗,写出该反应的化学方
程式 。
(6)操作“X”的名称为 。
(7)四氯化锗与高纯水反应的化学方程式为 。
27.(15 分)乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O ,相对分子质量为 288)易溶于水,
是一种很好的补铁剂,可由乳酸[CH3CH(OH)COOH]与 FeCO3 反应制得。
I.碳酸亚铁的制备(装置如图所示)
第 4 页 共 9 页
(1)实验操作如下:打开______,加入适量稀硫酸后关闭 k1,使反应进行一段时间,其目
的除生成 FeSO4 溶液外,还有 。
(2)接下来使仪器 C 中的制备反应发生,其反应的离子方程式为 。
(3)仪器 C 中混合物经过滤、洗涤得到 FeCO3 沉淀,检验其是否洗净的方法是 。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净 FeCO3 固体中加入足量乳酸溶液,在 75℃下搅拌使之充分反应,经过滤,在____
__________________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过 KMnO4 滴定法测定样品中 Fe2+的含量计算样品纯度。在操作均正确的前提下,
所得纯度总是大于 100%,其原因可能是 。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取 3.000g 样品,灼
烧完全灰化,加足量盐酸溶解,取所有可溶物配成 100mL 溶液。吸取 25.00mL 该溶液加入
过量 KI 溶液充分反应,然后加入几滴淀粉溶液,用 0.1000 mol·L-1 硫代硫酸钠溶液滴定(已
知:I2 + 2S2O32-=S4O62- + 2I-),当溶液 ,即为滴定终点;平行滴定 3 次,硫
代硫酸钠溶液的平均用量为 24.80 mL,则样品纯度为 %。
28.(14 分)热化学碘硫循环可用于大规模制氢气,HI 分解和 SO2 水溶液还原 I2 均是其中
的主要反应。回答下列问题:
(1)碘硫热化学循环中,SO2 的水溶液还原 I2 的反应包括如下:
SO2 + I2 + 2H2O 3H+ + HSO4-+2I-、I- + I2 I3-。
若起始时 n(I2)=n(SO2)=1 mol,I-、I3-、H+、HSO4-的物质的量随 2
2
( )
( )
n H O
n SO
的变化
第 5 页 共 9 页
如图 1 所示:
图 1 中表示的微粒:a 为__________,d 为__________。
(2)起始时 HI 的物质的量为 1 mol,总压强为 0.1MPa 下,发生反应:
HI(g) 1
2 H2(g) + 1
2 I2(g)。
平衡时各物质的物质的量随温度变化如图 2 所示:
①该反应的∆H__________(填“>”或“<”)0。
②600℃时, 平衡 分压 p(I2)= __________MPa ,反应 的平 衡常 数 Kp 的数 学 表达 式.. .为
__________________(Kp 为以分压表示的平衡常数)。
(3)反应 H2(g) + I2(g) 2HI(g)的反应机理如下:
第 6 页 共 9 页
①第一步反应__________(填“放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如 aA + dD=gG + hH 的速率方程,
v=kca(A)·cd(D),k 为常数;非基元反应由多个基元反应组成,非基元反应的速率方
程可由反应机理推定。H2(g)与 I2(g)反应生成 HI(g)的速率方程为 v=__________(用含 k1、
k-1、k2…的代数式表示)。
35.【化学选修 3——物质结构与性质】(15 分)
铜是人类利用最早的金属之一,其单质及化合物在人生产生活中有着广泛的应用。
(1)铜可以做成导线,Cu 的焰色为 色;基态 Cu2+的核外电子占据的最高能层
的能层符号为 。
(2)铜可以作为乙醇和氧气反应的催化剂,2CH3CH2OH + O2 CH3CHO + 2H2O。写出
与水具有相同空间构型的一个分子和一个离子 (微粒由短周期元素组成)。
从原子轨道重叠方式来看 CH3CHO 中所含的共价键类型有 ,碳的杂
化方式是 。
(3)高温超导是世界上最前沿的研究之一,如下图是第一个被发现的高温超导体氧化物的
晶胞。该化合物的化学式为 。与 Cu2+紧邻的 O2-的个数为 。
已知,阿伏加德罗常数为 NA,则晶胞密度为 g·cm-3。
第 7 页 共 9 页
36.【化学选修 5——有机化学基础】(15 分)
G 是药物合成的中间体,其部分合成路线如下:
已知:RCHO + CH3COR1 RCH=CHCOR1 + H2O
请回答下列问题:
(1)C→D 的反应类型为 。
(2)试剂 E 的名称为 ,G 的分子式为 。
(3)写出 A→B 的化学方程式 。
(4)设计 A→B 步骤的目的是 。
(5)芳香族化合物 T 是 D 的同分异构体,满足下列条件的结构一共有 种。
①能发生银镜反应;
②遇 FeCl3 溶液不发生显色反应,其在稀硫酸中的水解产物之一遇 FeCl3 溶液能发生显
色反应;
③在核磁共振氢谱上有七组峰;
(6)以环己醇和 为原料,合成 的路线为
S CHO S
OH
S
第 8 页 共 9 页
。
化学答案
7—13:D D A D B D C
26.(14 分,每空 2 分)
(1)GeO2+Na2CO3 Na2GeO3+CO2↑ (2)为了提高含锗化合物的浸出率
(3)C (4)H2SiO3、Al(OH)3 (5)Na2GeO3+6HCl=2NaCl+3H2O+GeCl4
(6)蒸馏 (7)GeCl4 + (2+n)H2O = 4HCl+GeO2•nH2O
27.(15 分,除第一空 1 分,其它空均为 2 分)
(1)打开 K1 K2 用产生的 H2 排尽装置内的空气
(2)Fe2++2HCO3
-=FeCO3↓+CO2↑+H2O
(3)取最后一次洗涤液,加入过量稀盐酸,再加入一定量 BaCl2 溶液,若无白色沉淀,则洗
涤干净 (4)隔绝空气
(5)①乳酸根离子中的羟基也能被高锰酸钾溶液氧化,导致消耗高锰酸钾溶液的量偏多
②蓝色褪去且半分钟不恢复 95.2
28.(14 分,每空 2 分)
(1) H+ (2) I3- (3)> (4)0.0125
(5)
1 1
2 2
a a
a
(0 0125MP ) (0 0125MP )
0.075MP
. . (单位可以不写出)
(6)吸收 (7) 1 2 3
-1 -2
k k k
k k c(H2)·c(I2)
35.(15 分)
第 9 页 共 9 页
(1)绿色(1 分),M(2 分)。
(2)H2S 或 SO2,NO2-或 NH2-(2 分),δ键和π键(2 分),sp2 和 sp3 杂化(2 分)。
(3)La2CuO4(2 分),6(2 分), (2 分)
36.(15 分)
(1)取代反应(2 分)
(2)丙酮(2 分);C19H20O5(2 分)
(3) (2 分)
(4)保护酚羟基(2 分)
(5)2(2 分)
(6)
(3 分)