- 389.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
湖北省武汉市五校联合体2019-2020学年高一下学期期末考试试卷
试卷满分: 100分
可能用到的相对原子质量:Cl 35.5 Ag 108 S 32 O 16 Fe 56 Mg 24 Al 27
B 11 N 14 Na 23 C 12 K 39
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关说法正确的是( )
A.隔绝空气高温加热生物质,通过热化学转换可产生可燃性气体
B. 光电转换是太阳能的利用途径之一,该途径必然发生化学反应
C. 开发太阳能、氢能、核能、天燃气等新能源可以减少雾霾的产生
D. 科学家正在研究使用高效催化剂,使水分解产生氢气,同时释放能量
2.若15P原子的电子排布式写成1s22s22p63s23pX23PY1,它违背了 ( )
A.能量守恒原理 B.能量最低原理
C.洪特规则 D.泡利不相容原理
3.下列物质的变化过程中:①H2在Cl2中燃烧 ②碳酸钙分解 ③铝热反应 ④酸碱中和反应 ⑤缓慢氧化 ⑥H2O分解 ⑦NaOH固体溶于水 ⑧铁和稀H2SO4反应 ⑨Ba(OH)2·8H2O和NH4Cl反应 ⑩工业合成氨
说法正确的是:( )
A.属于放热反应的有:①③④⑤⑦⑧⑩
B.反应⑨在搅拌的过程中有刺激性气味的气体产生可以证明该反应是吸热反应
C.擦拭过机器的废旧棉纱在不通风的角落里自燃的现象可以证明缓慢氧化是放热反应
D.目前科学研究的前沿是寻找合适的催化剂,降低反应⑥的焓变,从而使水的分解更容易
4.下列说法或有关化学用语的表达正确的是 ( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.核外电子排布由1s22s22p63s1―→1s22s22p6 的变化需要吸收能量
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
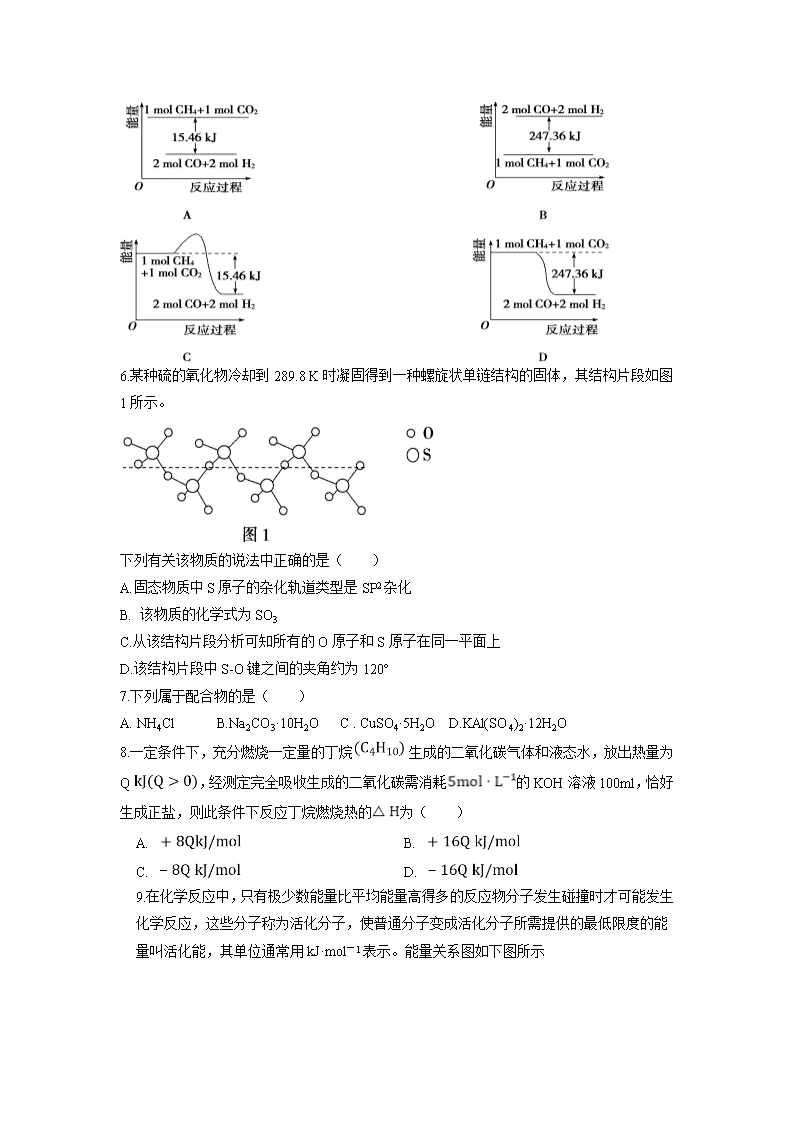
5.甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):
CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
能表示该反应过程中能量变化的是( )
6.某种硫的氧化物冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构片段如图1所示。
下列有关该物质的说法中正确的是( )
A.固态物质中S原子的杂化轨道类型是SP2杂化
B. 该物质的化学式为SO3
C.从该结构片段分析可知所有的O原子和S原子在同一平面上
D.该结构片段中S-O键之间的夹角约为120º
7.下列属于配合物的是( )
A. NH4Cl B.Na2CO3·10H2O C . CuSO4·5H2O D.KAl(SO4)2·12H2O
8.一定条件下,充分燃烧一定量的丁烷 生成的二氧化碳气体和液态水,放出热量为Q ,经测定完全吸收生成的二氧化碳需消耗的KOH溶液100ml,恰好生成正盐,则此条件下反应丁烷燃烧热的为( )
A. B.
C. D.
9.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。能量关系图如下图所示
下列有关说法中,正确的是:( )
A.图中所示反应为吸热反应
B.该反应需要加热或获取其它形式的能量才能发生
C.该反应的焓变ΔH=(E1-E2)KJ/mol
D.上图中虚线表示使用了催化剂,且反应物的活化能大于生成物的活化能
10.现有四种元素基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价④>③=②>①
11.下列有关说法不正确的是 ( )
A.SO42-的空间构型是正四面体形
B.CS2分子中各原子均达8电子稳定结构
C.CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
D.H2O2分子是既含极性键又含非极性键的非极性分子
12.已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH= ( )
A.ΔH1+ΔH2+ΔH3
B.ΔH1+ΔH2-ΔH3
C.ΔH1+2ΔH2+2ΔH3
D.2ΔH1+ΔH2+ΔH3
13.CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2C12(CO)2·2H20],其结构如图
下列有关氯化羰基亚铜的说法不正确的是:( )
A.该配合物的配体有CO、Cl、H2O三种
B.该复合物中Cl原子的杂化方式为SP3杂化
C.该配合物中,Cu+提供空轨道接受弧对电子形成配位键
D.该配合物中,中心离子的配位数为4
14.肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ: 3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ/mol
反应Ⅱ: N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ/mol
下列说法不正确的是( )
A.图1所示过程①是放热反应,②是吸热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为:
N2H4(g)= N2(g)+2H2(g) ΔH=-50.7 kJ/mol
15.下列各组微粒中,互为等电子体的一组是 ( )
A.CO、 C2H2、N2
B.SiF4、SiO44-、SO42-、PO43-
C.CO32-、NO3-、BeCl2
D.SO2、NO2+、N3-、CNO-
16.下列各组微粒的空间构型相同的是 ( )
①NH3和H2O ②NH和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥SiO和SO ⑦BF3和Al2Cl6
A.全部 B.除④⑥⑦以外 C.③④⑤⑥ D.②⑤⑥
二、非选择题:共4小题,共52分
17.(11分)(1)甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
③CH3OH(g)=CO(g)+2H2(g) ΔH3
已知反应②中相关化学键键能数据如下:
化学键
H—H
C==O
C≡O
H—O
E/kJ·mol-1
436
803
1 076
465
由此计算ΔH2=________kJ·mol-1。已知ΔH3=+99 kJ·mol-1,则ΔH1=________kJ·mol-1。
(2)已知分解1 mol H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为:①H2O2+I- → H2O+IO-慢 ②H2O2+IO- → H2O+O2+I-快
H2O2分解反应的热化学方程式为________________________________,该反应速率的快慢主要由第_______步(选择①或②,下同)决定。下图表示H2O2在无催化剂和少量I-的催化作用下的两步反应机理降低反应活化能的能量变化图,其中波峰A点代表反应机理___________。
(3)
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
①在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量的空气中燃烧,生成气体36 g,该过程放出的热量为________。
18.(13分)铁、钴、镍、铬、钼、钨都是重要的过渡元素,它们的单质和化合物在生活、生产中有广泛应用。
(1)基态铬原子核外价电子排布图为________;铬元素最高化合价为_______,已知一种铬的氧化物的化学式为CrO5,其中Cr的化合价为最高价,该氧化物的结构式为____________,1mol该氧化物中所含过氧键的数目__________。
(2)铬离子能形成多种配合物,例。
该配合物中的配位数为________。
上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
(3) FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则CO中的大π键应表示为________。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01 mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87 g,则该配合物的化学式为________________。
(5)镍与CO形成的一种配合物Ni(CO)x ,中心原子的价电子数和配体提供的孤电子数目之和为18,则X=________,1mol该配合物所含配位键的数目为_____。
19.(16分)元素周期表中的VA、VIA、VIIA族非金属元素的单质及其化合物用途非常广泛。回答下列问题:
I.(1)基态锑(Sb)原子价电子排布式为____。[H2F]+[SbF6]—
(氟酸锑)是一种超强酸,存在[H2F]+,该离子的VSEPR模型为______
II.已知: 含氧酸酸性强弱与非羟基氧原子数有关,几种含氧酸的分子式如下表:
酸的名称
次磷酸
亚磷酸
硼酸
亚砷酸
分子式
H3PO2
H3PO3
H3BO3
H3AsO3
类别
一元中强酸
二元中强酸
一元弱酸
三元弱酸
回答下列问题:
(2) H3PO2酸性比H3PO3弱的原因为___________________________________, H3PO2和过量的NaOH溶液反应的化学方程式是:_____________________,
(3)H3PO3和H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是一元中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构简式分别为 __________________, ______________________。
(4)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性,则H3BO3的电离方程式为_____________________
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 配位键 E 范德华力
(5)图1表示多硼酸根离子的一种无限长的链式结构,其化学式可表示为___________。
(6)硼酸晶体是片层结构,其中一层的结构如图2所示。硼酸在冷水中溶解度很小,但在热水中较大,原因是_________________________________。
20.(12分)周期表前四周期的元素a、b、c、d、e,m原子序数依次增大。a 的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d是电负性最大的元素,e与c同族;m的+1价阳离子的核外有3层电子且各层均处于全满状态。
回答下列问题:
(1)c元素与d元素能形成cd2分子,该分子的空间构型为__________。
(2) 与bc等电子体的一种分子的化学式为 ,根据等电子体原理在bc中b 原子轨道杂化类型是__________;c与b2是等电子体, c的电子式为_________________
(3)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是 (填化学式)。
(4)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ______________(填化学式,写一种即可);酸根呈三角锥结构的酸是 。(填化学式,写一种即可)
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图所示),该阳离子的化学式为___________________,该阳离子中做配体的两种微粒比较,键角较小的微粒是___________(填化学式),原因为_______________________________________
【参考答案】
一 选择题:共48分
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
A
C
C
B
D
B
C
D
B
A
D
A
A
D
B
C
二 非选择题: 共4小题, 共52分。
17.(11分)(1)+36 -63 (每空2分)
(2)2H2O2(l)=2H2O(l)+O2(g) ΔH=-196KJ/mol(2分) ① (1分) ①(1分)
(3)①石墨 393.5 kJ·mol-1 (或ΔH=-393.5 kJ·mol-1 ) ②252.0 kJ (每空1分)
18.(13分)(1) (1分) 6 (1分)
(2分) 2NA (1分)
(2) 6 (1分) (1分)
(3) sp2 (1分) Π (1分)
(4) [Co(NH3)5Cl]Cl2(1分)
(5) 4 (1分) 8NA(1分)
19. (16分)(1)5s25p3(1分) 四面体形(1分)
(2) H3PO2和H3PO3所含非羟基氧原子个数相等,H3PO3中P为+3价,H3PO2中P为+1价,化合价越高正电性越强,对共用电子对的吸引力越强,导致P-O-H中共用电子对更偏向O,更容易电离出H+,酸性更强(2分) H3PO2+NaOH=NaH2PO2+H2O (2分)
(3)(每个1分)
(4)①F>N>O>B(1分)
②H3BO3+H2O [B(OH)4]-+H+ (2分)
③ABD(2分)(对2个得1分,全对得2分,对1个或有错选0分)
(5)BO或 (BO2) 或 BnO (1分)
(6)晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,硼酸分子与水分子形成氢键,溶解度增大 (2分)
20.(12分)(1) V形 (1分)
(2)CO2或CS2 (1分) sp杂化 (1分) (2分)
(3)H2O2或N2H4(1分)
(4)HNO2或HNO3 (1分) H2SO3 (1分)
(5)[Cu(NH3)4(H2O)2]2+ (1分) H2O (1分)
NH3和H2O杂化轨道类型相同都为sp3杂化,H2O分子中O原子有两对孤对电子而NH3中N原子只有一对孤对电子,杂化轨道类型相同,孤对电子对数目越多,排斥力越大,键角越小。所以H2O键角比NH3小。(2分)