- 73.00 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学用语和化学计量
【教学目标】
1.熟记并正确书写常见元素的名称、符号、离子符号
2.熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。
3.了解原子结构示意图、分子式、结构式和结构简式的表示方法。
4.了解相对原子质量、相对分子质量的定义,并能进行相关计算。
5.理解质量守恒定律的含义。
6.能正确书写化学方程式,并能进行相关计算。
7.了解物质的量的单位—摩尔(mol),摩尔质量、气体摩尔体积、物质的量浓度、阿伏伽德罗常数的含义。
8.根据物质的量与微粒(分子、原子、离子等)数目、气体摩尔体积(标准状况)之间的相互关系进行相关计算。
9.了解溶液的组成,理解溶液中溶质质量分数的概念,并能进行相关计算。
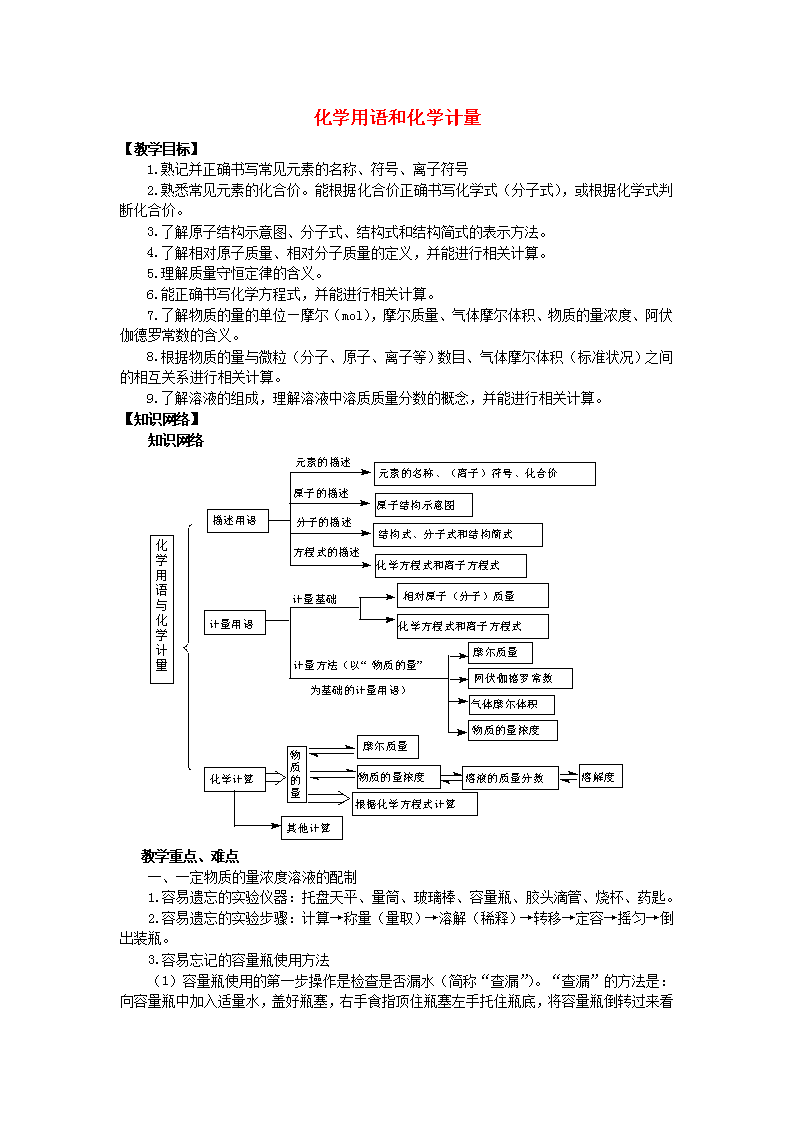
【知识网络】
知识网络
教学重点、难点
一、一定物质的量浓度溶液的配制
1.容易遗忘的实验仪器:托盘天平、量筒、玻璃棒、容量瓶、胶头滴管、烧杯、药匙。
2.容易遗忘的实验步骤:计算→称量(量取)→溶解(稀释)→转移→定容→摇匀→倒出装瓶。
3.容易忘记的容量瓶使用方法
(1)容量瓶使用的第一步操作是检查是否漏水(简称“查漏”)。“查漏”的方法是:向容量瓶中加入适量水,盖好瓶塞,
右手食指顶住瓶塞左手托住瓶底,将容量瓶倒转过来看瓶口处是否有水渗出,若没有将容量瓶正立,将瓶塞旋转180度,重复上述操作,如果瓶口处仍无水渗出,则此容量瓶不漏水。 若漏水,可以在瓶塞涂点凡士林。
(2)要选择规格合适的容量瓶。
①常见容量瓶的规格有:50mL、100mL、250mL、500mL、1000mL几种。如配制溶液时明确知道所需容量瓶规格,则需将容量瓶规格一并答上。
②根据所配制溶液的体积,选择合适的容量瓶,如配置480mL某浓度溶液,则需选用500mL容量瓶。
③不能用容量瓶直接溶解固体溶质,也不能用于稀释溶液。
④容量瓶不能用作反应容器,也不能用于长期贮存溶液。
4.容易忘记的注意事项
(1)如下图所示:用玻璃棒引流时,玻璃棒末端应插入到刻度线以下,且玻璃棒靠近容量瓶口处不能接触瓶口。
(2)在使用容量瓶过程中,如需要移动容量瓶,手应握在瓶颈刻度线以上,以免瓶内液体因受热而发生体积变化,导致溶液浓度不准确。
(3)定容摇匀后,液面低于刻度线,不能再滴加蒸馏水。
5.容易混淆的误差分析
进行误差分析的依据是c=,根据公式,分析各个量的变化,判断可能产生的误差。
(1)测定结果偏高的的是:砝码生锈,m偏大,结果偏高;定容时溶液温度高;用量筒量取液体时,仰视读数;定容时俯视容量瓶刻度线读数。
(2)测定结果偏低的是:称量时固体溶质与砝码位置放反而又使用游码;未洗涤烧杯及玻璃棒,使n减小,浓度偏低;定容时溶液温度过低;称量易吸水物质时称量时间过长;称量不干燥的物质;用量筒量取液体时,俯视读数;溶液在溶解、稀释、转移、定容和摇匀的过程中有液体溅出;定容时,滴加蒸馏水超过刻度线,再用胶头滴管吸出;定容摇匀后,液面低于刻度线,再滴加蒸馏水至刻度线。
(3)测量结果无影响的是:容量瓶内有少量水;定容摇匀后发现液面低于刻度线。
二、化学计算常用技巧
1.关系式法:对于多步进行的连续反应,尽管每一步反应都是独立的(反应条件和设备可能不同)但前一个反应的生成物是后一个反应的反应物,可根据中间产物的传递关系,找出原料和最终产物的关系式。利用关系式进行计算时要特别注意原料中的某些元素是否都转入了产物中,中间产物参与的反应中是否又有原始产物参与,不可盲目地根据起始物和产物中的原子守恒关系直接得出关系式。
2.差量法:根据化学变化前后物质的量发生的变化,找出所谓的“理论差值”。这个差值可以是质量、气体的体积、压强、物质的量、反应过程热量的变化等,该差值的大小与参与反应的物质的有关量成正比,借助这种比例关系,可解决一些量变的计算题。
3.守恒法:化学中的守恒有氧化还原反应电子守恒、溶液中的正负电荷守恒、连续反应中的原子守恒等。
4.极值法:极限法是一种极限思维方法,这种方法是通过极端假设,在题目给定的条件范围内取最大值和最小值,然后在最大值与最小值之间找出合适的选项。这种方法最适合解答选择性的计算题。
5.讨论法:适用于多个变量的计算题,方法是根据题目已知信息,列出关于要求的问题的关系式(可能有多个变量,一般为两个),然后根据化学的实际意义讨论,设一个变量为实际的数值来讨论另外的变量。
三、阿伏伽德罗定律及其推论可利用理想气体状态方程PV=nRT、ρ=、n=等推导。
【热点透视】
热点题型
【典例1】设NA是阿伏加德罗常数的数值,下列说法正确的是( )
A.1molAl3+含有的核外电子数为3NA
B.1molCl2与足量的铁反应,转移的电子数为3NA
C.10LpH=1的硫酸溶液中含有的H+离子数为2NA
D.10LpH=13的NaOH溶液中含有的OH-离子数为NA
解析:A选项中Al3+是10电子粒子;B选项中要以Cl2为依据;C选项中硫酸已经完全电离,不要重复计算;D选项由pH=13计算OH-浓度为0.1mol/L。
答案:D
命题意图:本题考查阿佛加德罗常数知识。主要考查了一定量的物质所含某种粒子数目的多少;氧化还原反应转移电子数目的多少;PH值与H+、OH—数目的换算等。该题目的在于考查学生对阿伏伽德罗常数的理解和应用。
【典例2】下列有关化学用语能确定为丙烯的是( )
解析:A属于球棍模型,但不一定是含有H的化合物;B可能是环丙烷;C中电子式少一个氢原子。
答案:D
命题意图:该题就结构式、电子式、结构简式、球棍模型等进行了考查,目的在于考查学生对于常见化学术语概念的理解和应用。
热点预测
【预测1】设NA是阿伏加德罗常数的数值,下列说法正确的是( )
A.1.6gNH2—和2.3gNa+所含的电子数均为NA
B.0.4molFe与0.8molHNO3(稀)反应,转移电子数为0.8NA
C.1L0.1mol·L-1Al2(SO4)3溶液中,Al3+的数目为0.2NA
D.T℃时,PH=6的纯水中,含10—6NA个OH—
解析:NH2—和Na+均为10电子体,0.1mol此两种离子均含有NA个电子,A项正确;Fe过量,由反应方程式3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O知0.8mol HNO3(稀)只能反应掉0.3molFe,转移电子数为0.6NA,B项错误;由于Al3+会发生水解反应,所以1L0.1mol·L-1Al2(SO4)3溶液中,Al3+的数目小于0.2NA,C项错误;D项未指明溶液体积,该项错误。
答案:A
【预测2】下列有关物质结构的表述正确的是( )
A.次氯酸的电子式
B.C—14原子:147C
222
8
1
+11
C.乙烯的比例模型:
D.钠离子的结构示意图:
解析:次氯酸的电子式为:,A项错误;C—14原子的质子数应为6,C项错误;钠离子是钠原子失去了最外层的1个电子,其原子结构示意图为:,D项错误。
答案:C
【直击高考】
1. NA为阿伏伽德罗常数,下列叙述错误的是( )
A.18gH2O中含的质子数为10NA
B.标准状况下,11.2L苯中含碳原子的个数为3 NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
2.若以ω1和ω2分别表示浓度为amol·L-1和bmol·L-1的氨水的质量分数,且知2a=b,则下列推断正确的是( )
A.2ω1=ω2 B.ω1=2ω2 C. 2ω1<ω2 D.ω1<ω2<2ω1
3.有硫酸镁溶液500mL,其密度为1.20g·mL-1,其中镁离子的质量分数是4.8%,则有关溶液的说法不正确的是( )
A.溶质的质量分数为24.0% B.溶液的物质的量浓度为2.4mol·L-1
C.溶质和溶剂的质量比为1﹕40 D.硫酸根离子的质量分数为19.2%
4.关于容量瓶的四种说法中,正确的是( )
①使用之前要检查是否漏水;②不能代替烧杯用于物质溶解
③是配制准确浓度溶液的仪器;④不能作为制备气体的发生装置
A.①③④ B.①④ C.①②③ D.①②③④
5.下列叙述正确的是( )
A.相同条件下,N2和O2的混合气体与等体积的N2所含有的原子数相等。
B.等物质的量的甲基(—CH3)与氢氧根(OH—)所含电子数相等
C.常温常压下,28gCO与22.4LO2所含分子数相等
D.16gCH4与18gNH4+所含质子数相等
6.在标准状况下将VL氨气溶解在1L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρg· mL-1,质量分数为ω,物质浓度为c mol·L-1,则下列关系中不正确的是( )
A.ρ=(17V+22400)/(22.4+22.4V) B.ω=17c/1000ρ
C. ω=17V/(17V+ 22400) D.c=1000Vρ/(17V+22400)
7.碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜。在高温条件下两种化合物均能分解生成氧化铜。溶解28.4g的上述混合物,消耗1.0 mol·L-1盐酸500mL。灼烧等量的上述混合物,得到的氧化铜的质量为( )
A.15g B.20g C.30g D.35g
8.一定量的氢气在氯气中燃烧,所得混合物用100mL3.00 mol·L-1
的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量浓度为0.500 mol·L-1。
(1)NaOH溶液的质量分数为 。
(2)所得溶液中NaCl的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比为n(Cl2)︰n(H2)= 。
答案
1.B 2.C 3.C 4.D 5.B 6.A 7.B 8.(1)10.7%(2)0.25(3)3︰2