- 1.09 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点3 几种常见的晶体
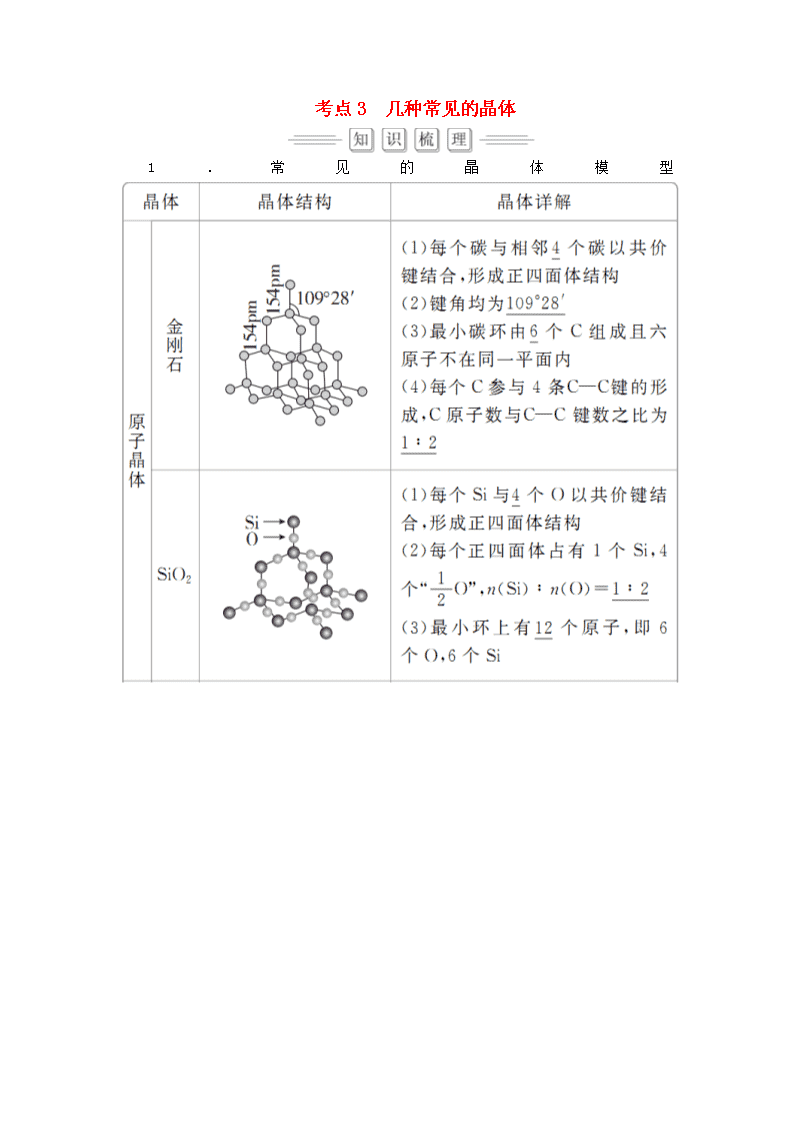
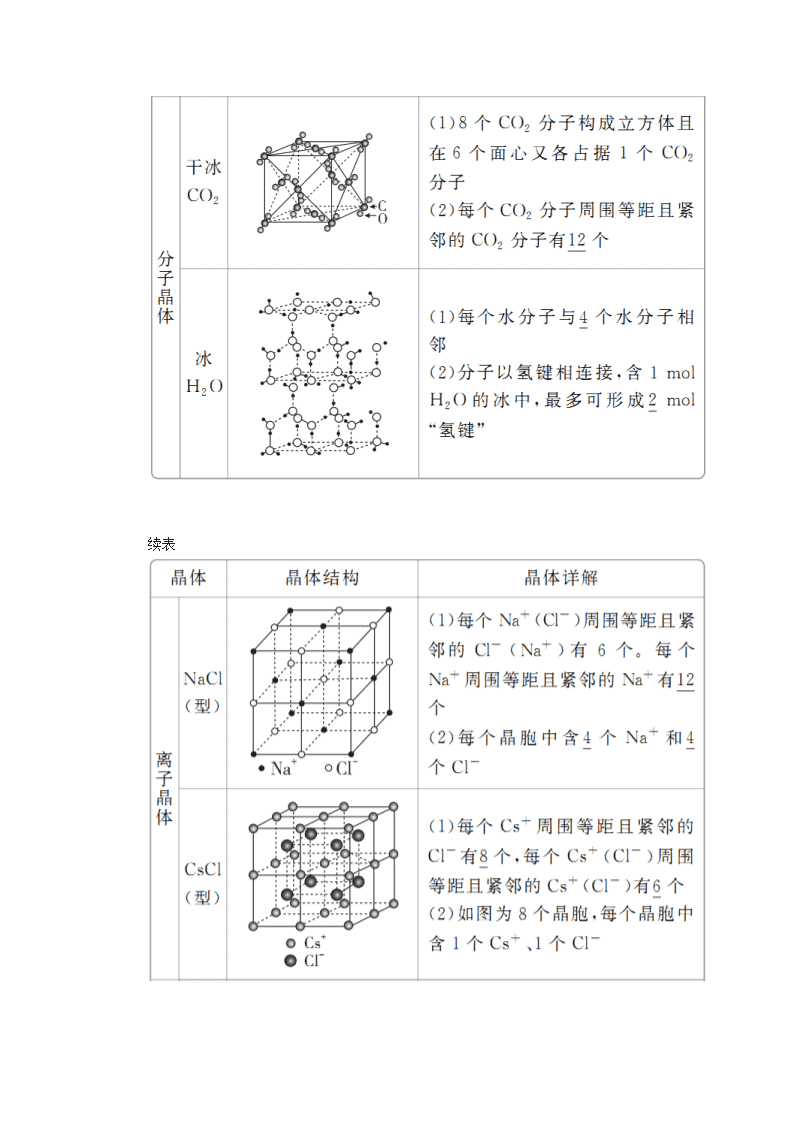
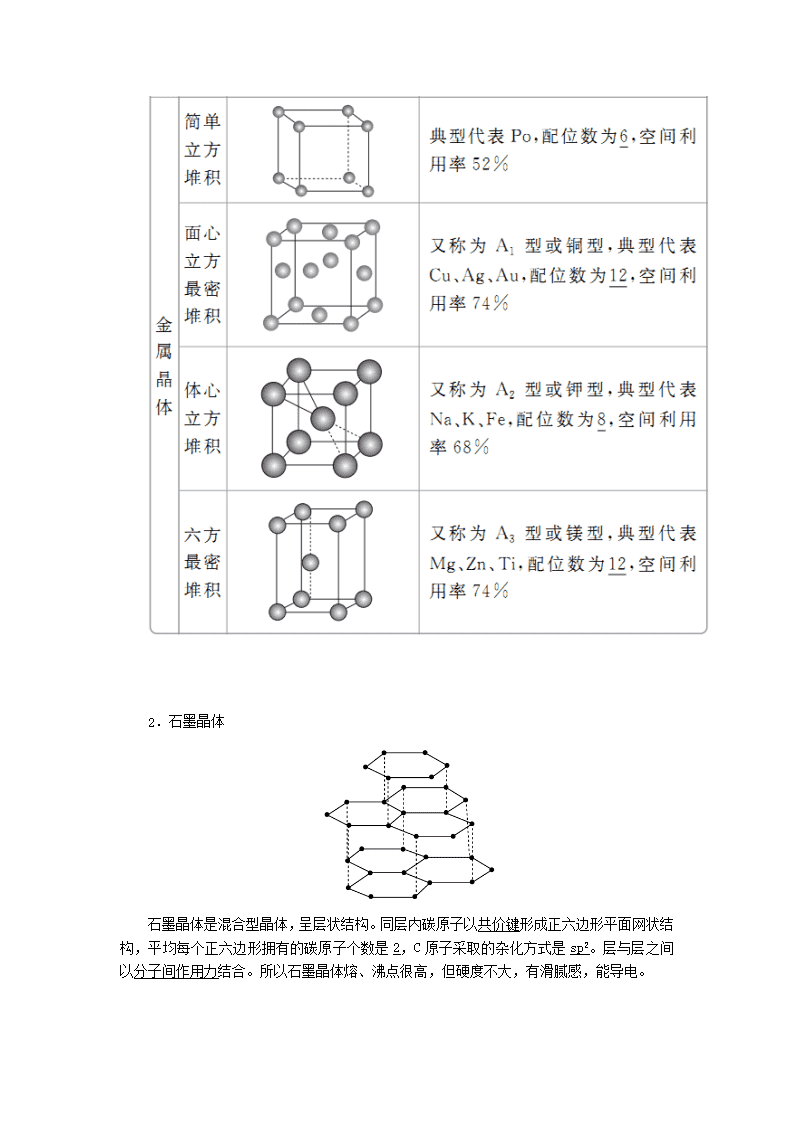
1.常见的晶体模型
续表
2.石墨晶体
石墨晶体是混合型晶体,呈层状结构。同层内碳原子以共价键形成正六边形平面网状结构,平均每个正六边形拥有的碳原子个数是2,C原子采取的杂化方式是sp2。层与层之间以分子间作用力结合。所以石墨晶体熔、沸点很高,但硬度不大,有滑腻感,能导电。
易错警示 判断某种粒子周围等距且紧邻的粒子数目时,要注意运用三维想象法。如NaCl晶体中,Na+周围的Na+数目(Na+用“”表示):
每个面上有4个,共计12个。
判断正误,正确的画“√”,错误的画“×”。
(1)1 mol金刚石和SiO2中含有的共价键数目均为4NA。(×)
(2)金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子。(√)
(3)氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个。(×)
(4)冰中包含的作用力有范德华力、氢键和共价键。(√)
(5)金属晶体能导电是因为金属晶体在外加电场作用下可失去电子。(×)
题组一 根据晶胞结构判断晶体类型
1.下图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为____________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体,原因是________________________
_________________________________________________________。
(4)每个Cu晶胞中实际占有________个铜原子,CaCl2晶体中Ca2+的配位数为________。
答案 (1)金刚石晶体
(2)金刚石、MgO、CaCl2、冰、干冰
(3)小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
答案 A
解析 由于r(Na+)>r(Mg2+)>r(Al3+),且Na+、Mg2+、Al3+所带电荷依次增大,所以NaF、MgF2、AlF3的离子键依次增强,晶格能依次增大,故熔点依次升高。r(F-)碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
答案 C
解析
选项A中晶体熔点与分子间作用力有关,相对分子质量越大,分子间作用力越大,选项A正确;选项B中硬度与共价键的键能有关,由于Si—Si键的键长大于C—Si键的键长大于C—C键的键长,键长越长,键能越小,选项B正确;选项C中熔点与金属键的强弱有关,金属性强,金属键弱,因此正确的顺序为Al>Mg>Na;选项D中晶格能的大小与离子半径和离子所带电荷数有关,选项D正确。
9.[2017·金版原创]下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2与SO3 ②C3N4(硬度大,熔点高)与SiC ③CO2与SO2 ④晶体氖与晶体氮 ⑤NaCl与AlCl3 ⑥NH4Cl与NaOH ⑦MgCl2与SiCl4
A.①③⑥ B.②③⑥ C.②④⑥ D.⑤⑥⑦
答案 B
解析 ①SiO2为原子晶体,SO3为分子晶体,错误;②C3N4与SiC均是含有共价键的原子晶体,正确;③CO2与SO2分子中都只含极性共价键,都属于分子晶体,正确;④晶体氖与晶体氮都是分子晶体,但晶体氖中不含化学键,晶体氮的分子中含有共价键,错误;⑤NaCl为离子晶体,AlCl3为分子晶体,错误;⑥NH4Cl与NaOH均为离子晶体,均含有离子键和共价键,正确;⑦MgCl2属于离子晶体,SiCl4属于分子晶体,错误。
二、非选择题(共46分)
10.(16分)确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:
A.________;B.________;C.________;D.________。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示,其中TiN中N呈-3价),已知3种离子晶体的晶格能数据如下表:
离子晶体
KCl
MgO
CaO
晶格能/kJ·mol-1
715
3791
3401
则该4种离子晶体的熔点从高到低的顺序是________。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如图2所示。X的元素符号是________,与同一个N3-相连的X+有________个。
(4)铁有δ、γ、α三种同素异形体(如图3),则δ晶胞原子堆积名称为______________。若α-Fe晶胞边长为a,γ-Fe晶胞边长为b,则两种晶体密度比为________。
答案 (1)金属晶体 分子晶体 离子晶体 原子晶体
(2)TiN>MgO>CaO>KCl
(3)Cu 6
(4)体心立方堆积 b3∶4a3
解析 (2)离子晶体中,离子半径越小,离子所带电荷越多,晶格能越大、熔点越高。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则X+为Cu+;采用X、Y、Z三轴切割的方法知与N3-相连的Cu+个数是6。
(4)δ晶胞原子堆积名称为体心立方堆积。根据晶胞结构可知,α-Fe晶胞、γ-Fe晶胞中含有的铁原子分别为1个和4个,所以有:ρ(α-Fe)=,ρ(γ-Fe)=,α-Fe和γ-Fe两种晶体的密度比为b3:4a3。
11.[2017·湖北鄂州模拟](15分)1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子,二价铜离子的电子排布式为____________________________,在CuSO4
溶液中滴入过量氨水,形成深蓝色溶液的溶质的化学式为________________。
答案 (1)晶体
(2)1 1s22s22p63s23p63d9(或[Ar]3d9)
[Cu(NH3)4]SO4
解析 (1)晶体中粒子在三维空间里呈周期性有序排列,有自范性,而非晶体中原子排列相对无序,无自范性,故该金属互化物属于晶体。
12.[2017·湖北襄阳调研](15分)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。回答下列问题(需要用到元素符号或分子式的,请用相应元素的元素符号或分子式作答):
图1
(1)a与b对应的元素可形成10电子中性分子X,写出带一个单位正电荷的1个X的等电子体________。将X溶于水后的溶液滴入到CuSO4溶液中至过量,再加入适量乙醇,可析出一种深蓝色晶体,其化学式为__________________________________。
(2)元素c位于元素周期表的____________区,d原子次外层有____________对自旋相反的电子,c、d单质的晶体堆积方式类型分别是________、________。
A.简单立方堆积 B.体心立方堆积
C.六方最密堆积 D.面心立方最密堆积
(3)d的一种氯化物为白色立方结晶,熔点430 ℃,沸点1490 ℃,其熔融态导电性差,晶胞结构如图2。该氯化物固体属于______晶体,其中氯原子的配位数为________。
图2
(4)e元素与氧可形成如图3中A所示的正四面体离子eO
,其中e在正四面体的体心,eO四面体通过共用顶角氧离子可形成B,则B的化学式为________。
图3
(5)单质a、f对应的元素以1∶1的原子个数比形成的分子(相同条件下对H2的相对密度为39)中含__________个σ键和____________个π键,其中f原子的杂化轨道类型为____________________。
答案 (1)H3O+ [Cu(NH3)4]SO4·H2O
(2)s 9 B D
(3)分子 4
(4)Si3O
(5)12 1 sp2杂化
解析 根据c、d均是热和电的良导体,且d的熔点高于c,确定c是Na,d是Cu。根据熔点高低可判断a是H2,b是N2,e是Si,f是金刚石。
(1)a与b对应的关系为H与N,形成的10电子中性分子X是NH3,与NH3互为等电子体的带一个单位正电荷的是H3O+。NH3与Cu2+可形成配位键,故深蓝色晶体为[Cu(NH3)4]SO4·H2O。
(2)Na位于第三周期ⅠA族,位于s区,Cu原子的M层有9个轨道,均充满电子,故有9对自旋相反的电子,钠单质采用体心立方堆积,铜单质采用面心立方最密堆积。
(3)根据这种氯化物熔沸点较低、熔融态导电性差确定其应为分子晶体,其中与氯原子相连的Cu原子有4个,故配位数为4。
(4)B中含有3个Si原子和9个O原子,根据化合价可判断其化学式为Si3O。
(5)该分子的式量=39×2=78,则化学式为C6H6,分子中含有6个C—C σ键和6个C—H σ键,形成一个大π键,C原子采用sp2杂化。
相关文档
- 2020届高考化学一轮复习化学计量在2021-07-034页
- 2019届高考化学一轮复习化学反应与2021-07-0318页
- 2021届高考化学一轮复习化学平衡状2021-07-027页
- 2020届高考化学一轮复习化学反应速2021-07-0218页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0215页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0219页
- 2020版高考一轮复习化学通用版学案2021-07-029页
- 2020届高考化学一轮复习化学反应与2021-07-028页
- 2020届高考化学一轮复习化学反应进2021-07-0215页
- 2020版高考一轮复习化学通用版学案2021-07-0210页