- 291.00 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
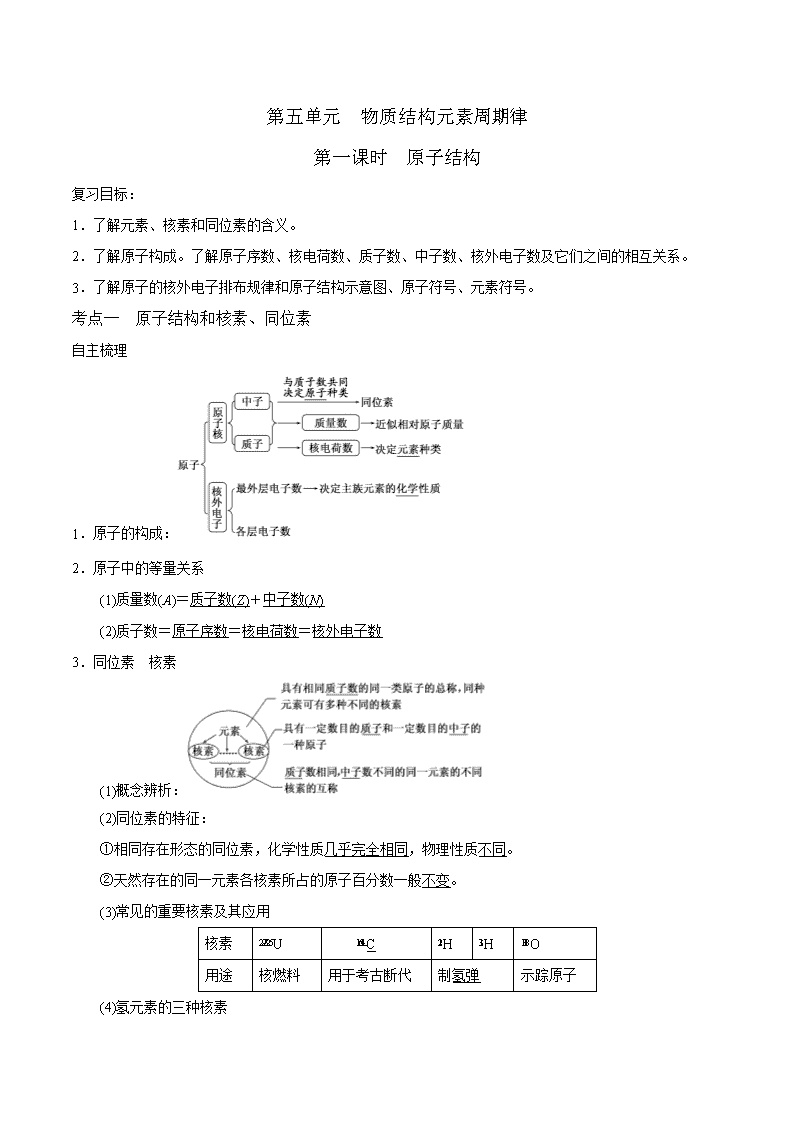
第五单元 物质结构元素周期律
第一课时 原子结构
复习目标:
1.了解元素、核素和同位素的含义。
2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数及它们之间的相互关系。
3.了解原子的核外电子排布规律和原子结构示意图、原子符号、元素符号。
考点一 原子结构和核素、同位素
自主梳理
1.原子的构成:
2.原子中的等量关系
(1)质量数(A)=质子数(Z)+中子数(N)
(2)质子数=原子序数=核电荷数=核外电子数
3.同位素 核素
(1)概念辨析:
(2)同位素的特征:
①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用
核素
U
C
H
H
O
用途
核燃料
用于考古断代
制氢弹
示踪原子
(4)氢元素的三种核素
H:名称为氕,不含中子
H:用字母D表示,名称为氘或重氢
H:用字母T表示,名称为氚或超重氢
4.元素符号周围数字的意义:
5.“四量”——原子质量、原子的相对原子质量、元素的相对原子质量、质量数
原子质量
原子的相对原子质量
元素的相对原子质量
质量数
定义
指某元素某种核素的一个原子的真实质量
一个原子的真实质量与一个C原子质量的的比值
该元素各种核素的相对原子质量与其在自然界中所占原子个数百分比的乘积之和
一个原子的质子数与中子数的和
实例
一个O原子的质量是2.657×10-26kg
O的相对原子质量约为16
Mr=Mr1a%+Mr2b%+…(其中a%+b%+…=1)
O的质量数为16
【易错警示】判断正误,正确的划“√”,错误的划“×”
(1)34S原子核内中子数为16( )
(2)2H+核外电子数为2( )
(3)1HO的摩尔质量为20g·mol-1( )
(4)13C和15N核内中子数相差1( )
(5)H3O+和OH-中具有相同的质子数和电子数( )
(6)O和S2-具有相同的质子数和电子数( )
【答案】(1)× (2)× (3)√ (4)√ (5)× (6)√
例1、2016年1月5日,江西省国土资源厅宣布,该省地质工作者在浮梁县发现超大型钨铜矿。下列有关W、W、W的说法正确的是( )
A.它们是钨的三种元素
B.它们互为同位素
C.W的中子数与质子数之差为110
D.它们的所有性质几乎完全相同
【答案】B
【解析】它们是钨的三种核素,A项错误;B项,它们的质子数相同、中子数不同,互为同位素,B项正确;
W的质量数与质子数之差为110,中子数与质子数之差为36,C项错误;它们的化学性质几乎完全相同,但物理性质不同,D项错误。
【发散类比1】下列说法中,正确的是( )
A.18O原子核内的中子数为8
B.16O2和18O2的化学性质几乎相同
C.HO与HO质子数不同
D.H2和D2属于同位素
【答案】B
【方法技巧】原子、离子、中子的数量关系
粒子
关系
原子X
质子数=核电荷数=核外电子数
阳离子Xn+
核外电子数=质子数-电荷数n
阴离子Xn-
核外电子数=质子数+电荷数n
例2、中新网2013年5月3日报道,铁60同位素显身,揭秘了超新星爆炸历史真相。下列说法中正确的是( )
A.铁元素的质量数为60
B.Fe的核内质子数比中子数多8
C.Fe与Fe的核外电子数相同,属于同一种核素
D.Fe与Fe的化学性质相似,互为同位素
【答案】D
【解析】Fe这种铁原子的质量数为60,而不是铁元素的质量数,A错;Fe的核内质子数(26)比中子数(34)少8,B错;Fe与Fe的质子数相同但中子数不同,是两种不同的核素,C错;Fe与Fe是同种元素的不同核素,互为同位素,化学性质相似,D对。
【发散类比2】同位素示踪技术已广泛应用在农业、工业、医学、地质及考古等领域。下列有关叙述正确的是( )
A.14C与12C是两种不同的元素或核素
B.通过化学变化可以实现16O与18O之间的相互转化
C.35Cl2与37Cl2互为同素异形体
D.铯元素的两种同位素中137Cs比133Cs多4个中子
【答案】D
【方法技巧】原子结构与同位素的认识误区
(1)原子不一定都有中子,如H。
(2)质子数相同的微粒不一定属于同一种元素,如F与OH-。
(3)核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+、F-等,NH与OH-等。
(4)不同的核素可能具有相同的质子数,如H与H;也可能具有相同的中子数,如6C与O;也可能具有相同的质量数,如C与N;也可能质子数、中子数、质量数均不相同,如H与C。
(5)同位素的物理性质不同但化学性质几乎相同。
(6)不同核素之间的转化属于核反应,不属于化学反应。
考点二核外电子排布
自主梳理
1.核外电子排布规律:
2.原子结构示意图:
3.核外电子排布与元素性质的关系
(1)金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出还原性,在化合物中显正化合价。
(2)非金属元素原子的最外层电子数一般大于或等于4,较易获得电子,活泼非金属原子易形成阴离子。在化合物中主要显负化合价。
(3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
【深度思考】根据1~18号元素,确定符合下列条件的元素
(1)原子核中无中子的原子:________。
(2)最外层有1个电子的元素:________。
(3)最外层有2个电子的元素:________。
(4)最外层电子数等于次外层电子数的元素:________。
(5)最外层电子数是次外层电子数2倍的元素:________;最外层电子数是次外层电子数3
倍的元素:________;最外层电子数是次外层电子数4倍的元素:________。
(6)电子层数与最外层电子数相等的元素:________。
(7)电子总数为最外层电子数2倍的元素:________。
(8)次外层电子数是最外层电子数2倍的元素:________。
(9)内层电子总数是最外层电子数2倍的元素:________。
(10)电子层数是最外层电子数2倍的元素:________。
(11)最外层电子数是电子层数2倍的元素:________。
(12)最外层电子数是电子层数3倍的元素:________。
【答案】(1)H (2)H、Li、Na (3)He、Be、Mg (4)Be、Ar (5)C O Ne (6)H、Be、Al (7)Be
(8)Li、Si(9)Li、P (10)Li (11)He、C、S (12)O
例3、短周期主族元素X、Y、Z、R的原子序数依次增大,核电荷数之和为36;X、Z原子的最外层电子数之和等于Y原子的次外层电子数;R原子的质子数是Y原子质子数的两倍。下列有关这四种元素的相关叙述正确的是( )
A.X的三种核素中均含有质子和中子
B.X与R组成的化合物溶于水呈碱性
C.R的离子结构示意图为
D.Y与Z可形成两种氧化物
【答案】D
【解析】短周期主族元素X、Y、Z、R的原子序数依次增大,核电荷数之和为36;X、Z原子的最外层电子数之和等于Y原子的次外层电子数;R原子的质子数是Y原子质子数的两倍,由原子序数关系可知X、Z原子的最外层电子数之和应为2,Y的次外层电子数为2,则X为H元素,Z为Na元素,Y为O元素,R为S元素。
【发散类比3】两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有( )
A.1对 B.2对C.3对 D.4对
【答案】B
【方法技巧】
(1)注意元素范围如短周期,前20号元素等。
(2)注意看清是“最外层电子数”“次外层电子数”还是“内层电子数”。
(3)最外层电子数为次外层电子数的2倍以上时,次外层一定是K层。
(4)符合某种描述的元素不一定是一种。
(5)注意原子结构示意图与离子结构示意图的区别。
例4、已知A、B、C、D是中学化学中常见的四种不同多核粒子,它们之间存在如下关系:
(1)如果A、B、C、D均是10电子的粒子。请写出:
A与B反应的离子方程式为___________________________________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式_____________________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)__________。
(3)已知肼(H2N—NH2)和甲胺(CH3—NH2)都是18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):________________。
【答案】(1)NH+OH-NH3↑+H2O (2)①HS-+OH-===S2-+H2O②OH->S2-
(3)CH3—CH3、CH3—F、CH3—OH(任写2个)
【解析】(1)若A、B、C、D均为10e-粒子,根据图可知A为NH,B为OH-,C为NH3,D为H2O
(2)若A、C为18e-粒子,B、D为10e-粒子,由图示可知A为HS-,B为OH-,C为S2-,D为H2O。
(3)根据H2N—NH2、CH3—NH2均为18个电子分子,可得—NH2、—CH3均为9电子基团,其他为9电子基团的还有—OH、—F。故构成18电子的有机分子为CH3—OH、CH3—F、CH3—CH3。
【发散类比4】下列各微粒:①H3O+、NH、Na+;②OH-、NH、F-;③O、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是( )
A.①②③ B.①②④C.②③④ D.①③④
【答案】B
【归纳总结】等电子粒子的寻找规律
(1)“10电子”微粒:
(2)“18电子”微粒:
CH3—CH3、H2N—NH2、HO—OH、F—F、F—CH3、CH3—OH……
(3)其他等电子微粒
①2电子微粒:
②“14电子”微粒:Si、N2、CO、C2H2、C
③“16电子”微粒:S、O2、C2H4、HCHO
相关文档
- 2020届高考化学一轮复习化学平衡常2021-07-0310页
- 2020届高考化学一轮复习化学计量在2021-07-034页
- 2019届高考化学一轮复习化学反应与2021-07-0318页
- 2021届高考化学一轮复习化学平衡状2021-07-027页
- 2020届高考化学一轮复习化学反应速2021-07-0218页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0215页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0219页
- 2020版高考一轮复习化学通用版学案2021-07-029页
- 2020届高考化学一轮复习化学反应与2021-07-028页
- 2020届高考化学一轮复习化学反应进2021-07-0215页