- 331.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
甘肃省武威第一中学2019-2020学年高一10月月考
化学试题
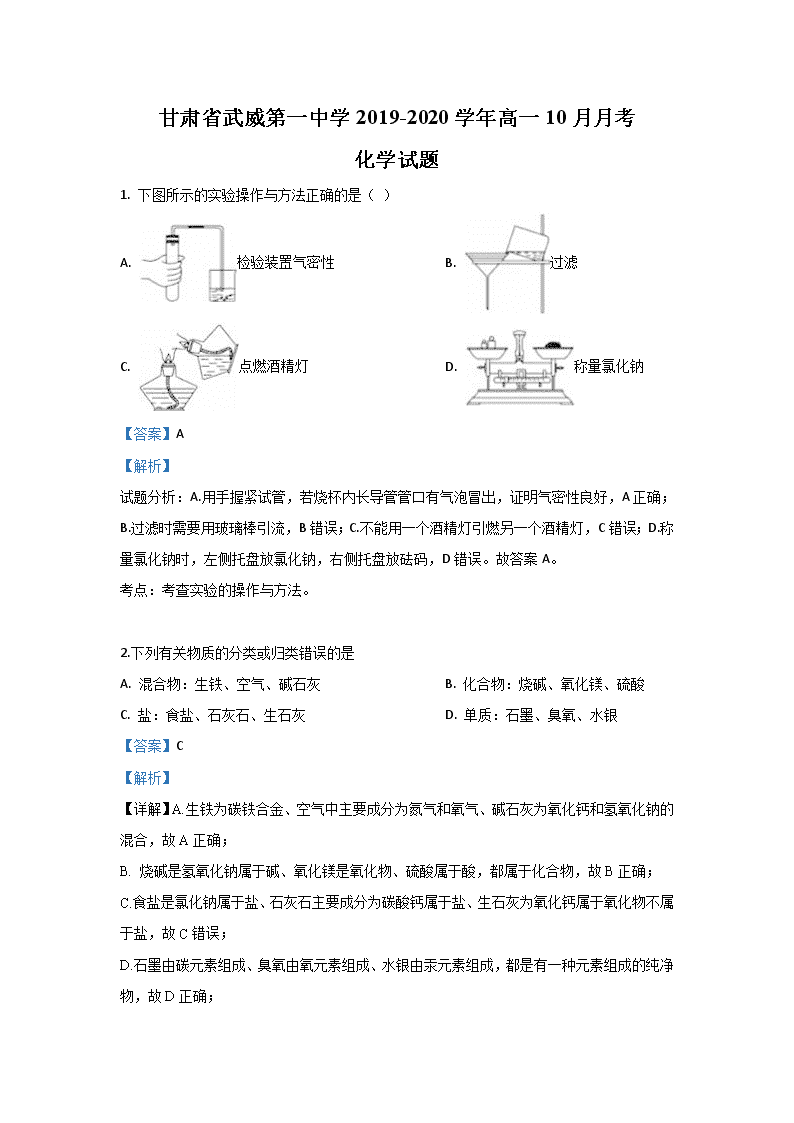
1. 下图所示的实验操作与方法正确的是( )
A. 检验装置气密性 B. 过滤
C. 点燃酒精灯 D. 称量氯化钠
【答案】A
【解析】
试题分析:A.用手握紧试管,若烧杯内长导管管口有气泡冒出,证明气密性良好,A正确;B.过滤时需要用玻璃棒引流,B错误;C.不能用一个酒精灯引燃另一个酒精灯,C错误;D.称量氯化钠时,左侧托盘放氯化钠,右侧托盘放砝码,D错误。故答案A。
考点:考查实验的操作与方法。
2.下列有关物质的分类或归类错误的是
A. 混合物:生铁、空气、碱石灰 B. 化合物:烧碱、氧化镁、硫酸
C. 盐:食盐、石灰石、生石灰 D. 单质:石墨、臭氧、水银
【答案】C
【解析】
【详解】A.生铁为碳铁合金、空气中主要成分为氮气和氧气、碱石灰为氧化钙和氢氧化钠的混合,故A正确;
B. 烧碱是氢氧化钠属于碱、氧化镁是氧化物、硫酸属于酸,都属于化合物,故B正确;
C.食盐是氯化钠属于盐、石灰石主要成分为碳酸钙属于盐、生石灰为氧化钙属于氧化物不属于盐,故C错误;
D.石墨由碳元素组成、臭氧由氧元素组成、水银由汞元素组成,都是有一种元素组成的纯净物,故D正确;
答案选C。
3. 下列实验操作中错误的有
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的瓶底
C. 过滤时,玻璃棒下端在引流过程中应靠在三层滤纸处
D. 称量时,称量物放在纸上置于托盘天平左盘,砝码直接放在天平右盘
【答案】BD
【解析】
略
4.根据物质的组成对物质进行分类,和其他三种物质不属于一类的是( )
A. NaHSO4 B. Na2O C. Na2CO3 D. NaHCO3
【答案】B
【解析】
【详解】通过观察选项可知,四种物质均为含钠化合物,Na2CO3、NaHCO3、NaHSO4均属于钠盐,而Na2O属于钠的氧化物,与其它三个物质不属于一类,故答案为B。
5.有下列仪器:①烧杯;②蒸发皿;③平底烧瓶;④试管;⑤坩埚;⑥锥形瓶。其中可以用酒精灯直接加热的仪器是
A. ①②④⑤⑥ B. ②④⑤ C. ①③⑥ D. ④⑥
【答案】B
【解析】
【详解】可以用酒精灯直接加热的仪器有:坩埚、蒸发皿、试管、燃烧匙等,垫上石棉网可以加热的仪器有烧杯、烧瓶、锥形瓶等,所以能够直接加热的为:②④⑤;
答案选B。
6. 下列实验操作中正确的是( )
A. 手持试管给试管里的物质加热 B. 将鼻孔凑到集气瓶口闻气体的气味
C. 酒精灯的火焰可以用嘴吹灭 D. 一般用药匙或镊子取用固体药品
【答案】D
【解析】
试题分析:A.用试管夹夹持试管给试管里的物质加热,错误;B.用手扇闻的方法闻气体的气味,错误;C.酒精灯的火焰可以用酒精灯的灯冒熄灭,错误;D.一般用药匙或镊子取用固体药品,正确。
考点:考查实验操作的正误判断的知识。
7. 奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )
①
②
③
④
A
Na2SO4
K2SO4
KCl
(NH4)2SO4
B
NaCl
K2SO4
KCl
NH4Cl
C
Na2SO4
K2SO4
KCl
NH4Cl
D
NaCl
K2SO4
KCl
(NH4)2SO4
【答案】C
【解析】
试题分析:A(NH4)2SO4不是盐酸盐。错误。B NaCl不是硫酸盐。错误。C物质分类正确。D NaCl不是硫酸盐,(NH4)2SO4不是盐酸盐。错误。
考点:考查各种盐的分类的知识。
8.下列说法正确的是
A. 1mol 固体或液体的体积主要由微粒间距离决定
B. 1mol气体的体积主要由微粒的大小决定
C. O2的气体摩尔体积约为22.4L·mol-1
D. 气体微粒间的距离受温度压强影响大,固体或液态微粒间的距离受温度压强影响小
【答案】D
【解析】
【详解】A.物质三态中气体分子之间的间隔最大,固体或液体中粒子间隔最小,则1mol固体或液体的体积主要由粒子的大小决定,A错误;
B.气体的体积受分子数目、分子之间距离及粒子大小影响,相同条件下气体分子间的距离远大于粒子的大小,则气体的体积大小受分子数目、分子之间距离影响,因此在相同条件下1mol气体的体积主要由分子间距离决定的,B错误;
C.状况未知,气体的摩尔体积不确定,在标况下O2的气体摩尔体积约为22.4L·mol-1,C错误;
D.物质三态中气体分子之间的间隔最大,固体或液体中粒子间隔最小,因此气体微粒间的距离受温度压强影响大,固体或液态微粒间的距离受温度压强影响小,D正确;
答案选D。
9.绿色植物是空气天然的“净化器”,研究发现,1万平方米柳杉每月可以吸收160 kg SO2,则1万平方米柳杉每月吸收的SO2的物质的量为( )
A. 164 kg B. 2.5 mol C. 2500 g/mol D. 2500 mol
【答案】D
【解析】
试题分析:160 kg SO2的物质的量是,答案选D。
考点:考查物质的量的计算
10.下列说法正确的是
A. 常温常压下,氯气的摩尔质量等于71 g
B. 1 mol H2SO4中含有2 mol氢元素
C. 某物质摩尔质量就是该物质的相对分子质量或相对原子质量
D. 2 g氦气所含的原子数目约为0.5×6.02×1023
【答案】D
【解析】
【详解】A.摩尔质量的单位是g/mol,故A错误;
B. 1 mol H2SO4中含有2 mol氢原子,要指明粒子的类别,元素不可数,故B错误
C. 摩尔质量和相对分子质量或相对原子质量的单位不同,两者在数值上相同,故某物质的摩尔质量在数值上等于该物质的相对分子质量或相对原子质量,故C错误;
D. 2g氦气的物质的量为n==0.5mol,而氦气为单原子分子,故0.5mol氦气中含0.5mol氦原子即0.5NA个,故D正确。
答案选D。
11. 下列说法中正确的是
A. 摩尔是可以把物质的质量与微观粒子数联系起来的一个基本物理量
B. 0.012 kg12C中所含的碳原子数为NA
C. 物质的摩尔质量等于其相对分子(原子)质量
D. 1mol任何物质都含有约6.02×1023个原子
【答案】B
【解析】
试题分析:A、物质的量是把宏观和微观联系起来的一个基本物理量,摩尔是物质的量的单位,故错误;B、阿伏加德罗常数规定是0.012kg碳-12中所含碳原子的数,故正确;C、摩尔质量在数值上等于其相对原子质量或相对分子质量,故错误;D、1mol任何微粒含有的微粒数是6.02×1023,有的物质是分子组成,如氧气,1mol氧气中含有氧原子数为2×6.02×1023,故错误。
考点:考查物质的量、阿伏加德罗常数、摩尔质量等知识。
12. 下列两种气体的分子数一定相等的是( )
A. 质量相等、密度不同的N2和C2H4
B. 体积相等的CO和N2
C. 等温、等体积O2和N2
D. 等压、等体积的N2和CH4
【答案】A
【解析】
试题分析:A、N2和C2H4的摩尔质量都是28g/mol,二者质量相等时物质的量相等,所含分子数一定相等,A正确;B、体积相等的CO和N2,二者的温度和压强不一定相等,若温度和压强相等,分子数相等,若温度和压强不等,分子数不一定相等,B错误;C、等温等体积的O2和N2,二者的压强不一定相同,若压强相同,含有的分子数相同,若压强不同含有的分子数不同,C错误;D、等压等体积的N2和C2H4,二者的温度不一定相同,若温度相同,含有的分子数相同,若温度不同,含有的分子数与温度成反比,D错误。
考点:考查了气体摩尔体积和阿伏伽德罗定律的应用的相关知识。
13.实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为 ( )。
A. 950 mL;201.4 g B. 1 000 mL;212.0 g
C. 100 mL;21.2 g D. 500 mL;100.7 g
【答案】B
【解析】
【详解】实验室没有950mL的容量瓶,因此需要配置1000mL,则需要称取碳酸钠的质量是1L×2.0mol/L×106g/mol=212.0g,答案选B。
14.设NA表示阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液的叙述不正确的是
A. 2 L溶液中阴阳离子总数为1.2NA
B. 500 mL溶液中NO3-浓度为0.2 mol/L
C. 500 mL溶液中Ba2+浓度0.2 mol/L
D. 500 mL溶液中NO3-物质的量为0.2 mol
【答案】B
【解析】
A、溶液中Ba(NO3)2的物质的量n=cV=0.2mol/L×2L=0.4mol,而1mol Ba(NO3)2中含1mol钡离子和2mol硝酸根即含3mol离子,则0.4mol Ba(NO3)2中含1.2mol离子即1.2NA个,A正确;B、0.2mol•L-1 Ba(NO3)2溶液NO3-浓度为0.4mol/L,与所取溶液的体积无关,B错误;C、0.2mol•L-1 Ba(NO3)2溶液Ba2+浓度为0.2mol/L,与所取溶液的体积无关,C正确;D、500mL溶液中含有Ba(NO3)2的物质的量n=cV=0.2mol/L×0.5L=0.1mol,而1mol Ba(NO3)2中含2mol NO3-,故0.1mol Ba(NO3)2中含0.2mol硝酸根,D正确,答案选B。
15.下列溶液中物质的量浓度为1 mol·L-1的是 ( )
A. 将250 g CuSO4·5H2O溶解在1 L水中
B. 将22.4 L HCl气体溶于水配成1 L溶液
C. 将1 L 10 mol·L-1的浓盐酸加入9 L水中
D. 将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
【答案】D
【解析】
【详解】A、溶液的体积不是1L,不能计算物质的量浓度,A错误;
B、氯化氢的物质的量不一定是1mol,其浓度不一定是1mol/L,B错误;
C、稀释后溶液的体积不是10L,不能计算盐酸的浓度,C错误;
D、10g氢氧化钠是10g÷40g/mol=0.25mol,溶液的体积为0.25L,所以浓度是1mol/L,D正确,
答案选D。
16.将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为b g·mL-1,则该盐酸的物质的量浓度(mol·L-1)是
A. B. C. D.
【答案】C
【解析】
【详解】氯化氢的物质的量,氯化氢的质量,
溶液的体积,
则。
答案选C
17.设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )
A. 22.4ap/bNA B. 22.4ab/pNA C. 22.4NAb/a D. 22.4pb/aNA
【答案】D
【解析】
如果ag某双原子分子气体的分子数为P,则其物质的量是,所以该气体的摩尔质量是,则bg该气体在标准状况下的体积为,答案选D。
18.设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温常压下,28 g CO和N2的混合气体一定含有2NA个原子
B. 在常温、常压下,11.2L N2含有的分子数目为0.5NA
C. 标准状况下,64 g的SO2含NA个氧原子
D. 0.2mol/L KCl溶液中含有0.2 NA个Cl-
【答案】A
【解析】
【详解】A. CO和N2的相对分子质量均为28,均为双原子分子,所以28 g CO和N2的混合气体的物质的量为1mol,含有的原子总数一定含有2NA,故A正确;
B. 在常温、常压下,11.2L N2的物质的量不为0.5mol,含有的分子数目不等于0.5NA,故B错误;
C. 标准状况下,64 g的SO2为1mol ,含2NA个氧原子,故C错误;
D.没有给定体积,无法计算出 0.2mol/L KCl溶液中含有Cl-的数目,故D错误
答案选A。
19.在体积相同的两个密闭容器中分别充满O2、O3气体,当两个容器内温度和气体密度相等时,说法正确的是 ( )
A. 两种气体的压强相等 B. O2比O3质量小
C. 两种气体的分子数目相等 D. 两种气体的氧原子数目相等
【答案】D
【解析】
【分析】
相同体积相同密度时,两容器气体的质量相等,且都由O元素组成的同素异形体,则O原子的质量、个数以及物质的量相等,据此分析解答。
【详解】A、O原子个数相等时,气体的物质的量之比为n(O2):n(O3)=3:2,由PV=nRT可知,两种气体的压强之比为3:2,故A错误;
B、同体积相同密度时,两容器气体的质量相等,故B错误;
C、O原子个数相等时,气体的物质的量之比为n(O2):n(O3)=3:2,故C错误;
D、相同体积相同密度时,两容器气体的质量相等,且都由O元素组成,因此O原子数目相等,故D正确。
答案选D。
20. 下列说法不正确的是
A. 温度相同、体积相同的O2(g)和N2(g)分子数相同
B. 等温等压下,SO2气体与CO2气体的密度之比等于16∶11
C. 温度和容积相同的两气罐中分别盛有5mol O2(g)和2 mol N2(g),两容积中的压强之比等于5∶2
D. 等温等压条件下, 5 molO2(g)和2 molH2(g)的体积之比等于5∶2
【答案】A
【解析】
【详解】A项,压强没有确定,温度相同、体积相同的O2(g)和N2(g)分子数不一定相同,错误;
B项,等温等压下,SO2气体与CO2气体的密度之比等于其相对分子质量之比,为64:44=16∶11,正确;
C项,温度和容积相同的两气罐中的压强之比等于气体分子物质的量之比,即为5∶2,正确;
D项,等温等压条件下,两气体的体积之比等于气体分子物质的量之比,即为5∶2,正确;
答案选A。
21.若20 g密度为ρ g·mL-1的Ca(NO3)2溶液中含有2 g Ca(NO3)2,则溶液中NO3-的物质的量浓度为
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
【答案】C
【解析】
该硝酸钙溶液中溶质的质量分数为:×100%=10%,则该溶液中硝酸钙的物质的量浓度为:c=mol/L=mol/L=mol/L,所以溶液中NO3-的物质的量浓度为:c(NO3-)=2c[Ca(NO3)2]=mol/L×2=mol/L,故答案为C。
点睛:确物质的量浓度与溶质质量分数的关系为解答关键,先计算出该硝酸钙溶液中溶质的质量分数,然后根据c=mol/L计算出该溶液中硝酸钙的物质的量浓度,再结合硝酸钙的化学式计算出溶液中硝酸根离子的浓度。
22.标准状况下有①0.112 L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol NH3,下列对这四种物质的关系由小到大排列正确的是
A. 体积:①③②④ B. 密度:④①③②
C. 质量:①④③② D. 氢原子数:②④③①
【答案】D
【解析】
【详解】①标准状况下0.112 L水的质量是112g,物质的量是112g÷18g/mol=6.2mol,氢原子的物质的量是12.4mol;
②3.01×1023个氯化氢分子的物质的量是0.5mol,质量是18.25g,氢原子的物质的量是0.5mol;
③13.6 g H2S气体的物质的量是13.6g÷34g/mol=0.4mol,氢原子的物质的量是0.8mol;
④0.2 mol氨气的质量是3.4g,氢原子的物质的量是0.6mol。则
A、体积:①④③②,A错误;
B、密度:④③②①,B错误;
C.质量:④③②①,C错误;
D.氢原子数:②④③①,D正确;
答案选D。
【点晴】在进行物质的量的有关计算时,关键是熟练应用几个关系式、n=m/M、、,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。另外该题还要注意分子以及组成分子的原子的数量关系。
23.通过加入适量的化学药品,采用恰当的分离提纯方法,除去某溶液里溶解的杂质,下列做法中不正确的是(括号内的物质为杂质)
A
KCl溶液(CaCl2)
加K2CO3溶液,过滤,再加适量盐酸
B
NaNO3溶液(AgNO3)
加适量NaCl溶液,过滤
C
NaCl溶液(I2)
加酒精,分液
D
KBr溶液(Br2)
加CCl4,分液
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A. KCl溶液中含有杂质CaCl2,向其中加入少过量的K2CO3溶液,发生反应:CaCl2+K2CO3=CaCO3↓+2KCl,过滤,把CaCO3过滤除去,再加适量盐酸,与溶液中杂质K2CO3发生反应:2HCl+ K2CO3=2KCl+H2O+CO2↑,就得到纯净的KCl溶液,正确;
B. NaNO3溶液中含有杂质AgNO3,向其中加入适量NaCl溶液,发生反应:NaCl+ AgNO3=AgCl↓+NaNO3,过滤除去AgCl沉淀,就得到纯净的NaNO3溶液,正确;
C. NaCl溶液混有杂质I2,若加入酒精,由于酒精与水混溶,不分层,因此不能通过分液的方法分离得到,错误;
D. KBr溶液中含有杂质Br2,可以利用溴单质容易溶于有机物CCl4,而CCl4与水互不相溶,然后分液就除去了其中含有的杂质溴单质,正确。
答案选C。
【点睛】混合物分类提纯,由于被提纯的物质及含有的杂质的性质不同,使用的除杂试剂及分离方法也不相同。为了使杂质除去,使用的除杂试剂要过量,过量的除杂试剂要容易变为气体或沉淀除去,当物质中含有的杂质有多种时,加入每种除杂试剂要采用一定的顺序,使操作步骤简单易行,最后得到的纯净的物质。掌握除杂原则是“不增、不减”。即不增加新的杂质,不减少被提纯的物质本身。通常采用的分量混合物的方法有过滤、蒸馏、分馏、分液、萃取、升华、盐析、渗析等方法。要结合具体物质采用适当的方法,达到分离、净化物质的目的。
24.由K2SO4、Al2(SO4)?3、KAl(SO4)?2·12H2O及H2SO4组成的混合溶液测得c(H+)?=0.1mol·L-1,c(Al 3+)="0.2" mol·L-1,c(SO42-)?="0.5" mol·L-1,则c(K+)为( )
A. 0.2 mol·L-1 B. 0.3 mol·L-1 C. 0.4 mol·L-1 D. 0.5
mol·L-1
【答案】B
【解析】
溶液不显电性,所以根据电荷守恒可以得到,所以,答案选B。
25.某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是
①该氯原子的相对原子质量为12a/b
②该氯原子的摩尔质量是aNA g
③m g该氯原子的物质的量为m/(aNA)mol
④a g该氯原子所含的电子数为17 mol
A. ①③ B. ②④ C. ①② D. ②③
【答案】A
【解析】
【详解】①某一原子的相对原子质量是指:以一个碳-12原子质量的1/12作为标准,该原子的质量跟一个碳-12原子质量的1/12的比值。故该氯原子的相对原子质量为,①正确;
②一个该氯原子的质量是a,则1mol该氯原子的质量为aNA g,因此摩尔质量为aNA g/mol,②错误;
③根据公式n=m/M可知,m g该氯原子的物质的量为m/(aNA)mol,③正确;
④一个该氯原子的质量是ag,a g该氯原子个数是1,1个氯原子所含的电子数是17个,④错误。
答案选A。
【点睛】本题考查了相对原子质量、物质的量、摩尔质量等概念,该题概念辨析要求高,平时学习是需理解这些概念与相关概念的区别和联系。
26.无机化合物可根据其组成和性质进行分类,如下所示:
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别
酸
碱
盐
氧化物
氢化物
化学式
①HCl
②______
③______
④Ba(OH)2
⑤Na2CO3
⑥______
⑦CO2
⑧Na2O
⑨NH3
⑩H2O2
(3)写出实验室由⑩制备O2的化学方程式___________________________________。
【答案】 (1). 树状分类法 (2). H2SO4(或HNO3或H2CO3等均可) (3). NaOH(或KOH) (4). Na2SO4(或K2CO3或Na2SO3或NaNO3等) (5). 2H2O22H2O+O2↑
【解析】
【详解】(1)常见的分类法有两种:交叉法和树状分类法,由图可知为树状分类法;
答案为:树状分类法;
(2)常见的酸有H2SO4、HNO3、HCl等,碱有KOH、NaOH、Ba(OH)2、Ca(OH)2等,盐有NaCl、Na2SO4、Na2CO3、NaNO3、Na2SO3等;
答案为:H2SO4(或HNO3或H2CO3等均可);NaOH(或KOH);Na2SO4(或K2CO3或Na2SO3或NaNO3等)
(3)双氧水在二氧化锰的催化作用下制取氧气,反应的化学方程式为2H2O22H2O+O2↑;
答案为:2H2O22H2O+O2↑
【点睛】根据常见的分类法有两种:交叉法和树状分类法分析;根据酸是在溶液中电离出的阳离子全部是氢离子的化合物,碱是在水溶液中电离出的阴离子全部是氢氧根离子的化合物,盐是指一类由金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物;
27.要分离下列四组混合物
①饱和食盐水与沙子 ②从KNO3和NaCl的混合溶液中获得KNO3
③水和汽油的混合物 ④CCl4液体与甲苯液体的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6 ℃)
(1)分离①、②的操作分别为________、________。
(2)分离③时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是________。
(3)上述四组分离时需使用酒精灯的有________和________(填序号)。
(4)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
①第Ⅰ步操作的名称是____________。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是__________________________________________。
【答案】 (1). 过滤 (2). 结晶 (3). 分液漏斗 (4). ② (5). ④ (6). 溶解 (7). 有影响 (8). 漏斗、玻璃棒、烧杯
【解析】
【详解】①沙子难溶于水、NaCl易溶于水,所以分离沙子和食盐采用过滤方法分离;
②硝酸钾和NaCl溶解度相差较大,可以采用冷却结晶的方法分离;
③水和汽油是不互溶的混合物 ,可以采用分液的方法分离;
④四氯化碳和甲苯互溶且熔沸点相差较大,可以采用蒸馏的方法分离,
(1)分离①、②的操作分别为过滤、结晶。
答案:过滤、结晶
(2)分液使使用的玻璃仪器有分液漏斗、烧杯,分离③时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是分液漏斗。
答案为:分液漏斗;
(3)需要加热的分离提纯操作需要酒精灯,需要加热的有②④,所以需要酒精灯的有②④。
答案为:②; ④;
(4)由流程可知,固体溶解后,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,以此解答该题。
①第Ⅰ步操作为固体的溶解,
故答案为:溶解;
②碳酸钠一定放在氯化钡的后面价,否则溶液中过量的钡离子无法除去,
故答案为:有影响;
③第Ⅴ步操作为过滤,过滤装置是分离难溶性物质和溶液的分离方法,用到的玻璃仪器为:烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
【点睛】难溶性固体和溶液采用过滤方法分离;溶解度相差较大的固体,采用冷却结晶的方法分离提纯;互不相溶的液体采用分液方法分离;互溶且熔沸点相差较大的液体采用蒸馏的方法分离;
28.(1)2 mol O3和3 mol O2的质量之比为________,分子数之比为________,同温同压下的密度之比为________,含氧原子数之比为________,体积之比为________。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量之比是______,混合气体的平均相对分子质量是_______,对氢气的相对密度是________。
【答案】 (1). 1∶1 (2). 2∶3 (3). 3∶2 (4). 1∶1 (5). 2∶3 (6). 1∶3 (7). 40 (8). 20
【解析】
【详解】(1)臭氧的摩尔质量为48g/mol,氧气的摩尔质量为32g/mol,根据m=nM知,其质量之比=(48g/mol×2):(32g/mol×3)=1:1,根据N=nNA知,其分子数之比等于其物质的量之比=2mol:3mol=2:3,相同条件下,气体摩尔体积相等,根据ρ=知,其密度之比等于其摩尔质量之比=48g/mol:32g/mol=3:2;一个臭氧分子中含有3个氧原子,一个氧气分子中含有2个氧原子,其分子数之比为2:3,结合每个分子中含有的氧原子个数知,其原子个数之比为1:1;在相同条件下,物质的量之比等于体积之比,体积之比为2:3
故答案为:1:1;2:3;3:2;1:1;2:3;
(2):设CO为xmol,CO2为ymol,则x+y=,28x+44y=12;
解得:x=0.075,y=0.225,
此混合物中CO和CO2的物质的量比是0.075:0.225=1:3,==40g/mol,摩尔质量与其相对分子质量在数值上相等,所以其相对分子质量为40,相同条件下气体的密度之比等于其摩尔质量之比,所以该混合气体的密度相对氢气的密度是20,
故答案为:1:3;40;20;
29.有下列化学实验用品:①托盘天平 ②玻璃棒 ③药匙 ④烧杯 ⑤量筒 ⑥容量瓶 ⑦胶头滴管 ⑧细口试剂瓶 ⑨标签纸
(1)现需要配制500 mL 1 mol·L-1 H2SO4溶液,需要质量分数为98%、密度为1.84 g·cm-3的浓H2SO4________mL;
(2)从上述仪器中,按实验要求使用的先后顺序,其编号排列是________________;
(3)容量瓶使用前检查是否漏水的方法是________________________________;
(4)若实验过程遇到下列情况,对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①用来稀释浓硫酸的烧杯未洗涤,________;
②未经冷却将溶液注入容量瓶中,________;
③摇匀后发现液面下降再加水,________;
④定容时俯视观察液面,________。
【答案】 (1). 27.2 (2). ⑤④②⑥⑦⑧⑨ (3). 往容量瓶内加适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,把瓶塞旋转180°后塞紧,再把瓶倒立过来,若不漏水,才能使用 (4). 偏低 (5). 偏高 (6). 偏低 (7). 偏高
【解析】
解题探究:本题主要考查了物质的量浓度、溶液的配制及误差分析。本题难点在于误差分析,理解引起误差的原因是解题的关键。
(1)V(浓H2SO4)×184g/mL×98%="0.500L×1" mol/L×98g/mol
(2)配制顺序是:计算→量取→稀释→移液→定容