- 180.50 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化 学 试 题
可能用到的相对原子质量:H:1 He:4 C:12 N14 O:16 Na:23 Mg24
Al:27 Si:28 P:31 S:32 Cl:35.5 K:39 Ca:40 Fe:56 Cu:64
一、单选题(每题3分,共16小题,共48分)
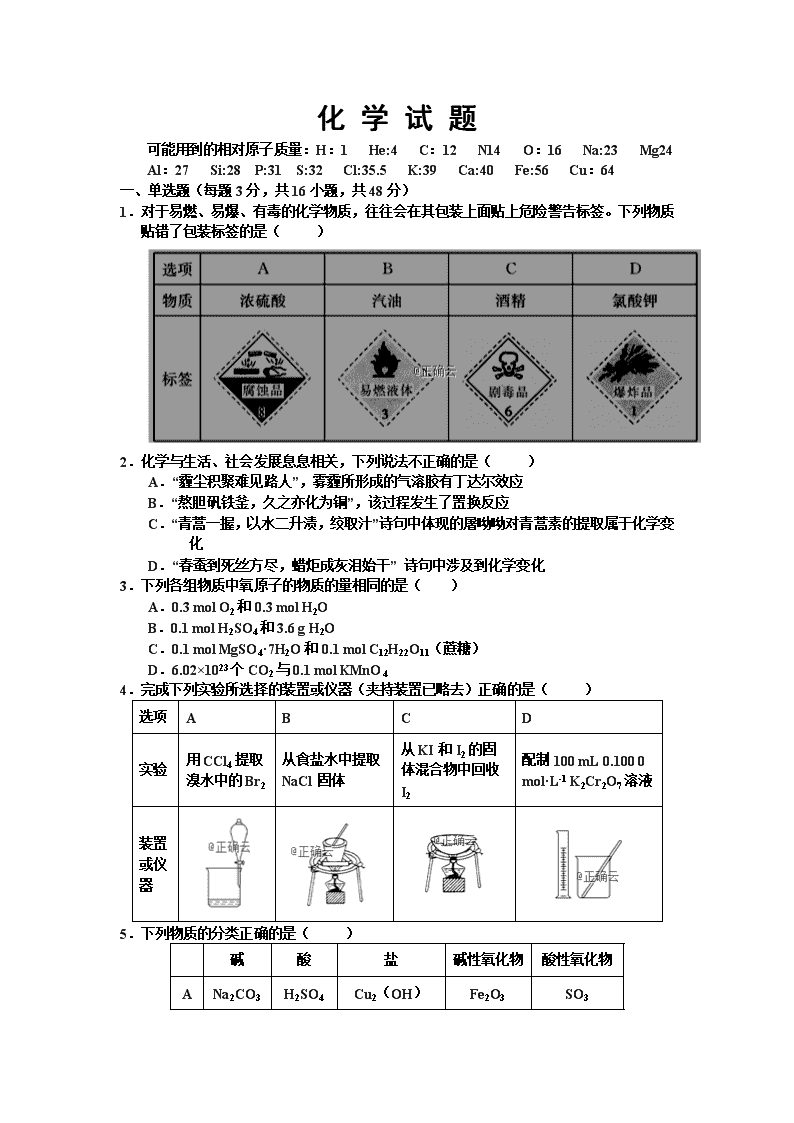
1.对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下列物质贴错了包装标签的是( )
2.化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“青蒿一握,以水二升渍,绞取汁”诗句中体现的屠呦呦对青蒿素的提取属于化学变化
D.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及到化学变化
3.下列各组物质中氧原子的物质的量相同的是( )
A.0.3 mol O2和0.3 mol H2O
B.0.1 mol H2SO4和3.6 g H2O
C.0.1 mol MgSO4·7H2O和0.1 mol C12H22O11(蔗糖)
D.6.02×1023个CO2与0.1 mol KMnO4
4.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
选项
A
B
C
D
实验
用CCl4提取溴水中的Br2
从食盐水中提取NaCl固体
从KI和I2的固体混合物中回收I2
配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液
装置或仪器
5.下列物质的分类正确的是( )
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
Cu2(OH)
Fe2O3
SO3
2CO3
B
NaOH
HCl
NaCl
Na2O
NO2
C
NaOH
NaHSO4
CaF2
MgO
SO2
D
KOH
HNO3
NaHCO3
CaO
Mn2O7
6.下列说法正确的个数有( )
①盐卤点豆腐、江河入海口处“三角洲”的形成、高压电除烟尘均与胶体的性质有关
②通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
③氢氧化铁胶体能稳定存在的主要原因是胶体粒子做布朗运动
④做氢氧化铁胶体电泳实验时,阴极周围红褐色加深,说明氢氧化铁胶体带正电
⑤向FeCl3溶液中滴加NaOH溶液,可制得Fe(OH)3胶体
⑥1mol FeCl3完全与水反应生成氢氧化铁胶体粒子数约为NA个
⑦淀粉溶液和蛋白质溶液是溶液,不可能是胶体
A. 1个 B. 2个 C. 3个 D. 4个
7.现有下列三种溶液:①45%的乙醇溶液、②汽油和氯化钾溶液、③氯化钠和单质碘的水溶液,分离上述各组混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、分液、萃取
8.用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量摩尔浓度,单位为
mol·kg -1,若5 mol·kg -1的硫酸溶液其密度为1.3 g·mL-1,则它的物质的量浓度为( )
A. 3.85 mol·L-1 B. 4.36 mol·L-1 C. 5.25 mol·L-1 D. 6.50mol·L-1
9.下列说法中,不正确的是( )
A.18 g水中所含电子的物质的量为10 mol
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L
10.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计,隔板可确保不让气体透过),其中能代表等质量氢气与氦气的是( )
A B C D
11.化学是一门以实验为基础的科学,下列说法正确的一组是( )
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
④将烧瓶放在桌上,用力塞紧塞子
⑤进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
⑥向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32-
⑦用坩埚钳夹取加热后的蒸发皿
A. ②③⑥⑦ B. ①③④⑦ C. ①③⑦ D. ①⑤⑥⑦
12.下列各组数据中,前者刚好是后者二倍的是( )
A.2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L 氯化钾溶液中c(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20% NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
13.若NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.16 g氧气和臭氧的混合物中含有的氧原子数为NA
B.标准状况下,22.4 L水中含有的氧原子数为NA
C.0.5 mol·L-1的AlCl3溶液中所含Al3+数目为0.5NA
D.0.1 mol 氦气所含有的原子数为0.2NA
14.在标准状况下,下列四种气体的有关量排列顺序正确的是( )
①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3
a.体积:②>③>①>④ b.密度:②>③>④>①
c.质量:②>①>③>④ d.氢原子个数:①>③>④>②
A.abc B.bcd C.abd D.acd
15. 关于同温、同压下等质量的SO2气体和CO2气体,下列比较正确的是( )
①密度之比为16∶11 ②密度之比为11∶16
③体积之比为16∶11 ④体积之比为11∶16
A.①③ B.①④ C.②③ D.②④
16.下图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试根据图判断M气体可能是( )
A. C3H4 B. CO2 C. CO D. H2S
二、填空题(共52分)
17.(10分)在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图D18所示,回答下列问题:
图D18
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为______mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
18.(10分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图Z12所示。
图Z12
(1)指出提取碘的过程中有关的实验操作名称。①_________。
(2)写出流程图中氧化②的离子反应议程式__________________________________。
(3)提取碘的过程中,可供选择的有机试剂是___________。
A.酒精 B.四氯化碳 C.醋酸 D.水
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的玻璃仪器是________________。
图Z13
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出图Z13实验装置中的错误之处。(每空1分)
①__________________________________________;
②__________________________________________;
③___________________________________________。
19.(8分)如图为一“铁链”图案,图案上由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl35种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:
(1)请将分类依据代号填入相应的括号内(每空各1分):
( )两种物质都是非金属氧化物
( )两种物质都是钠的化合物
( )两种物质中一种是酸性氧化物,一种是碱性氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。(每空各2分)
①物质M的化学式为________。
②证明有红褐色胶体生成的最常用的实验操作是________________________________________________。
20.(12分)(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为____________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g 该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
(3)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O,恰好达到饱和,该溶液的密度为1.21 g/cm3,则该溶液中CuSO4的物质的量浓度约为____________,从中取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是________mL。
21.(12分)某课外兴趣小组需要用 18 mol/L 的浓硫酸配制80mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL, 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。
A.10 mL B.25 mL C.50 mL D.100 mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线1-2cm处, 改用___________向容量瓶中滴加蒸馏水至凹液面和刻度线相切为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(3)下列情况对所配制的稀硫酸浓度有何影响? (填 “偏大”“ 偏小”或“无影响”)
①容量瓶用蒸馏水洗涤后残留有少量的水_________________;
②在转入容量瓶前烧杯中溶液未冷却至室温_________;
③取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___________。
化学答案
第I卷(选择题)
一、单选题(每题3分,共16小题,共48分)
1.C 2.C 3.C 4.A 5.D 6.A 7.D 8.B
9.C 10.A 11.C 12.C 13.A 14. C 5. A 16 C
第II卷(非选择题)
二、填空题(共52分)
17.(每空2分,共10分)
(1) 0.2 9.5
(2)0.1 0.1
(3)0.6
18.(10分)(1)①过滤 ③萃取(各2分)
(2)B(2分)
(3)分液漏斗(1分)
(4)(各1分)①加热未垫石棉网
②温度计的位置不正确
③冷凝管进出水方向不正确
19.(共8分)(1)A C B D(各1分)
(2)(各2分) ① FeCl3
②用激光笔照射,能产生一条光亮的通路
20.(每空2分,12分)
(1)5:4:4 5:2:2
(2)46g/mol 14
(3) 1.5mol/L 30
21.(每空2分,12分)
(1) 16.7 B
(2)胶头滴管
(3)无影响 偏大 偏大