- 1.32 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
PART 2
第二单元
专题六 化学能与热能
高频考点探究
命题考向追踪
教师备用习题
·
·
·
考纲展示
1.
了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.
了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3.
了解热化学方程式的含义,能正确书写热化学方程式。
4.
了解焓变
(Δ
H
)
与反应热的含义。了解
Δ
H
=
H
(
生成物
)
-
H
(
反应物
)
表达式的含义。
5.
理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
6.
了解能源是人类生存和社会发展的重要基础;了解化学在解决能源危机中的重要作用。
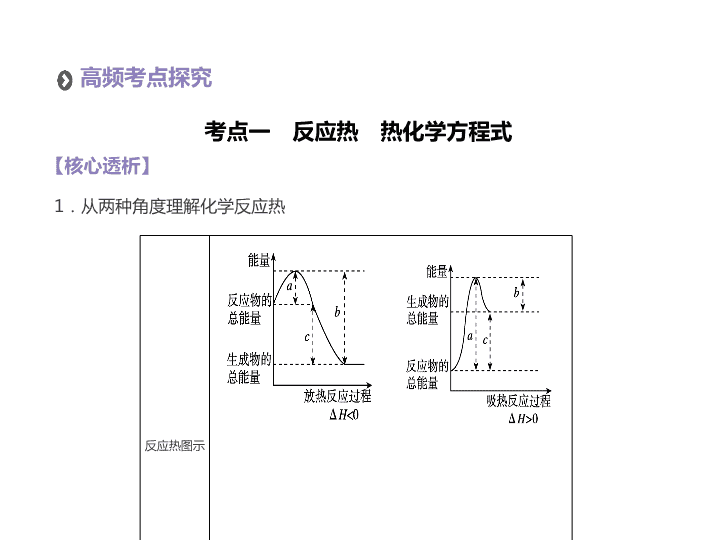
反应热图示
高频考点探究
1
.从两种角度理解化学反应热
【
核心透析
】
考点一 反应热 热化学方程式
2.“
五环节
”
法书写热化学方程式
图像分析
微观
宏观
a
表示断裂旧化学键吸收的热量;
b
表示新化学键生成放出的热量;
c
表示反应热
a
表示反应物的活化能;
b
表示活化分子形成生成物释放的能量;
c
表示反应热
ΔH
的计算
Δ
H
=
∑
E
(
生成物
)-∑
E
(
反应物
)
Δ
H
=
∑
E
(
反应物键能
)-∑
E
(
生成物键能
)
[
提醒
]
对于具有同素异形体的物质,除了要注明聚集状态之外,还要注明物质的名称。
3
.燃烧热和中和热应用中的注意事项
(1)
均为放热反应,Δ
H
<
0
,单位为
kJ·mol
-
1
。
(2)
燃烧热概念理解的三要点:
①
外界条件是
25 ℃
、
101
kPa
;
②
反应的可燃物是
1 mol
;
③
生成物是稳定的氧化物
(
包括状态
)
,如碳元素生成的是
CO
2
,而不是
CO
,氢元素生成的是液态水,而不是水蒸气。
(3)
中和热概念理解三要点:
①
反应物的酸碱是强酸、强碱;
②
溶液是稀溶液,不存在稀释过程的热效应;
③
生成产物水是
1 mol
。
A
.由
X→Y
反应的
Δ
H
=
E
5
-
E
2
B
.由
X→Z
反应的
Δ
H
<0
C
.降低压强有利于提高
Y
的产率
D
.升高温度有利于提高
Z
的产率
(2)[2017·
北京卷
] TiO
2
与
Cl
2
难以直接反应,加碳生成
CO
和
CO
2
可使反应得以进行。
已知:
TiO
2
(s)
+
2Cl
2
(g)=TiCl
4
(g)
+
O
2
(g)
Δ
H
1
=+
175.4 kJ
·
mol
-
1
2C(s)
+
O
2
(g)=2CO(g)
Δ
H
2
=-
220.9
kJ·mol
-
1
①沸腾炉中加碳氯化生成
TiCl
4
(g)
和
CO(g)
的热化学方程式:
___________________
。
【
典例探究
】
例
1
(1)[2016·
海南卷
] (
双选
)
由反应物
X
转化为
Y
和
Z
的能量变化如图
61
所示。下列说法正确的是
(
)
图
61
②氯化过程中
CO
和
CO
2
可以相互转化,根据图
62
判断:
CO
2
生成
CO
反应的
Δ
H
______________(
填
“
>
”“
<
”
或
“
=
”)0
,判断依据:
________________________________
。
(3)[2016·
天津卷
]
硅和氯两元素的单质反应生成
1 mol Si
的最高价化合物,恢复至室温,放热
687 kJ
,已知该化合物的熔、沸点分别为-
69 ℃
和
58 ℃
,写出该反应的热化学方程式:
__________________
。
图
62
【
答案
】
(1)BC (2)①TiO
2
(s)
+
2Cl
2
(g)
+
2C(s)=TiCl
4
(g)
+
2CO(g)
Δ
H
=-
45.5
kJ·mol
-
1
②
>
随温度升高,
CO
含量增大,说明生成
CO
的反应是吸热反应
(3)Si(s)
+
2Cl
2
(g)=SiCl
4
(l)
Δ
H
=-
687
kJ·mol
-
1
【
解析
】
(1)
由题给图示可知,
X
→
Y
的
Δ
H
=生成物的总能量-反应物的总能量 =
E
3
-
E
2
,
A
项错误;
2X(g)
的能量高于
Z(g)
的能量,故
X→Z
是放热反应,Δ
H
<0
,
B
项正确;根据反应
2X(g)
⇌
3Y(g)
,可知压强减小,平衡正向移动,
Y
的产率提高,
C
项正确;根据反应
2X(g)
⇌
Z(g)
Δ
H
<0
,温度升高,平衡逆向移动,
Z
的产率降低,
D
项错误。
(2)①
沸腾炉中的反应为
TiO
2
(s)
+
2C(s)
+
2Cl
2
(g)=TiCl
4
(g)
+
2CO(g)
,根据盖斯定律,两式相加可得。
②
分析图像可知,升高温度,
CO
的物质的量增多,
CO
2
的物质的量减少,所以该反应为吸热反应。
(3)
单质
Si
和
Cl
2
发生化合反应生成
Si
的最高价化合物即
SiCl
4
,根据熔沸点可判断常温下
SiCl
4
为液体,根据题意可写出热化学方程式为
Si(s)
+
2Cl
2
(g)=SiCl
4
(l)
Δ
H
=-
687 kJ/mol
。
变式
甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)
+
2H
2
(g) ⇌CH
3
OH(g)
。已知:
①
常压下反应的能量变化如图
63
所示。
②
化学键
H—H
H—O
O=O
键能
kJ/mol
436
x
496
图
63
③
CO(g)
+
1/2O
2
(g)=CO
2
(g)
Δ
H
=-
280 kJ/mol
H
2
(g)
+
1/2O
2
(g)=H
2
O(l)
Δ
H
=-
284 kJ/mol
H
2
O(l)=H
2
O(g)
Δ
H
=+
44 kJ/mol
请回答下列问题:
(1)
请写出表示气态甲醇燃烧热的热化学方程式:
______________
。
(2)H—O
键的键能
x
为
________kJ/mol
。
(3)
甲醇气体分解为
CO
和
H
2
两种气体的反应的活化能为
________kJ/mol
。
(4)
在
________(
填
“
高温
”
或
“
低温
”)
情况下有利于
CO
和
H
2
制备甲醇的反应自发进行。
(5)
标准摩尔生成焓是指在
25 ℃
和
101
kPa
,最稳定的单质生成
1 mol
化合物的焓变。已知
25 ℃
和
101
kPa
时下列反应:
①
2C
2
H
6
(g)
+
7O
2
(g)=4CO
2
(g)
+
6H
2
O(l)
Δ
H
=-
3116
kJ·mol
-
1
②
C(
石墨,
s)
+
O
2
(g)=CO
2
(g)
Δ
H
=-
393.5
kJ·mol
-
1
③
2H
2
(g)
+
O
2
(g)=2H
2
O(l)
Δ
H
=-
571.6
kJ·mol
-
1
写出乙烷标准生成焓的热化学方程式:
______________
。
【
答案
】
(1)CH
3
OH(g)
+
3/2O
2
(g)=CO
2
(g)
+
2H
2
O(l)
Δ
H
=-
757
kJ·mol
-
1
(2)462
(3)510
(4)
低温
(5)2C(
石墨,
s)
+
3H
2
(g)=C
2
H
6
(g)
Δ
H
=-
86.4 kJ/mol
【
解析
】
(1)
燃烧热的热化学方程式中,可燃物为
1 mol
,反应生成稳定的氧化物。由图
63
可得热化学方程式:
①CO(g)
+
2H
2
(g)=CH
3
OH(g)
Δ
H
=-
91 kJ/mol
,又已知:
②CO(g)
+
1/2O
2
(g)=CO
2
(g)
Δ
H
=-
280 kJ/mol
,③
H
2
(g)
+
1/2O
2
(g)=H
2
O(l)
Δ
H
=-
284 kJ/mol
,根据盖斯定律,③×
2
+
②
-
①
可得:
CH
3
OH(g)
+
3/2O
2
(g)=CO
2
(g)
+
2H
2
O(l)
Δ
H
=-
757 kJ
·
mol
-
1
。
(2)
已知:
H
2
(g)
+
1/2O
2
(g)=H
2
O(l)
Δ
H
=-
284 kJ/mol
,
H
2
O(l)===H
2
O(g)
Δ
H
=+
44 kJ/mol
,二者相加可得:
H
2
(g)
+
1/2O
2
(g)=H
2
O(g)
Δ
H
=-
240 kJ/mol
,反应热=反应物总键能-生成物总键能,则
436 kJ/mol
+
1/2
×
496 kJ/mol
-
2×
x
kJ/mol
=-
240 kJ/mol
,解得
x
=
462
。
(3)
根据图像,甲醇气体分解为
CO
和
H
2
两种气体的反应的活化能=
91 kJ/mol
+
419 kJ/mol
=
510 kJ/mol
。
(4)CO(g)
+
2H
2
(g)=CH
3
OH(g)
Δ
H
=-
91 kJ/mol
的
Δ
H
<
0
、
Δ
S
<
0
,Δ
H
-
T
Δ
S
<
0
反应自发进行,故在低温下反应具有自发性。
特别提醒
利用键能计算反应热,需算清物质中化学键的数目。常见物质中所含共价键的数目:
1 mol C(
金刚石
)
中含有
2 mol C—C
键,
1 mol
硅中含有
2 mol Si—Si
键,
1 mol SiO
2
晶体中含有
4 mol Si—O
键;
1 mol P
4
中含有
6 mol P—P
键,
1 mol P
4
O
10
(
即五氧化二磷
)
中含有
12 mol P—O
键、
4 mol P=O
键,
1 mol CH
3
CH
3
中含有
6 mol C—H
键和
1 mol C—C
键。
热化学方程式
焓变之间的关系
a
A
(g)=B(g)
Δ
H
1
A(g)= 1/
a
B(g)
Δ
H
2
Δ
H
2
=
1/
a
Δ
H
1
或
Δ
H
1
=
a
Δ
H
2
a
A
(g)=B(g)
Δ
H
1
B(g)=
a
A
(g)
Δ
H
2
Δ
H
1
=-
Δ
H
2
Δ
H
=
Δ
H
1
+
Δ
H
2
【
核心透析
】
考点二 盖斯定律的应用
根据盖斯定律计算焓变
常用关系式
考查角度一
反应热的计算
例
2
(1)[2017·
全国卷Ⅰ
]
图
64
是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统
(
Ⅰ
)
和系统
(
Ⅱ
)
制氢的热化学方程式分别为
________
、
________
,制得等量
H
2
所需能量较少的是
________
。
【
典例探究
】
(2)[2017·
全国卷Ⅲ
]
已知:
As(s)
+
3/2H
2
(g)
+
2O
2
(g)=H
3
AsO
4
(s)
Δ
H
1
H
2
(g)
+
1/2O
2
(g)=H
2
O(l)
Δ
H
2
2As(s)
+
5/2O
2
(g)=As
2
O
5
(s)
Δ
H
3
则反应
As
2
O
5
(s)
+
3H
2
O(l)=2H
3
AsO
4
(s)
的
Δ
H
=
________
。
图
64
【
答案
】
(1)H
2
O(l)=H
2
(g)
+
1/2O
2
(g)
Δ
H
=
286
kJ·mol
-
1
H
2
S(g)=H
2
(g)
+
S(s)
Δ
H
=
20
kJ·mol
-
1
系统
(Ⅱ) (2)2Δ
H
1
-
3Δ
H
2
-
Δ
H
3
【
解析
】
(1)
系统
(Ⅰ)
中最终是水分解制取氢气,系统
(
Ⅱ
)
最终是
H
2
S
分解为硫和氢气。利用盖斯定律,依据反应
①H
2
SO
4
(
aq
)=SO
2
(g)
+
H
2
O(l)
+
1/2O
2
(g)
Δ
H
1
=
327
kJ·mol
-
1
、②
SO
2
(g)
+
I
2
(s)
+
2H
2
O(l)=2HI(
aq
)
+
H
2
SO
4
(
aq
)
Δ
H
2
=-
151 kJ
·
mol
-
1
和
③2HI(
aq
)=H
2
(g)
+
I
2
(s)
Δ
H
3
=
110
kJ·mol
-
1
,④
H
2
S(g)
+
H
2
SO
4
(
aq
)=S(s)
+
SO
2
(g)
+
2H
2
O(l)
Δ
H
4
=
61
kJ·mol
-
1
,将上述反应进行如下变形:
①
+
②
+
③
,整理可得系统
(Ⅰ)
的热化学方程式为
H
2
O(l) =H
2
(g)
+
1/2O
2
(g)
Δ
H
=
286
kJ·mol
-
1
;
②
+
③
+
④
,整理可得系统
(Ⅱ)
的热化学方程式为
H
2
S(g)=H
2
(g)
+
S(s)
Δ
H
=
20
kJ·mol
-
1
。由此可知每反应产生
1 mol H
2
,后者吸收的热量比前者少,所以制取等量的
H
2
所需能量较少的是系统
(Ⅱ)
。
(2)
依次设题中的热化学方程式为
①②③
,由盖斯定律可知,①×
2
-
②×3
-
③
可得反应
As
2
O
5
(s)
+
3H
2
O(l)=2H
3
AsO
4
(s)
,则该反应的
Δ
H
=
2Δ
H
1
-
3Δ
H
2
-
Δ
H
3
。
变式
(1)
已知:
2NO(g)
+
O
2
(g)===2NO
2
(g)
Δ
H
1
=-
113.0
kJ·mol
-
1
2SO
2
(g)
+
O
2
(g) ⇌2SO
3
(g)
Δ
H
2
=-
196.6
kJ·mol
-
1
则
NO
2
(g)
+
SO
2
(g) ⇌SO
3
(g)
+
NO(g)
Δ
H
=
________
。
(2)
以
CO
2
与
NH
3
为原料可合成尿素。已知:
①
2NH
3
(g)
+
CO
2
(g)=NH
2
COONH
4
(s)
Δ
H
=-
159.47
kJ·mol
-
1
②
NH
2
COONH
4
(s)=CO(NH
2
)
2
(s)
+
H
2
O(g)
Δ
H
=+
116.49
kJ·mol
-
1
③
H
2
O(l)=H
2
O(g)
Δ
H
=+
44.0
kJ·mol
-
1
写出
NH
3
和
CO
2
合成尿素和液态水的热化学方程式:
_______________
。
(3)
一定条件下,可以用
CO
处理燃煤烟气生成液态硫,实现硫的回收。
①
2CO(g)
+
O
2
(g)=2CO
2
(g)
Δ
H
=-
566
kJ·mol
-
1
②
S(l)
+
O
2
(g)=SO
2
(g)
Δ
H
=-
296
kJ·mol
-
1
则用
CO
处理燃煤烟气的热化学方程式是
_________________________
。
(4)
已知在常温常压下:
①
2CH
3
OH(l)
+
3O
2
(g)=2CO
2
(g)
+
4H
2
O(g)
Δ
H
=-
1 275.6
kJ·mol
-
1
②
2CO(g)
+
O
2
(g)=2CO
2
(g)
Δ
H
=-
566.0
kJ·mol
-
1
③
H
2
O(g)=H
2
O(l)
Δ
H
=-
44.0
kJ·mol
-
1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
_________________
。
【
答案
】
(1)
-
41.8 kJ/mol (2)2NH
3
(g)
+
CO
2
(g=CO(NH
2
)(s)
+
H
2
O(l)
Δ
H
=-
86.98 kJ/mol (3)2CO(g)
+
SO
2
(g)=2CO
2
(g)
+
S(l)
Δ
H
=-
270
kJ·mol
-
1
(4)CH
3
OH(l)
+
O
2
(g)=CO(g)
+
2H
2
O(l)
Δ
H
=-
442.8
kJ·mol
-
1
【
解析
】
(1)2NO(g)
+
O
2
(g)=2NO
2
(g)
,②
2SO
2
(g)
+
O
2
(g)
⇌
2SO
3
(g)
,
(②
-
①)÷2
得出
Δ
H
=
1/2
×
(
-
196.6
+
113.0)
kJ·mol
-
1
=-
41.8
kJ·mol
-
1
。
(2)
根据盖斯定律,①+
②
-
③
得:
2NH
3
(g)
+
CO
2
(g)=CO(NH
2
)(s)
+
H
2
O(l)
Δ
H
=
(
-
159.47
+
116.49
-
44)
kJ·mol
-
1
=-
86.98
kJ·mol
-
1
。
(3)
反应
①
-反应
②
可得
2CO(g)
+
SO
2
(g)=2CO
2
(g)
+
S(l)
Δ
H
=-
270
kJ·mol
-
1
。
(4)
根据盖斯定律,由
1/2 (①
-
②
+
③×4)
得:
CH
3
OH(l)
+
O
2
(g)=CO(g)
+
2H
2
O(l)
Δ
H
=
1/2 (Δ
H
1
-
Δ
H
2
+
4Δ
H
3
)
=-
442.8
kJ·mol
-
1
。
根据盖斯定律计算反应热计算技巧
解题策略
考查角度一
反应热大小的比较
例
3
室温下,将
1 mol
的
CuSO
4
·
5H
2
O(s)
溶于水会使溶液温度降低,热效应为
Δ
H
1
,将
1 mol
的
CuSO
4
(s)
溶于水会使溶液温度升高,热效应为
Δ
H
2
;
CuSO
4
·
5H
2
O
受热分解的化学方程式为
CuSO
4
·
5H
2
O(s)=CuSO
4
(s)
+
5H
2
O(l)
,热效应为
Δ
H
3
,则下列判断正确的是
(
)
A
.Δ
H
2
>
Δ
H
3
B
.Δ
H
1
<
Δ
H
3
C
.Δ
H
1
+
Δ
H
3
=
Δ
H
2
D
.Δ
H
1
+
Δ
H
2
>
Δ
H
3
【
典例探究
】
【
答案
】B
【
解析
】
依题意
CuSO
4
·
5H
2
O(s)
溶于水发生反应
CuSO
4
·
5H
2
O(s)=Cu
2
+
(
aq
)
+
SO
4
2-
(
aq
)
+
5H
2
O(l)
Δ
H
1
>
0
;
CuSO
4
(s)
溶于水发生反应
CuSO
4
(s)=Cu
2
+
(
aq
)
+
SO
4
2-
(
aq
)
Δ
H
2
<
0
;根据盖斯定律有:
CuSO
4
·
5H
2
O(s)=CuSO
4
(s)
+
5H
2
O(l)
,Δ
H
3
=
Δ
H
1
-
Δ
H
2
>
0
。
Δ
H
2
-
Δ
H
3
=
2Δ
H
2
-
Δ
H
1
<
0
,
A
项错误;
Δ
H
3
-
Δ
H
1
=-
Δ
H
2
>
0
,
B
项正确;
Δ
H
3
=
Δ
H
1
-
Δ
H
2
,
C
项错误;
Δ
H
1
+
Δ
H
2
-
Δ
H
3
=
2Δ
H
2
<
0
,
D
项错误。
变式
已知:
C(s)
+
O
2
(g)=CO
2
(g)
Δ
H
1
CO
2
(g)
+
C(s)=2CO(g)
Δ
H
2
2CO(g)
+
O
2
(g)=2CO
2
(g)
Δ
H
3
4Fe(s)
+
3O
2
(g)=2Fe
2
O
3
(s)
Δ
H
4
3CO(g)
+
Fe
2
O
3
(s)=3CO
2
(g)
+
2Fe(s)
Δ
H
5
下列关于上述反应焓变的判断正确的是
(
)
A
.Δ
H
1
>0
,Δ
H
3
<0 B
.Δ
H
2
>0
,Δ
H
4
>0
C
.Δ
H
1
=
Δ
H
2
+
Δ
H
3
D
.Δ
H
3
=
Δ
H
4
+
Δ
H
5
【
答案
】C
【
解析
】
C
、
CO
的燃烧都是放热反应,故
Δ
H
1
<
0
、
Δ
H
3
<
0
,
A
项错误;
CO
2
与
C
生成
CO
的反应为吸热反应,则
Δ
H
2
>
0
;铁的燃烧为放热反应,则
Δ
H
4
<
0
,
B
项错误;将第二、三个热化学方程式相加可得第一个热化学方程式,
C
项正确;将第五个热化学方程式系数同时乘以
2
后与第四个热化学方程式相加,再将系数同时除以
3
可得第三个热化学方程式,故
Δ
H
3
=
(
Δ
H
4
+
2Δ
H
5
)
÷
3
,
D
项错误。
归纳总结
比较反应热大小的方法
比较反应热的大小时要注意:
Δ
H
有正负之分,比较时要连同
“
+
”“
-
”
一起比较,类似数学中的正、负数大小的比较;若只比较放出或吸收热量的多少,则只比较数值的大小,不考虑正、负号。具体比较方法有如下几种:
(1)
利用盖斯定律比较。
(2)
同一反应的生成物状态不同时,如
A(g)
+
B(g)=C(g)
Δ
H
1
,
A(g)
+
B(g)=C(l)
Δ
H
2
,则
Δ
H
1
>
Δ
H
2
。
(3)
同一反应的反应物状态不同时,如
A(s)
+
B(g)=C(g)
Δ
H
1
,
A(g)
+
B(g)=C(g)
Δ
H
2
,则
Δ
H
1
>
Δ
H
2
。
(4)
两个有联系的反应相比较时,如
C(s)
+
O
2
(g)=CO
2
(g)
Δ
H
1
①,
C(s)
+
1/2O
2
(g)=CO(g)
Δ
H
2
②
。
比较方法:利用反应
①
减去反应
②
,得反应③
CO(g)
+
1/2O
2
(g)=CO
2
(g)
Δ
H
3
=
Δ
H
1
-
Δ
H
2
,根据
Δ
H
3
大于
0
或小于
0
进行比较。
1
.
[2017·
江苏卷
]
通过以下反应可获得新型能源二甲醚
(CH
3
OCH
3
)
。下列说法不正确的是
(
)
①
C(s)
+
H
2
O(g)=CO(g)
+
H
2
(g)
Δ
H
1
=
a
kJ
·
mol
-
1
②
CO(g)
+
H
2
O(g)=CO
2
(g)
+
H
2
(g)
Δ
H
2
=
b
kJ
·
mol
-
1
③
CO
2
(g)
+
3H
2
(g)=CH
3
OH(g)
+
H
2
O(g)
Δ
H
3
=
c
kJ
·
mol
-
1
④
2CH
3
OH(g)=CH
3
OCH
3
(g)
+
H
2
O(g)
Δ
H
4
=
d
kJ
·
mol
-
1
A
.反应
①
、
②
为反应
③
提供原料气
B
.反应
③
也是
CO
2
资源化利用的方法之一
C
.反应
CH
3
OH(g)=1/2CH
3
OCH
3
(g)
+
1/2H
2
O(l)
的
Δ
H
=
d
/2 kJ
·
mol
-
1
D
.反应
2CO(g)
+
4H
2
(g)=CH
3
OCH
3
(g)
+
H
2
O(g)
的
Δ
H
=
(2
b
+
2
c
+
d
)
kJ·mol
-
1
命题考向追踪
【
历年动态
】
【
答案
】
C
【
解析
】
反应
①
和
②
的最终产物中含有
H
2
和
CO
2
,
A
项正确;
CO
2
与
H
2
化合生成能源物质
CH
3
OH
,
B
项正确;该反应生成的
H
2
O
为液态,液态水汽化需要吸热,则
Δ
H
<
d
/2kJ
·
mol
-
1
,
C
项错误;根据盖斯定律,反应
②×2
+反应
③×2
+反应
④
可得该热化学方程式,
D
项正确。
【
答案
】
D
【
解析
】
反应
①
是光能转化为化学能,
A
项错误;反应
②
的焓变为正值,属于吸热反应,
B
项错误;催化剂只能降低反应的活化能,但不会改变反应的焓变,
C
项错误;根据盖斯定律可知,“反应
③
-反应
②”
得所求的反应,则焓变
Δ
H
=+
206.1
kJ·mol
-
1
-
131.3
kJ·mol
-
1
=+
74.8
kJ·mol
-
1
,
D
项正确。
2
.
[2016·
江苏卷
]
通过以下反应均可获取
H
2
。下列有关说法正确的是
(
)
①太阳光催化分解水制氢:
2H
2
O(l)=2H
2
(g)
+
O
2
(g)
Δ
H
1
=+
571.6
kJ·mol
-
1
②焦炭与水反应制氢:
C(s)
+
H
2
O(g)=CO(g)
+
H
2
(g)
Δ
H
2
=+
131.3
kJ·mol
-
1
③甲烷与水反应制氢:
CH
4
(g)
+
H
2
O(g)=CO(g)
+
3H
2
(g)
Δ
H
3
=+
206.1
kJ·mol
-
1
A
.反应
①
中电能转化为化学能
B
.反应
②
为放热反应
C
.反应
③
使用催化剂,Δ
H
3
减小
D
.反应
CH
4
(g)=C(s)
+
2H
2
(g)
的
Δ
H
=+
74.8
kJ·mol
-
1
3
.
(1)[2017·
海南卷
]
碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
已知:
①2NaOH(s)
+
CO
2
(g)=Na
2
CO
3
(s)
+
H
2
O(g)
Δ
H
1
=-
127.4
kJ·mol
-
1
②
NaOH
(s)
+
CO
2
(g)=NaHCO
3
(s)
Δ
H
2
=-
131.5
kJ·mol
-
1
反应
2NaHCO
3
(s)=Na
2
CO
3
(s)
+
H
2
O(g)
+
CO
2
(g)
的
Δ
H
=
________
kJ·mol
-
1
,该反应的平衡常数表达式
K
=
________
。
(2)[2016·
全国卷Ⅱ
] ①2O
2
(g)
+
N
2
(g)=N
2
O
4
(l)
Δ
H
1
②
N
2
(g)
+
2H
2
(g)=N
2
H
4
(l)
Δ
H
2
③
O
2
(g)
+
2H
2
(g)=2H
2
O(g)
Δ
H
3
④
2N
2
H
4
(l)
+
N
2
O
4
(l)=3N
2
(g)
+
4H
2
O(g)
Δ
H
4
=-
1 048.9 kJ
·
mol
-
1
上述反应热效应之间的关系式为
Δ
H
4
=
____________
。
(3)[2016·
全国卷Ⅲ
]
已知下列反应:
SO
2
(g)
+
2OH
-
(
aq
)=SO
3
2-
(
aq
)
+
H
2
O(l)
Δ
H
1
ClO
-
(
aq
)
+
SO
3
2-
(
aq
)=SO
4
2-
(
aq
)
+
Cl
-
(
aq
)
Δ
H
2
CaSO
4
(s)=Ca
2
+
(
aq
)
+
SO
4
2-
(
aq
)
Δ
H
3
则反应
SO
2
(g)
+
Ca
2
+
(
aq
)
+
ClO
-
(
aq
)
+
2OH
-
(
aq
)=CaSO
4
(s)
+
H
2
O(l)
+
Cl
-
(
aq
)
的
Δ
H
=
_________
。
(4)[2015·
浙江卷
]
乙苯催化脱氢制苯乙烯的反应为
+
H
2
(g)
。
已知:
计算上述反应的
Δ
H
=
________
kJ·mol
-
1
。
化学键
C—H
C—C
C=C
H—H
键能
/(
kJ·mol
-
1
)
412
348
612
436
(5)[2016·
四川卷
]
工业上常用磷精矿
[Ca
5
(PO
4
)
3
F]
和硫酸反应制备磷酸。已知
25 ℃
,
101
kPa
时:
CaO
(s)
+
H
2
SO
4
(l)=CaSO
4
(s)
+
H
2
O(l)
Δ
H
=-
271 kJ/mol
5CaO(s)
+
3H
3
PO
4
(l)
+
HF(g)=Ca
5
(PO
4
)
3
F(s)
+
5H
2
O(l)
Δ
H
=-
937 kJ/mol
则
Ca
5
(PO
4
)
3
F
和硫酸反应生成磷酸的热化学方程式是
____________________
。
【
答案
】
(1)
+
135.6
c
(CO
2
)·
c
(H
2
O) (2)2Δ
H
3
-
2Δ
H
2
-
Δ
H
1
(3)Δ
H
1
+
Δ
H
2
-
Δ
H
3
(4)
+
124 (5)Ca
5
(PO
4
)
3
F(s)
+
5H
2
SO
4
(l)=5CaSO
4
(s)
+
3H
3
PO
4
(l)
+
HF(g)
Δ
H
=-
418 kJ/mol
【
解析
】
(1)
根据盖斯定律,
NaHCO
3
(s)
分解反应可由:
①
-
②×2
得,故
Δ
H
=
Δ
H
1
-
2Δ
H
2
=-
127.4
kJ·mol
-
1
-
(
-
131.5
kJ·mol
-
1
)×2
=+
135.6
kJ·mol
-
1
。固体不能写入平衡常数表达式,该反应的平衡常数表达式为
c
(CO
2
)·
c
(H
2
O)
。
(2)
观察可知,四个热化学方程式关系式为
③×2
-
②×2
-
①
=
④
,由盖斯定律可知
2Δ
H
3
-
2Δ
H
2
-
Δ
H
1
=
Δ
H
4
。
(3)
根据盖斯定律,由第一个反应+第二个反应-第三个反应,可得
SO
2
(g)
+
Ca
2
+
(
aq
)
+
ClO
-
(
aq
)
+
2OH
-
(
aq
)=CaSO
4
(s)
+
H
2
O(l)
+
Cl
-
(
aq
)
,则
Δ
H
=
Δ
H
1
+
Δ
H
2
-
Δ
H
3
。
(4)
用反应物的总键能减去生成物的总键能等于反应的焓变,反应可看成是苯乙烷中乙基的两个碳氢键断裂,由碳碳单键变成碳碳双键,同时有
H
2
生成,故有
Δ
H
=
412 kJ
·
mol
-
1
×
2
+
348
kJ·mol
-
1
-
612
kJ·mol
-
1
-
436
kJ·mol
-
1
=+
124
kJ·mol
-
1
。
(5)
按顺序给已知热化学方程式编号为
①
、
②
,根据盖斯定律知目标热化学方程式由
①×5
-
②
可得。
4
.
已知热化学方程式:
2H
2
(g)
+
O
2
(g)=2H
2
O(l)
Δ
H
=-
571.6 kJ/mol
2CH
3
OH(l)
+
3O
2
(g)=2CO
2
(g)
+
4H
2
O(l)
Δ
H
=-
1452 kJ/mol
H
+
(
aq
)
+
OH
-
(
aq
)=H
2
O(l)
Δ
H
=-
57.3 kJ/mol
据此判断下列说法正确的是
(
)
A
.
CH
3
OH
的燃烧热为
1452 kJ/mol
B
.
2H
2
(g)
+
O
2
(g)=2H
2
O(g)
Δ
H
>-
571.6 kJ/mol
C
.
2CH
3
OH(l)
+
O
2
(g)=2CO
2
(g)
+
4H
2
(g)
Δ
H
=-
880.4 kJ/mol
D
.
CH
3
COOH(
aq
)
+
NaOH
(
aq
)=H
2
O(l)
+
CH
3
COONa(
aq
)
Δ
H
=-
57.3 kJ/mol
【2018
预测
】
【
答案
】
B
【
解析
】
燃烧热是
1 mol
可燃物完全燃烧生成稳定氧化物放出的热量,
2CH
3
OH(l)
+
3O
2
(g)=2CO
2
(g)
+
4H
2
O(l)
Δ
H
=-
1452 kJ
·
mol
-
1
,反应焓变是
2 mol
甲醇燃烧生成稳定氧化物放出的热量,不是燃烧热,
A
项错误;
2H
2
(g)
+
O
2
(g)=2H
2
O(l)
Δ
H
=-
571.6
kJ·mol
-
1
,液态水变化为气态水需要吸收热量,放热焓变为负值,比较大小,
2H
2
(g)
+
O
2
(g)=2H
2
O(g)
Δ
H
>-
571.6 kJ
·
mol
-
1
,
B
项正确;依据热化学方程式和盖斯定律计算判断,①
2H
2
(g)
+
O
2
(g)=2H
2
O(l)
Δ
H
=-
571.6
kJ·mol
-
1
②
2CH
3
OH(l)
+
3O
2
(g)=2CO
2
(g)
+
4H
2
O(l)
Δ
H
=-
1452 kJ
·
mol
-
1
,依据盖斯定律计算
②
-
①×2
得到
2CH
3
OH(l)
+
O
2
(g)=2CO
2
(g)
+
4H
2
(g)
Δ
H
=-
308.8
kJ·mol
-
1
,
C
项错误;醋酸是弱酸,存在电离平衡,电离过程是吸热过程,焓变为负值,
CH
3
COOH(
aq
)
+
NaOH
(
aq
)=H
2
O(l)
+
CH
3
COONa(
aq
)
Δ
H
>-
57.3
kJ·mol
-
1
,
D
项错误。
5
.
C
和
H
2
在生产、生活、科技中是重要的燃料。
①
2C(s)
+
O
2
(g)=2CO(g)
Δ
H
1
=-
220 kJ/mol
②
下列推断正确的是
(
)
A
.
C(s)
的燃烧热为
110 kJ/mol
B
.
2H
2
(g)
+
O
2
(g)=2H
2
O(g)
Δ
H
1
=+
480 kJ/mol
C
.
C(s)
+
H
2
O(g)=CO(g)
+
H
2
(g)
Δ
H
1
=+
130 kJ/mol
D
.欲分解
2 mol H
2
O(l)
,至少需要提供
4×462 kJ
的热量
【
答案
】
C
【
解析
】
2C(s)
+
O
2
(g)=2CO(g)
Δ
H
1
=-
220 kJ/mol
,
C(s)
+
1/2O
2
(g)=CO(g)
Δ
H
1
=-
110 kJ/mol
,但
C(s)
的燃烧热指产物为稳定的二氧化碳所放出的热量,燃烧热大于
110 kJ/mol
,
A
项错误;水的结构式为
H—O—H
,
2 mol
水分子中含有
4 mol H—O
键,
2H
2
(g)
+
O
2
(g)=2H
2
O(g)
Δ
H
=反应物总键能-生成物总键能=
436 kJ/mol×2
+
496 kJ/mol
-
4×462 kJ/mol
=-
480 kJ/mol
,
B
项错误;
①C(s)
+
1/2O
2
(g)=CO(g)
Δ
H
1
=-
110 kJ/mol
,②
2H
2
(g)
+
O
2
(g)=2H
2
O(g)
Δ
H
=-
480 kJ/mol
,由
①
-
1/2
×②得:
C(s)
+
H
2
O(g)=CO(g)
+
H
2
(g)
Δ
H
1
=
(
-
110 kJ/mol)
-
1/2
×
(
-
480 kJ/mol)
=+
130 kJ/mol
,
C
项正确;
2H
2
(g)
+
O
2
(g)=2H
2
O(g)
Δ
H
=-
480 kJ/mol
,将方程式反应物和生成物颠倒,根据盖斯定律,则反应热变换符号,分解
2 mol H
2
O(l)
,至少需要提供
480 kJ
热量,
D
项错误。
1
.
已知:
Fe
2
O
3
(s)
+
3/2C(s)= 3/2CO
2
(g)
+
2Fe(s)
Δ
H
=+
234.1
kJ·mol
-
1
C(s)
+
O
2
(g)=CO
2
(g)
Δ
H
=-
393.5
kJ·mol
-
1
则
2Fe(s)
+
O
2
(g)=Fe
2
O
3
(s)
的
Δ
H
是
(
)
A
.-
824.4
kJ·mol
-
1
B
.-
627.6
kJ·mol
-
1
C
.-
744.7
kJ·mol
-
1
D
.-
168.4
kJ·mol
-
1
教师备用习题
【
答案
】A
【
解析
】
已知
①Fe
2
O
3
(s)
+
3/2C(s)= 3/2CO
2
(g)
+
2Fe(s)
Δ
H
=+
234.1
kJ·mol
-
1
。
②C(s)
+
O
2
(g)
=
CO
2
(g)
Δ
H
=-
393.5
kJ·mol
-
1
。据盖斯定律,②×
3/2
-
①
得:
2Fe(s)
+
O
2
(g)=Fe
2
O
3
(s)
Δ
H
=-
824.4 kJ/mol
。
2
.
[2015·
重庆卷
]
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)
+
2KNO
3
(s)
+
3C(s)=K
2
S(s)
+
N
2
(g)
+
3CO
2
(g)
Δ
H
=
x
kJ
·
mol
-
1
已知:碳的燃烧热
Δ
H
1
=
a
kJ
·
mol
-
1
S(s)
+
2K(s)=K
2
S(s)
Δ
H
2
=
b
kJ
·
mol
-
1
2K(s)
+
N
2
(g)
+
3O
2
(g)=2KNO
3
(s)
Δ
H
3
=
c
kJ
·
mol
-
1
则
x
为
(
)
A
.
3
a
+
b
-
c
B
.
c
-
3
a
-
b
C
.
a
+
b
-
c
D
.
c
-
a
-
b
【
答案
】
A
【
解析
】
根据题意得:
C(s)
+
O
2
(g)=CO
2
(g)
Δ
H
1
=
a
kJ
·
mol
-
1
①
S(s)
+
2K(s)=K
2
S(s)
Δ
H
2
=
b
kJ
·
mol
-
1
②
2K(s)
+
N
2
(g)
+
3O
2
(g)=2KNO
3
(s)
Δ
H
3
=
c
kJ
·
mol
-
1
③
根据盖斯定律,由
①×3
+
②
-
③
可得
S(s)
+
2KNO
3
(s)
+
3C(s)=K
2
S(s)
+
N
2
(g)
+
3CO
2
(g)
,则
Δ
H
=
x
kJ
·
mol
-
1
=
(3
a
+
b
-
c
)
kJ·mol
-
1
。
3
.
(1)[2015·
江苏卷
]
烟气
(
主要污染物
SO
2
、
NO
x
)
经
O
3
预处理后用
CaSO
3
水悬浮液吸收,可减少烟气中
SO
2
、
NO
x
的含量。
O
3
氧化烟气中
SO
2
、
NO
x
的主要反应的热化学方程式为
NO(g)
+
O
3
(g)=NO
2
(g)
+
O
2
(g)
Δ
H
=-
200.9
kJ·mol
-
1
NO(g)
+
1/2O
2
(g)=NO
2
(g)
Δ
H
=-
58.2
kJ·mol
-
1
SO
2
(g)
+
O
3
(g)=SO
3
(g)
+
O
2
(g)
Δ
H
=-
241.6
kJ·mol
-
1
反应
3NO(g)
+
O
3
(g)=3NO
2
(g)
的
Δ
H
=
__________
kJ·mol
-
1
。
(2)[2015·
山东卷
]
贮氢合金
ThNi
5
可催化由
CO
、
H
2
合成
CH
4
的反应。温度为
T
时,该反应的热化学方程式为
____________________
。
已知温度为
T
时:
CH
4
(g)
+
2H
2
O(g)=CO
2
(g)
+
4H
2
(g)
Δ
H
=+
165
kJ·mol
-
1
CO(g)
+
H
2
O(g)=CO
2
(g)
+
H
2
(g)
Δ
H
=-
41
kJ·mol
-
1
【
答案
】
(1)
-
317.3 (2)CO(g)
+
3H
2
(g)=CH
4
(g)
+
H
2
O(g)
Δ
H
=-
206
kJ·mol
-
1
【
解析
】
(1)
根据盖斯定律,依据
“
第
(1)
式+第
(2)
式
×2”
得所求反应,Δ
H
=-
200.9
kJ·mol
-
1
-
58.2
kJ·mol
-
1
×
2
=-
317.3
kJ·mol
-
1
。
(2)
根据盖斯定律,将下式-上式得
CO(g)
+
3H
2
(g)=CH
4
(g)
+
H
2
O(g)
,则
Δ
H
=-
41 kJ/mol
-
165 kJ/mol
=-
206 kJ/mol
。