- 213.80 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
热点专攻5 化学实验基础
1.(2019全国Ⅱ)下列实验现象与实验操作不相匹配的是( )
选项
实验操作
实验现象
A
向盛有酸性高锰酸钾溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
B
将镁条点燃后迅速伸入集满CO2的集气瓶
集气瓶中产生浓烟并有黑色颗粒产生
C
向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸
有刺激性气味气体产生,溶液变浑浊
D
向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
答案:A
解析:乙烯能被酸性高锰酸钾溶液氧化为CO2,反应后气体逸出,静置后溶液不分层,A项错误;将镁条点燃后迅速伸入集满CO2的集气瓶,镁条在CO2中剧烈燃烧,反应的化学方程式为2Mg+CO22MgO+C,反应产生大量浓烟,集气瓶内壁上有黑色固体生成,B项正确;硫代硫酸钠与盐酸反应的化学方程式为Na2S2O3+2HCl2NaCl+H2O+SO2↑+S↓,SO2有刺激性气味,S不溶于水,使溶液变浑浊,C项正确;FeCl3与过量铁粉反应生成Fe2+,加KSCN后溶液不变色,D项正确。
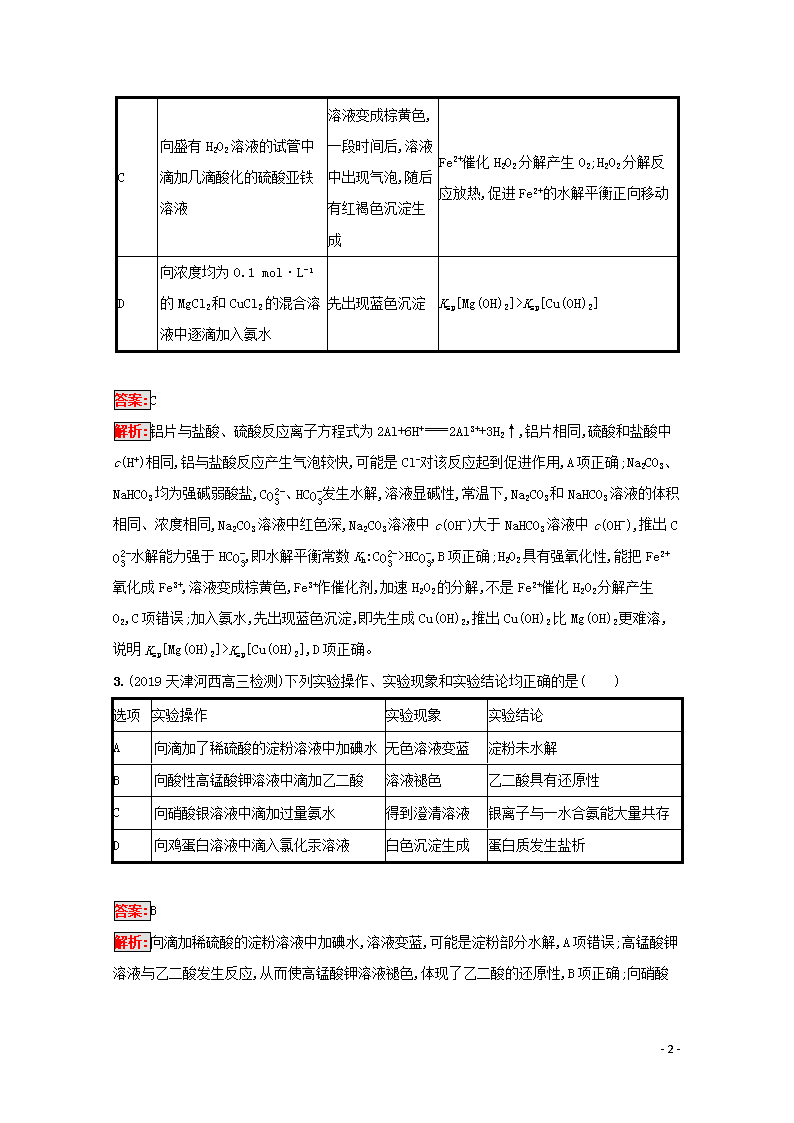
2.(2019天津七校高三期末)根据下列实验操作和现象所得出的结论错误的是( )
选项
操作
现象
结论
A
相同的铝片分别与同温同体积,且c(H+)=1 mol·L-1的盐酸、硫酸反应
铝与盐酸反应产生气泡较快
可能是Cl-对该反应起到促进作用
B
常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液
Na2CO3溶液中红色更深
水解平衡常数Kh:CO32->HCO3-
- 5 -
C
向盛有H2O2溶液的试管中滴加几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后,溶液中出现气泡,随后有红褐色沉淀生成
Fe2+催化H2O2分解产生O2;H2O2分解反应放热,促进Fe2+的水解平衡正向移动
D
向浓度均为0.1 mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水
先出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
答案:C
解析:铝片与盐酸、硫酸反应离子方程式为2Al+6H+2Al3++3H2↑,铝片相同,硫酸和盐酸中c(H+)相同,铝与盐酸反应产生气泡较快,可能是Cl-对该反应起到促进作用,A项正确;Na2CO3、NaHCO3均为强碱弱酸盐,CO32-、HCO3-发生水解,溶液显碱性,常温下,Na2CO3和NaHCO3溶液的体积相同、浓度相同,Na2CO3溶液中红色深,Na2CO3溶液中c(OH-)大于NaHCO3溶液中c(OH-),推出CO32-水解能力强于HCO3-,即水解平衡常数Kh:CO32->HCO3-,B项正确;H2O2具有强氧化性,能把Fe2+氧化成Fe3+,溶液变成棕黄色,Fe3+作催化剂,加速H2O2的分解,不是Fe2+催化H2O2分解产生O2,C项错误;加入氨水,先出现蓝色沉淀,即先生成Cu(OH)2,推出Cu(OH)2比Mg(OH)2更难溶,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2],D项正确。
3.(2019天津河西高三检测)下列实验操作、实验现象和实验结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
向滴加了稀硫酸的淀粉溶液中加碘水
无色溶液变蓝
淀粉未水解
B
向酸性高锰酸钾溶液中滴加乙二酸
溶液褪色
乙二酸具有还原性
C
向硝酸银溶液中滴加过量氨水
得到澄清溶液
银离子与一水合氨能大量共存
D
向鸡蛋白溶液中滴入氯化汞溶液
白色沉淀生成
蛋白质发生盐析
答案:B
解析:向滴加稀硫酸的淀粉溶液中加碘水,溶液变蓝,可能是淀粉部分水解,A项错误;高锰酸钾溶液与乙二酸发生反应,从而使高锰酸钾溶液褪色,体现了乙二酸的还原性,B项正确;向硝酸
- 5 -
银溶液中加入过量的氨水,生成[Ag(NH3)2]OH,C项错误;向鸡蛋白溶液中滴加HgCl2溶液,蛋白质发生变性,D项错误。
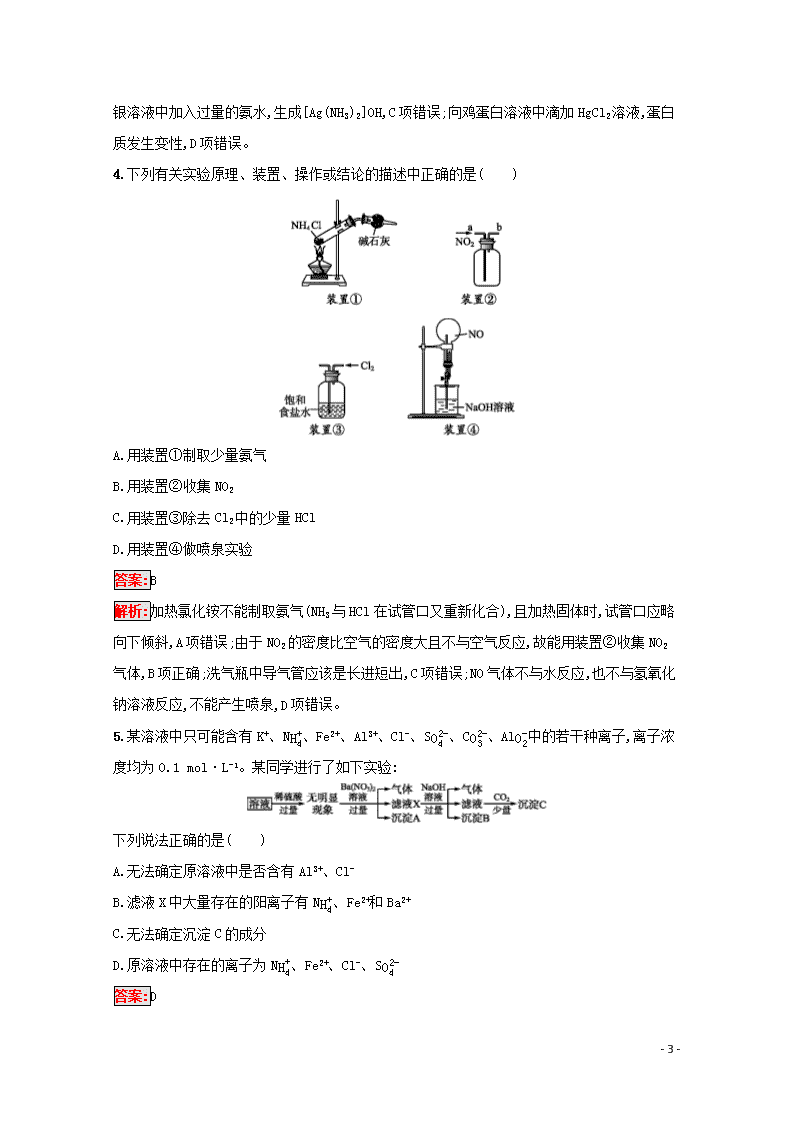
4.下列有关实验原理、装置、操作或结论的描述中正确的是( )
A.用装置①制取少量氨气
B.用装置②收集NO2
C.用装置③除去Cl2中的少量HCl
D.用装置④做喷泉实验
答案:B
解析:加热氯化铵不能制取氨气(NH3与HCl在试管口又重新化合),且加热固体时,试管口应略向下倾斜,A项错误;由于NO2的密度比空气的密度大且不与空气反应,故能用装置②收集NO2气体,B项正确;洗气瓶中导气管应该是长进短出,C项错误;NO气体不与水反应,也不与氢氧化钠溶液反应,不能产生喷泉,D项错误。
5.某溶液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1 mol·L-1。某同学进行了如下实验:
下列说法正确的是( )
A.无法确定原溶液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
答案:D
- 5 -
解析:加入过量稀硫酸无明显现象,说明原溶液中无CO32-、AlO2-;加入Ba(NO3)2溶液有气体产生,说明原溶液中有Fe2+,在酸性环境下被NO3-氧化,滤液X中大量存在的阳离子中无Fe2+,沉淀A为硫酸钡;加入NaOH溶液有气体,说明存在NH4+,气体为氨气,沉淀B为氢氧化铁;通入CO2产生沉淀,可能是BaCO3,也可能是原溶液中含有Al3+,与过量NaOH溶液反应生成AlO2-,通入CO2生成Al(OH)3,又因为存在的离子浓度均为0.1mol·L-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-才能保证电荷守恒。K+、Al3+必然不能存在,沉淀C只能是BaCO3,故选项A、B、C三项均错误,D项正确。
6.根据实验目的判断下列实验操作或装置正确的是( )
答案:D
解析:长颈漏斗应插入液面以下,其目的是防止气体逸出,A项错误;稀释浓硫酸应在烧杯中进行,B项错误;在铁制品上镀铜时,铜片应作阳极而待镀铁制品应作阴极,C项错误。
7.下列实验操作正确且能达到预期目的的是( )
编号
实验目的
操作
①
比较水和乙醇中羟基氢的活泼性强弱
用金属钠分别与水和乙醇反应
②
欲证明CH2CHCHO中含有碳碳双键
滴入酸性KMnO4溶液,看紫红色是否褪去
③
欲除去苯中混有的苯酚
向混合液中加入浓溴水,充分反应后,过滤
④
证明SO2具有漂白性
将SO2通入酸性KMnO4溶液中
⑤
比较铜和镁的金属活动性强弱
用石墨作电极电解等浓度
Mg(NO3)2、Cu(NO3)2的混合液
⑥
确定碳和硅两元素非金属性强弱
测同温同浓度Na2CO3和Na2SiO3水溶液的pH
- 5 -
A.①④⑤ B.②③④ C.①⑤⑥ D.①②③④⑤⑥
答案:C
解析:②中—CHO干扰碳碳双键的检验,错误;③除去苯中的苯酚应用NaOH溶液,错误;④SO2能使酸性KMnO4溶液褪色,是因为其还原性,错误。
- 5 -