- 371.80 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届新课标Ⅱ卷冲刺高考考前预热卷(二)
化学试题卷
考生注意:
1.本卷共100分,考试时间50分钟。
2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
3. 不得在本卷上答题,请将答案填写在答题卡指定区域。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65
一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列关于文献记载的说法正确的是( )。
A.《天工开物》中“世间丝、麻、裘、褐皆具素质”,文中“丝、麻”的主要成分都是蛋白质
B.《肘后备急方》中“青蒿一握,以水二升渍,绞取汁”,该提取过程属于化学变化
C.《抱朴子》中“丹砂(HgS)烧之成水银,积变又还成丹砂”,描述的是升华和凝华过程
D.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承取滴露”,涉及的实验操作是蒸馏
8.有机化合物环丙叉环丙烷,由于其特殊的电子结构一直受到理论化学家的关注,其结构如图所示。下列关于环丙叉环丙烷的说法中错误的是( )。
A.二氯取代物有4种
B.与环丙烷不互为同系物
C.所有的原子均在同一平面内
D.与环己二烯互为同分异构体
9.设阿伏加德罗常数的值为NA。下列说法正确的是( )
A.12 g NaHSO4晶体含阳离子的数目为0.2NA
B.1 L 0.5 mol·L-1Na3PO4溶液中含PO数目为0.5NA
C.标准状况下,1 mol环己烷含非极性键的数目为6NA
D.16.8 g Fe在氧气中完全燃烧时转移的电子数为0.9NA
10.短周期元素X、Y、Z、W在元素周期表中的相对位置关系如图所示。下列判断正确的是( )。
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>X
C.X、Z、W形成的简单氢化物中X的沸点最高
D.W的最高价氧化物是一种气体污染物
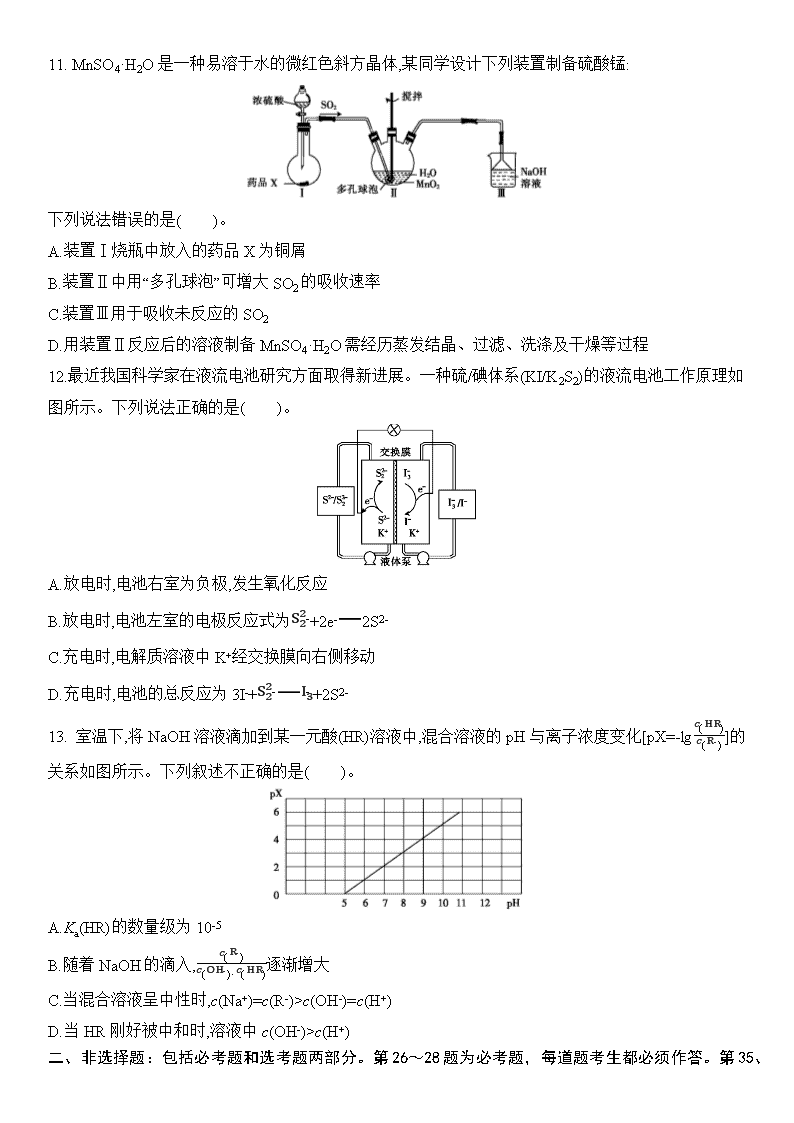
11. MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:
下列说法错误的是( )。
A.装置Ⅰ烧瓶中放入的药品X为铜屑
B.装置Ⅱ中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ用于吸收未反应的SO2
D.用装置Ⅱ反应后的溶液制备MnSO4·H2O需经历蒸发结晶、过滤、洗涤及干燥等过程
12.最近我国科学家在液流电池研究方面取得新进展。一种硫/碘体系(KI/K2S2)的液流电池工作原理如图所示。下列说法正确的是( )。
A.放电时,电池右室为负极,发生氧化反应
B.放电时,电池左室的电极反应式为S22-+2e-2S2-
C.充电时,电解质溶液中K+经交换膜向右侧移动
D.充电时,电池的总反应为3I-+S22-I3-+2S2-
13. 室温下,将NaOH溶液滴加到某一元酸(HR)溶液中,混合溶液的pH与离子浓度变化[pX=-lgc(HR)c(R-)]的关系如图所示。下列叙述不正确的是( )。
A.Ka(HR)的数量级为10-5
B.随着NaOH的滴入,c(R-)c(OH-)·c(HR)逐渐增大
C.当混合溶液呈中性时,c(Na+)=c(R-)>c(OH-)=c(H+)
D.当HR刚好被中和时,溶液中c(OH-)>c(H+)
二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。
(一)必考题:共43分。
26.二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
Ⅰ:CO(g)+2H2(g)CH3OH(g)
Ⅱ:2CH3OH(g)CH3OCH3(g)+H2O(g)
(1)300 ℃和500 ℃时,反应Ⅰ的平衡常数分别为K1、K2,且K1>K2,则其正反应为________(填“吸热”或“放热”)反应。
(2)在恒容密闭容器中发生反应Ⅰ:
①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是________(填“a”或“b”)。
②下列说法能表明反应已达到平衡状态的是________(填标号)。
A.容器中气体的压强不再变化
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.v正(H2)=2v正(CH3OH)
(3)500 K时,在2 L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
①0~4 min,反应Ⅰ的v(H2)=______________,反应Ⅰ的平衡常数K=______________。
②反应Ⅱ中CH3OH的转化率α=________。
(4)二甲醚燃料电池的工作原理如图所示,则X电极的电极反应式为________________________________。
用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为________g(精确到0.01)。
27.苯佐卡因(对氨基苯甲酸乙酯)常用于创面、溃疡面及痔疮的镇痛。在实验室用对氨基苯甲酸
()与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:
相对分
子质量
密度/
(g·cm-3)
熔点/℃
沸点/℃
溶解性
乙醇
46
0.79
-114.3
78.5
与水任意比互溶
对氨基
苯甲酸
137
1.374
188
339.9
微溶于水,易溶于乙醇
对氨基苯
甲酸乙酯
165
1.17
90
172
难溶于水,易溶于醇、醚类
产品合成:在250 mL圆底烧瓶中加入8.2 g对氨基苯甲酸(0.06 mol)和80 mL无水乙醇(约1.4 mol),振荡溶解,将烧瓶置于冰水中并加入10 mL浓硫酸,然后将反应混合物在80 ℃热水浴中加热回流1 h,并不断振荡。
分离提纯:冷却后将反应液转移到400 mL烧杯中,分批加入10% Na2CO3溶液直至pH=9,转移至分液漏斗中,用乙醚(密度0.714 g·cm-3)分两次萃取,并向醚层加入无水硫酸镁,蒸馏,冷却结晶,最终得到产物3.3 g。
(1)仪器A的名称为________,在合成反应进行之前,圆底烧瓶中还应加入适量的________________。
(2)该合成反应的化学方程式是________________。
(3)将烧瓶置于冰水中的目的是________________。
(4)分液漏斗使用之前必须进行的操作是______________,乙醚位于________(填“上层”或“下层”);分离提纯操作加入无水硫酸镁的作用是________________。
(5)合成反应中加入过量的乙醇的目的是____________;分离提纯过程中加入10% Na2CO3溶液的作用是________________。
(6)本实验中苯佐卡因的产率为________(保留3位有效数字)。该反应产率较低的原因是________(填标号)。
a.浓硫酸具有强氧化性和脱水性,导致副反应多
b.催化剂加入量不足
c.产品难溶于水,易溶于乙醇、乙醚
d.酯化反应是可逆反应
28.(14分)工业上用钒炉渣(主要含FeO·V2O3,还含有少量SiO2、P2O5等杂质)提取V2O5的流程如下:
(1)焙烧的目的是将FeO·V2O3转化为可溶性的NaVO3,写出该反应的化学方程式________________________;浸出渣的主要成分为________________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为Mg3(PO4)2、MgSiO3。
①若滤液中c(SiO)=0.08 mol·L-1,则c(PO)=________。(已知:Ksp(MgSiO3)=2.4×10-5,Ksp=2.7×10-27)
②随着温度升高,Mg2+的水解程度增大,导致除磷率下降,但除硅率升高,其原因是
________________________________________________________________________。
(3)
元素钒在溶液中主要以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO(浅黄色)等形式存在。钒液可充电电池的工作原理如图所示。
已知溶液中c(H+)=1.0 mol·L-1,阴离子为SO。
①充电时,左槽溶液颜色由蓝色逐渐变为浅黄色,则左侧电极的电极反应式为________________________。
②放电过程中,右槽溶液颜色变化为________。
③放电时,若转移的电子数为3.01×1022,则左槽溶液中n(H+)的变化为________。
(二)选考题:共15分。请考生从给出的2道化学题中任选一题作答。如果多做,则按第一题计分。
35.[化学——选修3:物质结构与性质](15分)
研究发现,在CO2低压合成甲醇反应(CO2+3H2―→CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为________________。元素Mn与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为________和________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________________,原因是
________________________________________________________________________
________________________________________________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm。
36.[化学——选修5:有机化学基础](15分)
某酯W是一种疗效明显的血管扩张剂,W的一种合成流程如下:
回答下列问题:
(1)E中含碳官能团的名称是 ;C的名称是 。
(2)AB反应条件和试剂是 ;CD的反应类型是 。
(3)写出W的结构简式: 。能测定H分子中所含化学键和官能团种类的仪器名称是 。
(4)写出FG的化学方程式: 。
(5)R是E的同分异构体,R同时具备下列条件的结构有 种。
①遇氯化铁溶液发生显色反应
②能发生水解反应和银镜反应
其中,在核磁共振氢谱上有5组峰且峰的面积之比为1∶1∶2∶2∶2的结构简式为 。
(6)设计以乙醛为原料合成环酯的路线: (其他无机试剂任选)。
参考答案
7
8
9
10
11
12
13
D
C
C
C
A
D
B
26.(1)放热
(2)①a ②AC
(3)①0.8 mol·(L·min)-1
1.25(mol·L-1)-2 ②80%
(4)CH3OCH3-12e-+3H2O===2CO2↑+12H+ 7.67
27.:(1)球形冷凝管 沸石(或碎瓷片)
(3)散热降温,减少副反应,减少乙醇挥发损失
(4)检查是否漏液 上层 干燥吸水
(5)作溶剂,提高对氨基苯甲酸的转化率 中和过量的浓硫酸和调节pH
(6)33.4%(或33.3%) ad
28.(1)4FeO·V2O3+4Na2CO3+5O28NaVO3+2Fe2O3+4CO2(2分) Fe2O3
(2)①1.0×10-8mol·L-1 ②温度升高促进SiO水解生成硅酸沉淀
(3)①VO2++H2O-e-===VO+2H+ ②由紫色变为绿色 ③减少0.05 mol
35.答案:
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2 O Mn
(2)sp sp3
(3)H2O>CH3OH>CO2>H2 水含氢键比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大
(4)离子键、π键
(5)0.148 0.076
36 (1)羧基 苯甲醛
(2)Cl2/光照 加成反应
(3) 红外光谱仪
(4)+HBrBr—
(5)13
(6)CH3CHOCH3—