- 26.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题二 物质的量
教学目标
知识技能:
1、掌握物质的量及其单位——摩尔、摩尔质量、气体摩尔体积的涵义。
2、掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状态下)之间的相互关系。
过程与方法:
通过基本计算问题的讨论,培养学生的计算思维能力。
情感态度与价值观:
在阿伏加德罗定律的应用上,着重掌握有关比例的数学思想。
教学重点:
物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系
教学难点:
阿伏加德罗常数的计算
教学过程:
【引入】今天我们复习化学常用计量。
【提问】科学家引入物质的量这个物理量的意义是什么?
【再问】谁来说说物质的量是怎样联系宏观和微观的?
学生活动
回答:把质量、体积等宏观物理量和微观的微粒个数联系起来。
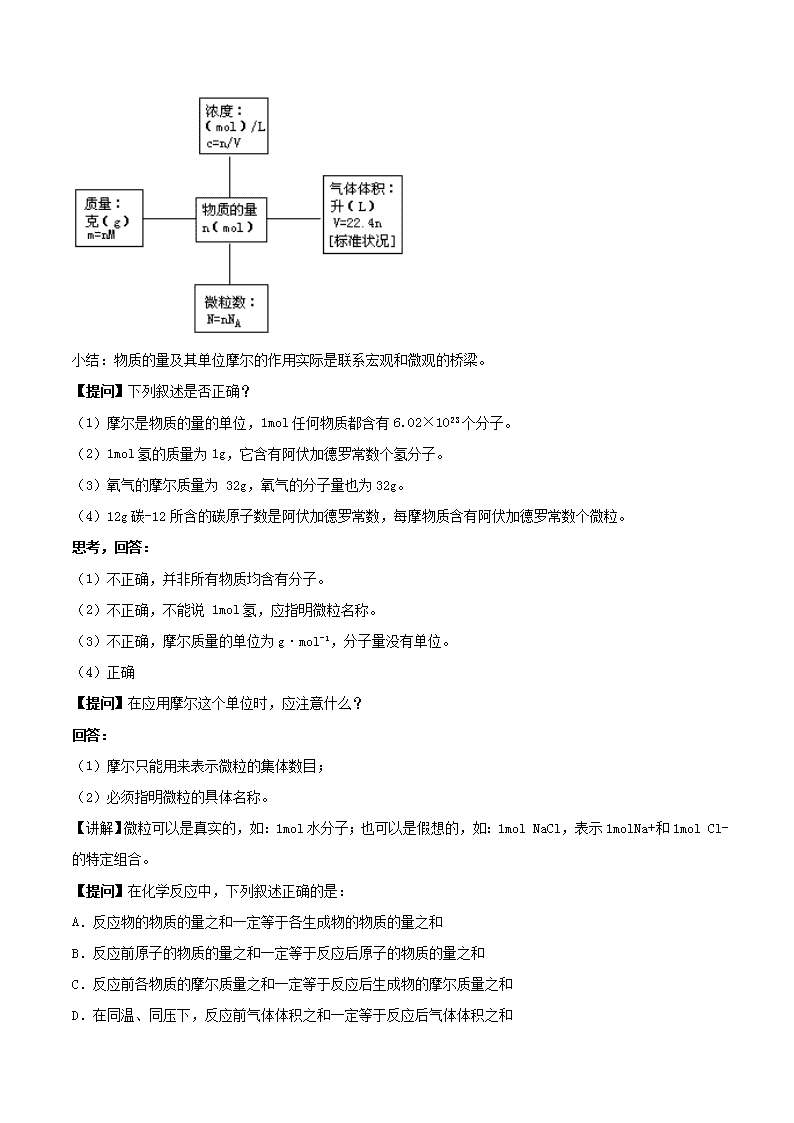
回答:主要通过以物质的量为核心物理量建立的下列关系图,把微粒数、物质质量、气体标准状况下的体积、溶液的物质的量浓度等相互关联起来。
归纳:
小结:物质的量及其单位摩尔的作用实际是联系宏观和微观的桥梁。
【提问】下列叙述是否正确?
(1)摩尔是物质的量的单位,1mol任何物质都含有6.02×1023个分子。
(2)1mol氢的质量为1g,它含有阿伏加德罗常数个氢分子。
(3)氧气的摩尔质量为 32g,氧气的分子量也为32g。
(4)12g碳-12所含的碳原子数是阿伏加德罗常数,每摩物质含有阿伏加德罗常数个微粒。
思考,回答:
(1)不正确,并非所有物质均含有分子。
(2)不正确,不能说 1mol氢,应指明微粒名称。
(3)不正确,摩尔质量的单位为g·mol-1,分子量没有单位。
(4)正确
【提问】在应用摩尔这个单位时,应注意什么?
回答:
(1)摩尔只能用来表示微粒的集体数目;
(2)必须指明微粒的具体名称。
【讲解】微粒可以是真实的,如:1mol水分子;也可以是假想的,如:1mol NaCl,表示1molNa+和1mol Cl- 的特定组合。
【提问】在化学反应中,下列叙述正确的是:
A.反应物的物质的量之和一定等于各生成物的物质的量之和
B.反应前原子的物质的量之和一定等于反应后原子的物质的量之和
C.反应前各物质的摩尔质量之和一定等于反应后生成物的摩尔质量之和
D.在同温、同压下,反应前气体体积之和一定等于反应后气体体积之和
思考,回答:
A.不正确,因为化学反应前后,分子数是可能发生变化的。
B.正确,因为原子是化学变化中的最小微粒。
C.不正确,因为分子是变化的,分子量很可能变化,摩尔质量也随之变化。
D.不正确,因为在同温、同压下,气体的体积随分子数变化。
【小结】化学反应的实质是分子组成、分子结构发生了变化。
【提问】质量守恒定律从宏观和微观两方面的涵义是什么?
回答:
在宏观上,反应物的总质量等于生成物的总质量;从微观上,反应物中原子的种类和总个数(或总物质的量)等于生成物中原子的种类和总个数(或总物质的量)。
【强调】物质的质量守恒定律在化学计算中有很重要的应用,需要大家努力掌握应用守恒的计算技巧。
【过渡】下面让我们再讨论一下有关气体摩尔体积的问题。
【提问】什么是气体摩尔体积?
回答:标准状况下,1mol任何气体的体积都约为22.4L。
【再问】标准状况的涵义是什么?
回答:273K,1.01×105Pa,或0℃,1atm。
提问:老师,标准状况下三氧化硫是气体吗?
【强调】气体摩尔体积不适用于非标准状况的气体及液体、固体。
【反问】谁知道这个问题?
回答:三氧化硫的熔点为16℃,标准状况下当然是固体。
【提问】有关气体问题的最重要的一个定律就是阿伏加德罗定律,谁来叙述一下该定律的内容?
回答:同温、同压下,同体积的气体具有相同的分子数。
【讲解】阿伏加德罗定律适用于任何状态下的气体,可归纳为:pV=nRT
具体应用有:(1)同温、同压下,体积比等于物质的量之比;(2)同温、同体积下,压强比等于物质的量之比;(3)同温、同压下,密度比等于摩尔质量(分子量)之比。
【板书并讲解】根据 pV=nRT和 n=m/M得:pV=(m/M)RT
pM=(m/V)RT
pM=ρRT
因此,同温、同压下,气体的密度之比等于摩尔质量(分子量)之比。
提问:为什么同温、同压下,密度之比等于摩尔质量(分子量)之比?
【引导小结】气体分子量计算的常用公式:
①气体的摩尔质量=标准状况下气体密度×22.4。
②同温、同压下,气体的分子量与气体的密度成正比。
③混合气体的平均摩尔质量=混合气体总质量÷混合气体的总物质的量。
回忆、归纳、小结:
(1)M=ρ0×p22.4
(2)M=ρA×MA
(3)M=Σm/Σn
【提问】下列说法正确的是:
A.1mol任何物质在标准状况下的体积都约是22.4L
B.0.5 mol氢气的体积为11.2L
C.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L
D.在20L恒容密闭容器中,充入1mol的氮气和3mol氢气,达平衡后有0.5mol的氮气反应,平衡后混合气体的体积仍为20L
思考,回答:
A.不正确,只有1mol气体在标准状况下的体积都约是22.4L,不能说任何物质。
B.不正确,因为没有指明标准状况。
C.不正确,因为三氧化硫在标准状况下不是气体。
D.正确,因为不论在任何条件下,气体都将充满整个容器。
【评价】回答得很好,请注意 D选项的条件不是标准状况。
【提问】下列说法正确的是:
A.标准状况下,1L辛烷完全燃烧生成8/22.4 mol的二氧化碳分子
B.在标准状况下,任何气体的体积都约为22.4L
C.常温常压下,1mol氮气含有阿伏加德罗常数个氮分子
D.常温常压下,金属和酸反应,若生成2g 氢气,则有2mol电子发生转移
思考,回答:
A正确,辛烷的分子式为C8H18,在标准状况下1L辛烷的物质的量是1/22. 4mol,因此,完全燃烧生成 8/22.4 mol的二氧化碳分子。
B.不正确,因为没有指明气体的物质的量是1mol。
C.正确,1mol氮气的分子数与是否标准状况无关。
D.正确,不论在任何条件下,2g氢气都是1mol,无论什么金属生成氢气的反应均可表示为:2H++2e=H2↑,因此,生成1mol氢气一定转移 2mol电子。
【质疑】辛烷在标准状况下是否为气体?
回答:辛烷在标准状况下为液体。
【评价】辛烷是汽油成分之一,在标准状况下为液体,1L辛烷的物质的量不是 1/22.4mol,因此,A选项是不正确的。
【提问】设N表示阿伏加德罗常数,则下列说法正确的是:
A.标准状况下,以任意比例混合的甲烷和丙烷混合气体22.4L,所含的气体的分子数约为N个
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5N个
C.常温下,2.3g金属钠变成钠离子时,失去的电子数目为0.1N个
D.常温下,18g重水所含中子数为10N个
思考,回答:
A.正确,任意比例混合的甲烷和丙烷混合气体 22.4L,气体的总物质的量为1mol,因此含有N个分子。
B.不正确,因为NO和氧气一接触就会立即反应生成二氧化氮。
C.正确,2.3g钠是0.1mol钠原子,钠原子变成离子的反应为:
Na-e=Na+
0.1mol钠原子就失去0.1mol电子,也就是0.1NA个电子。
D.不正确,重水分子(D2O)中含有10个中子,分子量为 20,18g重水所含中子
数为:10×18g/20g· mol-1=9mol。
【强调】温度和压强条件只影响气体的体积,而不影响气体的质量和物质的量,因此,如果讨论物质的量、质量和微粒数目的关系,则与是否标准状况无关。
【引导小结】在计算中需要注意的问题:
(1)有关微粒个数计算,需要注意什么?
(2)有关气体的计算,需要注意什么?
(3)有关方程式的计算,需要注意什么常用技巧?
归纳、小结:
(1)注意分子数和原子数、质子数、电子数、中子数的比例关系
(2)注意温度和压强条件对气体体积的影响很大,因此应用气体摩尔体积计算必须要求标准状况条件,并注意标准状况下不是气体或不能共存的混合气的问题。
(3)注意运用电子守恒的计算技巧。