- 304.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业(三十五)无机化学的综合应用——化学工艺流程题
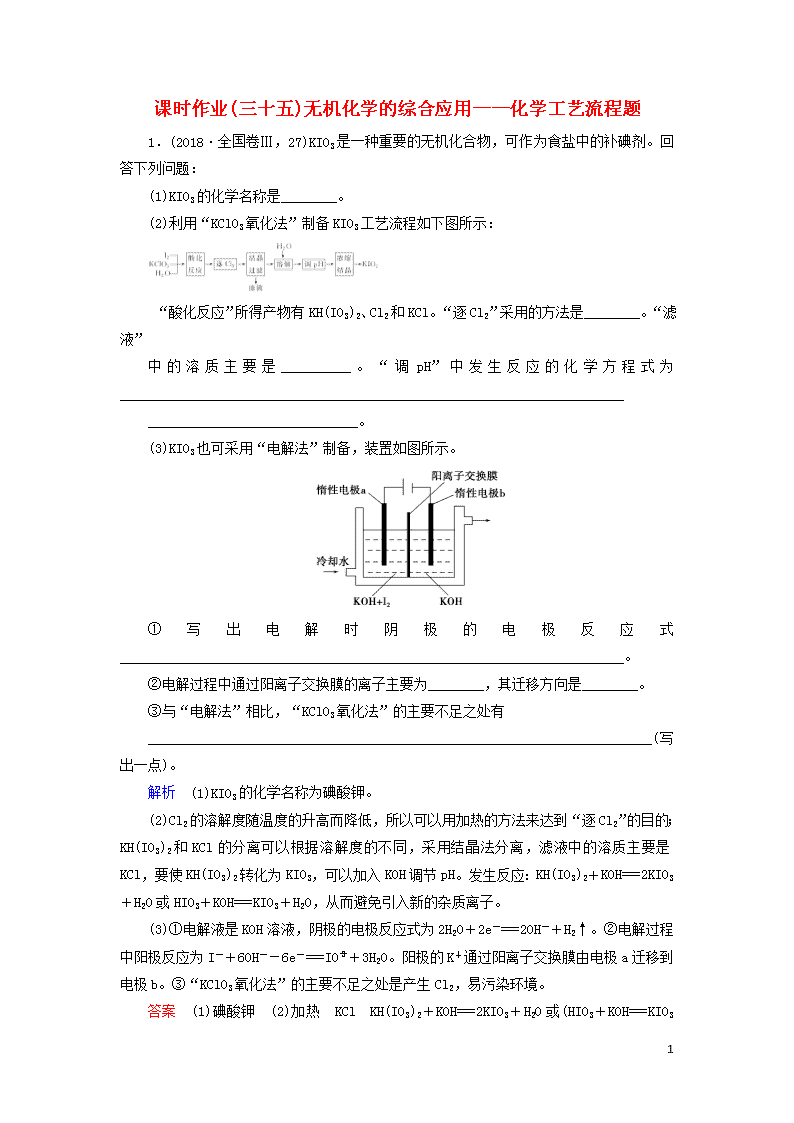
1.(2018·全国卷Ⅲ,27)KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”
中的溶质主要是__________。“调pH”中发生反应的化学方程式为________________________________________________________________________
______________________________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式________________________________________________________________________。
②电解过程中通过阳离子交换膜的离子主要为________,其迁移方向是________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有
________________________________________________________________________(写出一点)。
解析 (1)KIO3的化学名称为碘酸钾。
(2)Cl2的溶解度随温度的升高而降低,所以可以用加热的方法来达到“逐Cl2”的目的;KH(IO3)2和KCl的分离可以根据溶解度的不同,采用结晶法分离,滤液中的溶质主要是KCl,要使KH(IO3)2转化为KIO3,可以加入KOH调节pH。发生反应:KH(IO3)2+KOH===2KIO3+H2O或HIO3+KOH===KIO3+H2O,从而避免引入新的杂质离子。
(3)①电解液是KOH溶液,阴极的电极反应式为2H2O+2e-===2OH-+H2↑。②电解过程中阳极反应为I-+6OH--6e-===IO+3H2O。阳极的K+通过阳离子交换膜由电极a迁移到电极b。③“KClO3氧化法”的主要不足之处是产生Cl2,易污染环境。
答案 (1)碘酸钾 (2)加热 KCl KH(IO3)2+KOH===2KIO3+H2O或(HIO3+KOH===KIO3
10
+H2O)
(3)①2H2O+2e-===2OH-+H2↑ ②K+ 由a到b ③产生Cl2易污染环境等
2.(2018·江苏卷,16)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为________________________________________________________________________。
(2)添加1% CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如下图所示。
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=1-×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于________。
②700 ℃焙烧时,添加1% CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是________________________________________________________________________
________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由________(填化学式)转化为________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=________。
解析 (1)NaOH吸收过量SO2的离子方程式为SO2+OH-===HSO。
(2)①由已知多数金属硫酸盐的分解温度都高于600 ℃,不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于杂质FeS2。
②700 ℃焙烧时,FeS2中的硫元素生成SO2,添加CaO后,SO2会与CaO、O2反应生成CaSO4而留在矿粉中。
(3)用NaOH溶液碱浸后,Al2O3、SiO2溶解,转化为NaAlO2和Na2SiO3,通入过量CO2后,NaAlO2与CO2反应转化为Al(OH)3。
(4)Fe2O3与FeS2在缺氧条件下焙烧生成Fe3O4和SO2
10
,发生反应的化学方程式配平为16Fe2O3+FeS211Fe3O4+2SO2↑,可得关系式FeS2~16Fe2O3,则理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=1∶16。
答案 (1)SO2+OH-===HSO
(2)①FeS2 ②硫元素转化为CaSO4而留在矿粉中
(3)NaAlO2 Al(OH)3 (4)1∶16
3.(2019·河南郑州模拟) CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质) 为原料制备CoCO3的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算):
金属离子
开始沉淀的pH
沉淀完全的pH
Co2+
7.6
9.4
Al3+
3.0
5.0
Zn2+
5.4
8.0
(1)写出“酸溶”时发生氧化还原反应的化学方程式__________________________________。
(2)“除铝”过程中需要调节溶液pH的范围为________,形成沉渣时发生反应的离子方程式为________________________________________________________________________
________________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是________________________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因________________________________________________________________________
________________________________________________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2的体积为0.672 L(标准状况),则该钴氧化物的化学式为________。
解析 (1)“酸溶”时加入H2SO4和SO2,由于SO2具有还原性,SO2将钴废渣中+3价的Co还原为+2价,“酸溶”时发生的非氧化还原反应为:CoO+H2SO4===CoSO4+H2O、Al2O3+3H2SO4===Al2(SO4)3+3H2O、ZnO+H2SO4===ZnSO4+H2O,发生的氧化还原反应为Co2O3+SO2
10
+H2SO4===2CoSO4+H2O。(2)“除铝”过程中Al3+完全沉淀,其它金属阳离子不形成沉淀,根据Co2+、Al3+、Zn2+开始沉淀和沉淀完全的pH,“除铝”过程中需要调节溶液pH的范围为5.0~5.4。形成沉渣时加入的是Na2CO3,发生的是Al3+与CO的双水解反应,形成沉渣时反应的离子方程式为2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑。(3)在实验室里,萃取操作用到的玻璃仪器主要有分液漏斗、烧杯。由有机层获得ZnSO4溶液,要使平衡ZnSO4(水层)+2HX(有机层)ZnX2(有机层)+H2SO4(水层)逆向移动,所以要向有机层中加入硫酸然后分液,由有机层获得ZnSO4溶液的操作是:向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层。(4)“沉钴”时是向CoSO4溶液中加入Na2CO3溶液产生CoCO3沉淀,由于Na2CO3溶液呈碱性,若Na2CO3溶液滴加过快会导致局部碱性过强而产生Co(OH)2沉淀,导致产品CoCO3中混有Co(OH)2。
答案 (1) Co2O3+SO2+H2SO4===2CoSO4+H2O
(2)5.0~5.4 2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑ (3)分液漏斗,烧杯 向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层 (4)Na2CO3溶液滴加过快,会导致局部碱性过强而产生Co(OH)2 (5)Co3O4
4.(2018·哈尔滨三中二模) 某含铬污泥主要含Cr2O3、Al2O3、Fe2O3等物质,该污泥可以用湿法回收利用,流程如下图所示:
已知:室温下部分氢氧化物的Ksp见下表
Al(OH)3
Fe(OH)3
Cr(OH)3
Mn(OH)2
Ksp
3×10-34
4×10-38
6×10-31
4×10-14
(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨的作用是________________________________________________________________________
________________________________________________________________________。
(2)向滤液Ⅰ加KMnO4氧化Cr3+的离子方程式是________________________________________________________________________
________________________________________________________________________;
将Cr3+氧化的目的是________________________________________________________________________
________________________________________________________________________。
(3)室温下,调pH=10时,=________;调溶液pH不能大于10,理由是________________________________________________________________________
10
________________________________________________________________________。
(4)NaHSO3在反应中的作用是________________;理论上n(NaHSO3)∶n[CrOH(H2O)5SO4]之比是______。
(5)NaHSO3固体在空气中易变质,写出检验NaHSO3是否变质的方法________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
解析 (1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨可以增大接触面积,加快反应速率,增加酸浸时金属元素浸出率;(2)KMnO4氧化Cr3+的离子方程式为10Cr3++6MnO+11H2O===6Mn2++5Cr2O+22H+;根据氢氧化物的Ksp,将Cr3+氧化可以防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降;(3)室温下,调pH=10时,====7.5×103;为了防止碱性过强Al(OH)3沉淀溶解生成AlO,无法分离,溶液pH不能大于10;(4)加入NaHSO3可以将溶液的Cr2O还原为Cr3+;根据得失电子守恒,理论上n(NaHSO3)×(6-4)=n[CrOH(H2O)5SO4]×(6-3),解得n(NaHSO3)∶n[CrOH(H2O)5SO4]=3∶2;(5)NaHSO3固体在空气中易被空气氧化为硫酸氢钠而变质,检验NaHSO3是否变质只需要检验硫酸根离子即可,方法为取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质。
答案 (1)增大接触面积,加快反应速率,增加酸浸时金属元素浸出率 (2)10Cr3++6MnO+11H2O===6Mn2++5Cr2O+22H+ 防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降 (3)7.5×103 防止碱性过强Al(OH)3沉淀溶解生成AlO,无法分离 (4)还原剂 3∶2 (5)取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质
5.(2018·东北三校二模)以工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质含Si、Fe、Cu、Cd等元素)为原料,可以制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:
已知:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14
10
(1)“碱浸”过程中PbSO4发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________,
气体A的化学式为____________。
(2)“酸浸”过程中pH不宜过低,若pH过低,可能出现的问题是________________________________________________________________________
__________________。
(3)“沉降Ⅰ”过程中发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)滤液D中溶质的主要成分为__________,为制得较为纯净的ZnO,“煅烧”之前应该进行的操作Ⅰ是__________________。
(5)以1t含锌元素10%的铅锌废渣为原料,制得活性氧化锌113.4 kg,依据以上数据________(填“能”或“不能”)计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由________________________________________________________________________
________________________________________________________________________。
解析 (1)已知Ksp(PbSO4)=1.6×10-8>Ksp(PbCO3)=7.4×10-14。所以 “碱浸”过程中PbSO4发生反应的离子方程式为 PbSO4 (s)+CO(aq)PbCO3(s)+SO(aq),固体A为PbCO3(s),酸浸后产生的气体为CO2, A 的化学式为CO2。(2)“酸浸”过程中pH不宜过低,若pH过低,酸性强,使Fe与酸反应生成有关铁的化合物,进入到滤液C中,再加碱进行沉降时,会出现Fe(OH)3沉淀,影响PbCrO4纯度。(3)由知“沉降1”过程中发生反应的离子方程式为:2Pb2++2OH-+Cr2O===2PbCrO4↓+H2O。(4)由图知滤液B中含有的离子为Zn2+、NH、CO ,加H2SO4调节溶液的PH=6~6.5出现Zn2(OH)2CO3沉淀,滤液为(NH4)2SO4,所以滤液D中溶质的主要成分为(NH4)2SO4。为制得较为纯净的ZnO,“煅烧”之前应该对固体进行洗涤干燥处理。(5)根据图知不能,因为在除去铜、镉的过程中添加了锌粉,最终ZnO中的锌元素不完全来自于铅锌废渣,无法计算铅锌废渣中锌元素的回收率。
答案 (1) PbSO4 (s)+CO(aq)PbCO3(s)+SO(aq) CO2 (2)铁元素以离子形式进入到滤液C中,影响PbCrO4纯度 (3)2Pb2++2OH-+Cr2O===2PbCrO4↓+H2O (4)(NH4)2SO4 洗涤、干燥 (5)不能 除去铜、镉的过程中添加了锌粉,最终ZnO中的锌元素不完全来自于铅锌废渣,无法计算铅锌废渣中锌元素的回收率
10
6.(2019·福建百校模拟)以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
(1)用H2SO4溶解后过滤,得到的滤渣是__________(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____________________。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是__________________________________。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-===Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是________________________________________________________________________
________________________________________________________________________
________________。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
(5)弱酸和弱碱的电离平衡常数的负对数可用pK表示,根据下表中数据判断(NH4)2C2O4溶液中各离子的浓度由大到小的顺序为________________________________________________________________________。
H2C2O4
pKa1=1.25,pKa2=4.13
NH3·H2O
pKb=4.76
(6)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤其原因是________________________________________________________________________。
10
(7)准确称取1.470 g CoC2O4,在空气中充分灼烧得0.814 g复合氧化钴,写出复合氧化钴的化学式:________________________________________________________________________。
解析 (1)钴废催化剂加入稀硫酸,发生Co+H2SO4===CoSO4+H2↑,Fe+H2SO4===FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,洗液与滤液合并,提高洗涤和滤液中钴的利用率;(2)亚铁离子被氯酸根离子氧化成铁离子,1 mol的亚铁离子失去1 mol的电子,而1 mol的氯酸根离子得到6 mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO6Fe3++Cl-+3H2O,(3)取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;(4)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,离子方程式为:6Fe3++4SO+6H2O+2Na++6CO===Na2Fe6(SO4)4(OH)12↓+6CO2↑。(5)根据pK的大小关系,可以判断出电离常数的大小关系为Ka1>Ka2>Kb,所以对应离子的水解程度大小为NH>C2O>HC2O,水解程度越大溶液中剩余离子浓度就越小,所以溶液中的离子浓度大小顺序为:c(NH)>c(C2O)>c(H+)>c(HC2O)>c(OH-)。(6)由CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出;(7)CoC2O4的质量为1.470 g,其物质的量为0.01 mol,Co元素质量为0.59 g,钴氧化物质量为0.814 g,氧化物中氧元素质量为0.814 g-0.59 g=0.224 g,则氧化物中Co原子与O原子物质的量之比为0.01 mol∶ mol≈5∶7,故Co氧化物为Co5O7。
答案 (1)SiO2 提高钴元素的利用率 (2)6Fe2++6H++ClO6Fe3++Cl-+3H2O (3)取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化 (4)6Fe3++4SO+6H2O+2Na++6CO===Na2Fe6(SO4)4(OH)12↓+6CO2↑ (5)c(NH)>c(C2O)>c(H+)>c(HC2O)>c(OH-) (6)防止因温度降低,CoCl2晶体析出 (7)Co5O7
7.(2017·全国卷Ⅲ,27)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
10
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为________。该步骤不能使用陶瓷容器,原因是________________________________________________________________________
____________。
(2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的pH使之变________(填“大”或“小”),原因是________________________________________________________________________
(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________(填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是____________。
(5)某工厂用m1 kg铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品m2 kg,产率为________________________________________________________________________。
解析 (1)由题中反应可知,FeO·Cr2O3是还原剂,Fe元素化合价由+2升高到+3,Cr元素化合价由+3升高到+6,1 mol FeO·Cr2O3失去7 mol电子;NaNO3是氧化剂,N元素化合价由+5降低到+3,1 mol NaNO3得到2 mol电子。根据电子守恒可得,FeO·Cr2O3和NaNO3的系数比为2∶7。步骤①不能使用陶瓷容器的原因是陶瓷在高温下会与Na2CO3反应。(2)熔块中Fe2O3不溶于水,过滤后进入滤渣1,则滤渣1中含量最多的金属元素是铁。滤液1中含有AlO、SiO及CrO,调节溶液pH=7,则SiO转化为H2SiO3、AlO转化为Al(OH)3,故滤渣2为Al(OH)3及含硅杂质。(3)由流程图可知,滤液2通过调节pH使CrO转化为Cr2O,根据离子方程式2CrO+2H+Cr2O+H2O可知,增大H+浓度,即pH变小,可以使上述平衡右移,有利于提高溶液中的Cr2O浓度。(4)由图像可知,在10℃左右时得到的K2Cr2O7固体最多。发生反应为2KCl+Na2Cr2O7===K2Cr2O7
10
+2NaCl,该反应为复分解反应。(5)根据铬元素守恒可得:Cr2O3~K2Cr2O7,理论上m1 kg铬铁矿粉可制得K2Cr2O7的质量:×294 g·mol-1,则K2Cr2O7的产率为×100%=×100%。
答案 (1)2∶7 陶瓷在高温下会与Na2CO3反应
(2)Fe Al(OH)3
(3)小 2CrO+2H+Cr2O+H2O
(4)d 复分解反应 (5)×100%
10