- 391.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
非选择必考题标准练(七)
满分:58分
1.(14分)氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如下实验制备卤砂并进行元素测定。
Ⅰ.实验室制备卤砂所需的装置如图所示,装置可重复选用。
(1)装置接口连接顺序是c→d→e→a;b←g←f←c。
(2)C装置的作用是干燥氨气,D装置盛装的物质是浓硫酸。
(3)写出用上述装置制备氨气的一组试剂:浓氨水和碱石灰(或其他合理答案)。
Ⅱ.测定卤砂中Cl元素和N元素的质量之比。
该研究小组准确称取a g卤砂,与足量氧化铜混合加热,充分反应后把气体产物按如图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为V L,碱石灰增重b g。
(4)E装置内的试剂为浓硫酸,卤砂与氧化铜混合加热反应的化学方程式为2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O。
(5)卤砂中Cl元素和N元素的质量之比为∶(用含b、V的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将a
7
g卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:合理,氯化铵样品纯净,溶于水后其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯元素的质量(或不合理,氨化铵样品不纯,杂质离子也发生了沉淀反应)。
解析:(1)结合实验目的及题给装置可知,从a、b接口分别向锥形瓶中通入NH3和HCl,可用B装置制备HCl,经D装置干燥后通入b,装置接口连接顺序为c→f→g→b;也可用B装置制备NH3,经C装置干燥后通入a,装置接口连接顺序为c→d→e→a。(2)C装置用于干燥NH3,D装置用于干燥HCl,盛装的物质是浓硫酸。(3)用B装置制备NH3可选用浓氨水和碱石灰。(4)NH4Cl与CuO的反应为2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O,装置E内盛装浓硫酸,可用于干燥气体。(5)装置F中碱石灰增加的重量等于HCl的质量,装置G中收集到的气体为N2,则卤砂中Cl元素与N元素的质量之比为∶×28=∶。(6)若NH4Cl样品纯净,其完全溶于水后,加入过量AgNO3溶液,溶液中的Cl-完全转化为AgCl,根据AgCl的质量可确定NH4Cl样品中Cl元素的质量;若NH4Cl样品不纯,混有的杂质离子也发生沉淀反应,则不能根据生成沉淀的质量确定NH4Cl样品中Cl元素的质量。
2.(14分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,还含少量Cr、FeS等)来制备,其工艺流程如下:
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑。
(2)“溶解”时放出的气体为H2、H2S(填化学式)。
(3)已知金属离子开始沉淀和完全沉淀的pH如表:
开始沉淀的pH
完全沉淀的pH
Ni2+
6.2
8.6
Fe2+
7.6
9.1
Fe3+
2.3
3.3
7
Cr3+
4.5
5.6
“调pH1”时,溶液pH的范围为5.6≤pH<6.2。
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式:4Ni(OH)2+O24NiOOH+2H2O。
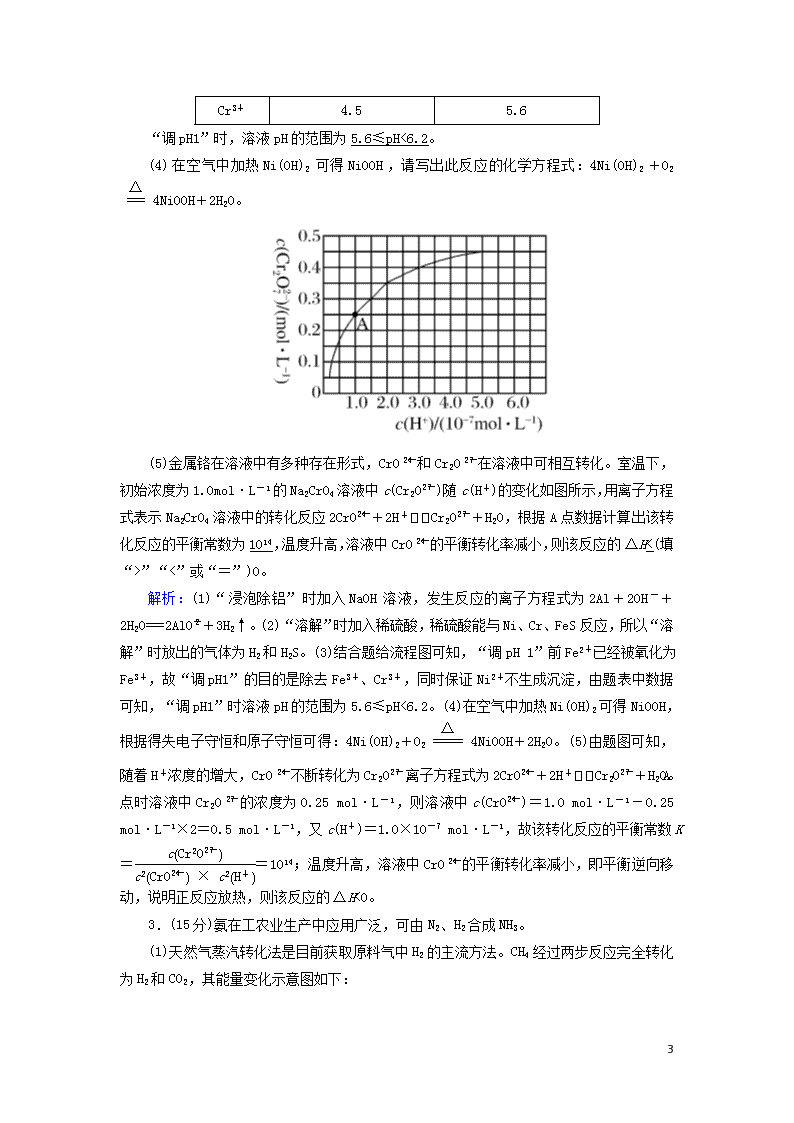
(5)金属铬在溶液中有多种存在形式,CrO和Cr2O在溶液中可相互转化。室温下,初始浓度为1.0mol·L-1的Na2CrO4溶液中c(Cr2O)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO+2H+Cr2O+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO的平衡转化率减小,则该反应的ΔH<(填“>”“<”或“=”)0。
解析:(1)“浸泡除铝”时加入NaOH溶液,发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑。(2)“溶解”时加入稀硫酸,稀硫酸能与Ni、Cr、FeS反应,所以“溶解”时放出的气体为H2和H2S。(3)结合题给流程图可知,“调pH 1”前Fe2+已经被氧化为Fe3+,故“调pH1”的目的是除去Fe3+、Cr3+,同时保证Ni2+不生成沉淀,由题表中数据可知,“调pH1”时溶液pH的范围为5.6≤pH<6.2。(4)在空气中加热Ni(OH)2可得NiOOH,根据得失电子守恒和原子守恒可得:4Ni(OH)2+O24NiOOH+2H2O。(5)由题图可知,随着H+浓度的增大,CrO不断转化为Cr2O,离子方程式为2CrO+2H+Cr2O+H2O。A点时溶液中Cr2O的浓度为0.25 mol·L-1,则溶液中c(CrO)=1.0 mol·L-1-0.25 mol·L-1×2=0.5 mol·L-1,又c(H+)=1.0×10-7 mol·L-1,故该转化反应的平衡常数K==1014;温度升高,溶液中CrO的平衡转化率减小,即平衡逆向移动,说明正反应放热,则该反应的ΔH<0。
3.(15分)氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:
7
结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)。
①起还原作用的物质是CH4。
②膜Ⅰ侧所得气体中=2,CH4、H2O、O2反应的化学方程式是10CH4+8H2O+O2===10CO+28H2。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是D。
7
A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠT2>T1。
②在T2、60 MPa条件下,A点v正>(填“>”“<”或“=”)v逆,理由是在T2、60_MPa时A点未达到平衡时的体积分数,反应正向进行。
③计算T2、60 MPa平衡体系的平衡常数Kp=0.043或0.042_7MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字)。
解析:(1)结合图象可知,第一步反应的热化学方程式为①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1,第二步反应的热化学方程式为②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41.0 kJ·mol-1,根据盖斯定律,由①+②得:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1。
(2)①结合工作原理图知,膜Ⅰ侧反应物为空气中的O2和H2O,得电子生成O2-和H2;膜Ⅱ侧反应物为CH4和O2-,失去电子生成CO和H2,起还原作用的是CH4。②设膜Ⅰ侧参加反应的空气中的n(N2)=4 mol、n(O2)=1 mol,则膜Ⅰ侧所得气体中n(N2)=4 mol、n(H2)=8 mol,膜Ⅰ侧的还原反应为O2+4e-===2O2-和H2O+2e-===H2↑+O2-,则n(O2)反应=1 mol,n(H2O)反应=8 mol,膜Ⅱ侧的氧化反应为CH4+O2--2e-===2H2
7
+CO,根据得失电子守恒,膜Ⅱ侧n(CH4)反应=10 mol,故CH4、H2O、O2反应的化学方程式为10CH4+8H2O+O2===10CO+28H2。
(3)温度不变,平衡常数K不变,A项错误;若t2 min时改变的条件是大量通入N2或H2,则平衡时NH3的体积分数:φ(Ⅱ)<φ(Ⅰ),B项错误;容器恒容,且过程Ⅰ和Ⅱ中混合气体的质量不变,混合气体的密度为固定值,C项错误;t2 min时改变条件,v逆瞬时不变后逐渐增大至不变,则平衡正向移动,所以改变的条件是向容器中加入反应物(可以是N2或H2或N2和H2的混合气),D项正确。
(4)①合成氨反应的正反应为放热反应,温度越高平衡时NH3的体积分数越小,所以T3>T2>T1。②在T2、60 MPa条件下,A点时NH3的体积分数小于平衡时NH3的体积分数,此时反应正向进行,所以v正>v逆。③结合图象知T2、60 MPa平衡时NH3的体积分数为60%,则平衡时φ(N2)=15%,φ(H2)=25%,Kp=(60MPa×60%)2/[(60 MPa×15%)×(60 MPa×25%)3]≈0.043(MPa)-2。
4.(15分)氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB===NH)3通过如下反应制得:
3CH4+2(HB===NH)3+6H2O===3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为2s22p1,B、C、N、O第一电离能由大到小的顺序为N>O>C>B,CH4、H2O、CO2的键角按照由大到小的顺序排列为CO2>CH4>H2O。
(2)与(HB===NH)3互为等电子体的有机分子为C6H6(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
①C16S8分子中C原子和S原子的杂化轨道类型分别为sp2、sp3。
②相关键长数据如表所示:
化学键
C—S
C===S
C16S8中碳硫键
7
键长/pm
181
155
176
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C===S键之间,原因可能是C16S8分子中的碳硫键具有一定程度的双键性质。
③C16S8与H2微粒间的作用力是范德华力。
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为Cu3AgH8。
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为 cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
解析:Ⅰ.(1)基态B原子的价电子排布式为2s22p1;一般情况下,同周期主族元素从左到右元素的第一电离能呈增大趋势,但是由于N原子的2p轨道上的电子处于半充满的稳定状态,所以其第一电离能比O原子的大,因此,元素第一电离能由大到小的顺序为N>O>C>B;CH4是正四面体形分子,键角为109°28′,H2O是V形分子,键角为105°,CO2是直线形分子,键角为180°,因此三者键角按照由大到小的顺序排列为CO2>CH4>H2O。(2)与(HB===NH)3互为等电子体的有机分子为C6H6。
Ⅱ.(1)①根据图1可知,C原子采取sp2杂化,S原子采取sp3杂化。②C16S8分子中的碳硫键具有一定程度的双键性质,从而导致C16S8中碳硫键键长介于C—S键与C===S键之间。③C16S8与H2微粒间的作用力为范德华力。(2)根据题意知,该晶胞中铜原子数=6×=3,银原子数=8×=1,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中,则H原子位于该晶胞内部,储氢后该晶胞中含有8个H,则该晶体储氢后的化学式为Cu3AgH8。(3)该晶胞中Mg原子数=8×+1=2,H原子数=2+4×=4,则该晶胞中含2个MgH2,该晶胞的体积V= cm3。
7