- 540.98 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
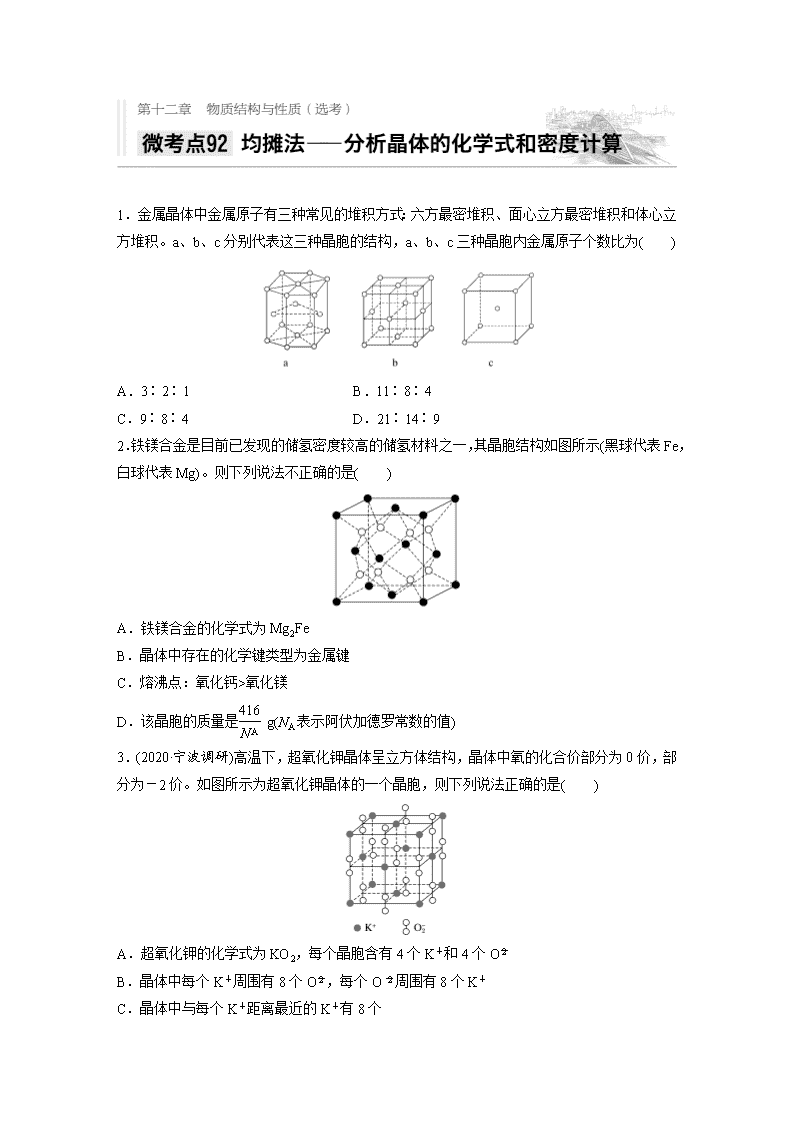
1.金属晶体中金属原子有三种常见的堆积方式:六方最密堆积、面心立方最密堆积和体心立方堆积。a、b、c分别代表这三种晶胞的结构,a、b、c三种晶胞内金属原子个数比为( )
A.3∶2∶1 B.11∶8∶4
C.9∶8∶4 D.21∶14∶9
2.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是( )
A.铁镁合金的化学式为Mg2Fe
B.晶体中存在的化学键类型为金属键
C.熔沸点:氧化钙>氧化镁
D.该晶胞的质量是 g(NA表示阿伏加德罗常数的值)
3.(2020·宁波调研)高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
B.晶体中每个K+周围有8个O,每个O周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个O距离最近的O有6个
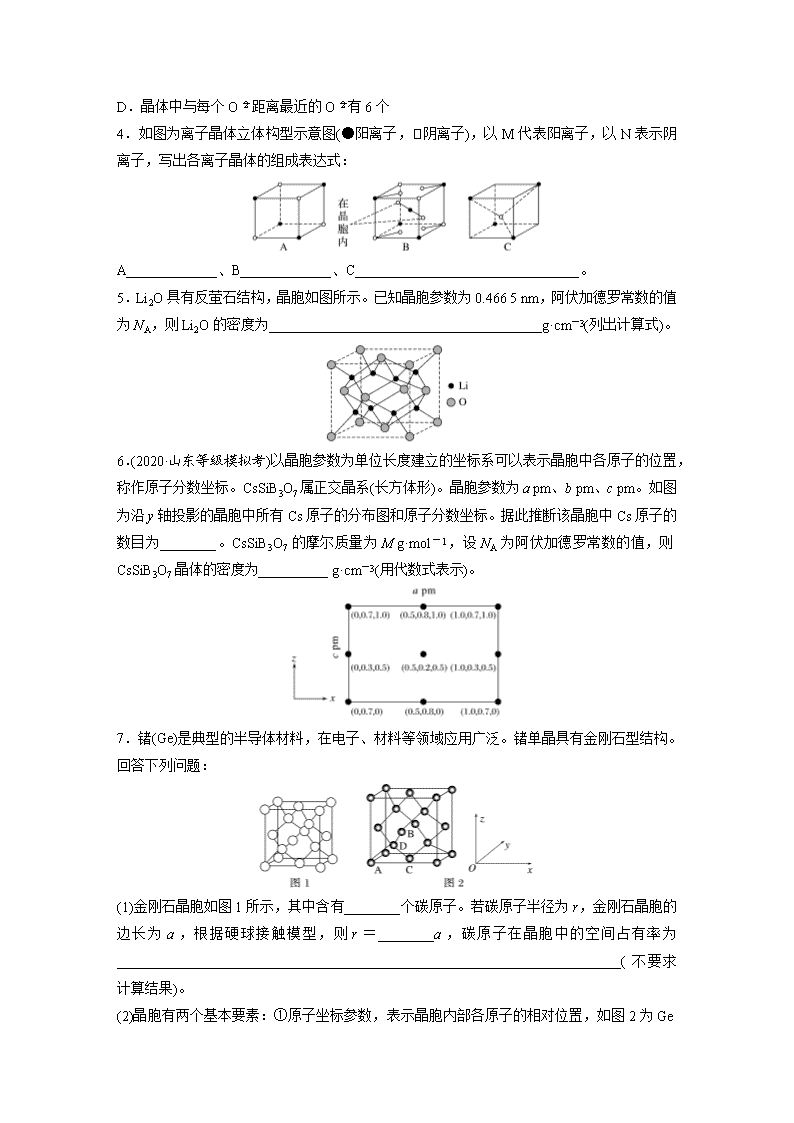
4.如图为离子晶体立体构型示意图(●阳离子,阴离子),以M代表阳离子,以N表示阴离子,写出各离子晶体的组成表达式:
A_____________、B_____________、C________________________________。
5.Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为_______________________________________g·cm-3(列出计算式)。
6.(2020·山东等级模拟考)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形)。晶胞参数为a pm、b pm、c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为________。CsSiB3O7的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为__________ g·cm-3(用代数式表示)。
7.锗(Ge)是典型的半导体材料,在电子、材料等领域应用广泛。锗单晶具有金刚石型结构。回答下列问题:
(1)金刚石晶胞如图1所示,其中含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________a,碳原子在晶胞中的空间占有率为________________________________________________________________________(不要求计算结果)。
(2)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图2为Ge
单晶的晶胞,其中原子坐标参数A为(0,0,0);B为;C为。则D原子的坐标参数为________。②晶胞参数描述晶胞的大小和形状,已知Ge单晶的晶胞参数a′=565.76 pm,其密度为_______________________________________g·cm-3(列出计算式即可)。
答案精析
1.A
2.C [依据均摊法,晶胞中共有4个铁原子,8个镁原子,故化学式为Mg2Fe,一个晶胞中含有4个“Mg2Fe”,其质量为×104 g= g。在元素周期表中,镁元素在钙元素的上一周期,故Mg2+半径比Ca2+半径小,氧化镁的熔沸点较氧化钙大,故C项错误。]
3.A
4.MN MN3 MN2
解析 在A中,含M、N的个数相等,故组成为MN;在B中,含M:×4+1=个,含N:×4+2+4×=个,M∶N=∶=1∶3;在C中,含M:×4=个,含N为1个。
5.
6.4 ×1030
解析 原子分数坐标为(0.5,0.2,0.5)的Cs原子位于晶胞体内,原子分数坐标为(0,0.3,0.5)及(1.0,0.3,0.5)的Cs原子位于晶胞的yz面上,原子分数坐标为(0.5,0.8,1.0)及(0.5,0.8,0)的Cs原子位于晶胞xy面上,原子分数坐标为(0,0.7,1.0)及(1.0,0.7,1.0)(0,0.7,0)及(1.0,0.7,0)的Cs原子位于晶胞平行于y轴的棱上,利用均摊法可计算该晶胞中共含Cs原子4个;带入晶胞密度求算公式可得:
ρ===×1030 g·cm-3。
7.(1)8
(2)① ②
解析 (1)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,所以金刚石晶胞中C原子数目为4+6×+8×=8;若C原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则正方体体对角线长度的就是C—C键的键长,即a=2r,所以r=a,碳原子在晶胞中的空间占有率===。(2)①对照晶胞图示、坐标系以及A、B、C的坐标,选A作为参照,观察D在晶胞中的位置(
体对角线的处),由B、C的坐标可以推知D的坐标为。②类似金刚石晶胞,1个Ge单晶的晶胞中含有8个锗原子,则ρ= g·cm-3= g·cm-3。