- 1.16 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
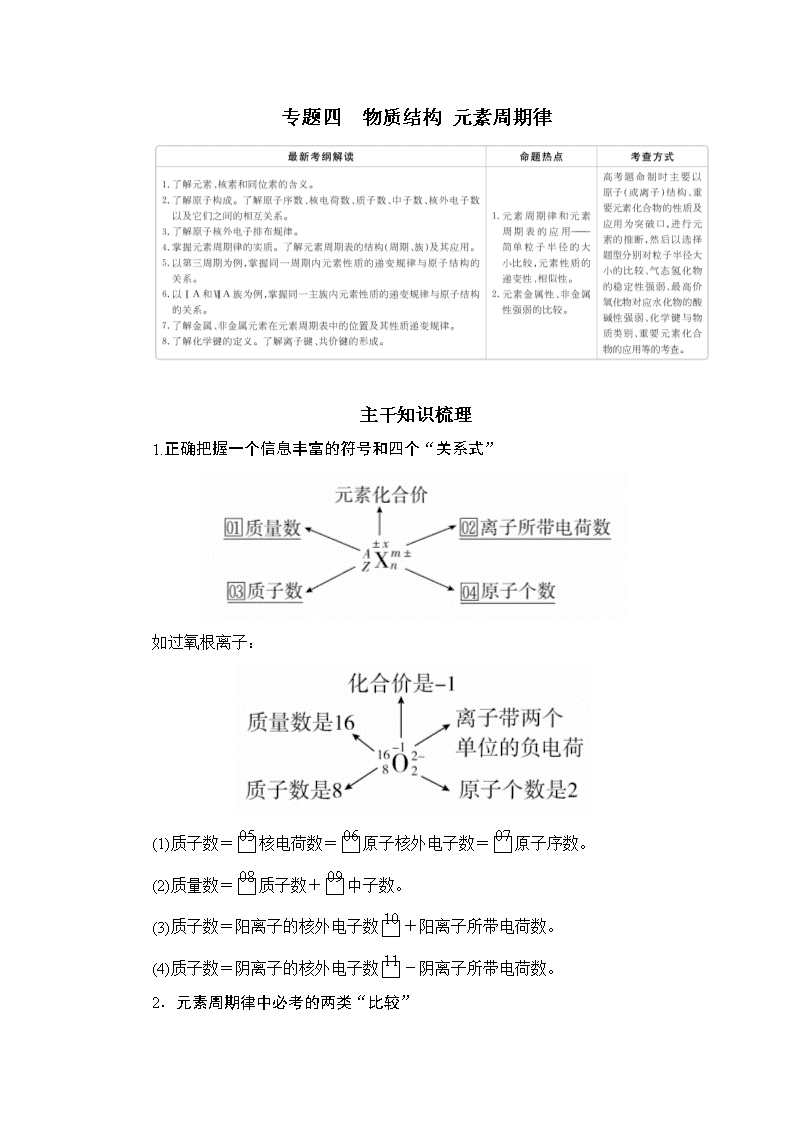
专题四 物质结构 元素周期律
主干知识梳理
1.正确把握一个信息丰富的符号和四个“关系式”
如过氧根离子:
(1)质子数=核电荷数=原子核外电子数=原子序数。
(2)质量数=质子数+中子数。
(3)质子数=阳离子的核外电子数+阳离子所带电荷数。
(4)质子数=阴离子的核外电子数-阴离子所带电荷数。
2.元素周期律中必考的两类“比较”
(1)元素金属性、非金属性强弱的比较
(2)比较粒子半径的大小的方法
①一般地,电子层数越多,半径越大,如HF->Na+>Mg2+>Al3+。
③电子层数和核电荷数相同(即同种元素)的微粒,核外电子数越多,半径越
大,如Fe3+Z>X
C.含Z元素的盐,其水溶液可能显酸性,也可能显碱性
D.X与Y形成的所有化合物中均只含一种化学键
答案 C
解析 X、Y、Z、W原子序数依次增大,Y是同周期主族元素中原子半径最大的,W原子最外层电子数是电子层数的2倍,工业上电解熔融Z2X3制备单质Z,可推出Y是Na,W是S,Z是Al,X是O。氧元素的非金属性强于硫元素,非金属性越强,气态氢化物越稳定,故A错误;电子层结构相同的离子,核电荷数越大,半径越小,所以离子半径是X>Y>Z,故B错误;NaAlO2溶液显碱性,AlCl3溶液显酸性,故C正确;Na2O2中既含离子键又含共价键,故D错误。
考点2 元素周期表 元素周期律
例2 (2019·全国卷Ⅱ)今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:WA>B,C>D>B;金属性C>A>B,C>D>B;非金属性B>A>C,B>D>C。
(2)相似规律
同主族元素性质相似,位于左上和右下对角线位置的元素性质相似,相邻元素性质差别不大。
2.元素金属性、非金属性强弱的比较方法
3.(2019·长郡中学高三月考)下列判断错误的是( )
A.酸性:HClO4>H2SO4>H3PO4
B.熔点:SiO2>NaCl>I2
C.沸点:NH3>PH3>AsH3
D.碱性:NaOH>Mg(OH)2>Al(OH)3
答案 C
解析 C项,沸点:NH3>AsH3>PH3。
4.(2019·河南滑县高三调研)短周期元素A、B、C、D、E在周期表中相对位置如图所示。已知:D原子的原子序数等于其最外层电子数的3倍。
请回答下列问题:
(1)B在周期表中位于第________周期________族。
(2)E2B分子的电子式为________,该分子所含化学键类型是________。
(3)在B、D、E的气态氢化物中,热稳定性最弱的是________(填化学式)。
(4)工业上,制备C单质的化学方程式为__________________________。
(5)在A的氢化物中,能与溴水、酸性KMnO4溶液发生化学反应的有________(填一种物质的结构简式)。
(6)D的单质在氯气中燃烧生成两种产物X和Y,其中X分子中每个原子最外层都达到8电子结构。Y与足量的NaOH溶液反应生成两种盐和水,写出该反应的化学方程式:_____________________________________________。
答案 (1)二 ⅥA
(2) 共价键(或极性共价键)
(3)PH3
(4)2Al2O3(熔融)4Al+3O2↑
(5)CH2===CH2(合理即可)
(6)PCl5+8NaOH===Na3PO4+5NaCl+4H2O
解析 推断D是关键,D位于第三周期,设最外层电子数为a,有2+8+a=3a,a=5,故D为磷元素。依次推知,A为碳元素,B为氧元素,C为铝元素,E为氯元素。
(2)Cl2O是共价化合物,每个原子最外层达到8电子结构。
(3)热稳定性:H2O>H2S,PH3<H2S<HCl,故PH3的热稳定性最弱。
(4)工业上,电解熔融氧化铝制备铝。
(5)C的氢化物有烯烃、烷烃、芳香烃等,其中乙烯等能与溴、酸性高锰酸钾溶液反应。
(6)磷与氯气反应生成三氯化磷和五氯化磷,其中五氯化磷分子中磷原子最外层有10个电子,五氯化磷与水反应生成磷酸和氯化氢,磷酸和氯化氢都能与氢氧化钠反应,生成对应的盐和水。
考点3 元素“位-构-性”的综合推断
例3 (2019·全国卷Ⅰ)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
[批注点拨]
[解析] 形成一条共价键的元素有H、F、Cl,最外层分别有1或7个电子。由于W、X、Y、Z为同一周期的元素,故Z(图中Z只能形成一条共价键)为F或Cl,Z核外最外层电子数是X核外电子数的一半,故X为Si,所以Z只能是Cl;由此可推出形成+1价阳离子的第三周期的元素W为Na,同周期元素中能形成两条共价键后再得一个电子能达稳定结构的第三周期元素是P。NaCl为强酸强碱盐,呈中性,A错误;元素非金属性:Cl>P>Si,B错误;H3PO4是中强酸,C正确;新化合物的电子式为
,P已满足8e-稳定结构,D错误。
[答案] C
1.由题给特征信息推断元素的基本思路
2.(1)元素周期表中短周期的特殊结构
如:①元素周期表中第一周期只有两种元素H和He,H元素所在的第ⅠA族左侧无元素分布;
②He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有元素分布。
利用这个关系可以确定元素所在的周期和族。
如:已知X、Y、Z、W四种短周期元素的位置关系如图:
则可以推出X为He,再依次推知Y为F、Z为O、W为P。
(2)元素及其化合物的特性
①形成化合物种类最多的元素或对应单质是自然界中硬度最大的物质的元素:C。
②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
③地壳中含量最多的元素或简单氢化物在通常情况下呈液态的元素:O。
④地壳中含量最多的金属元素:Al。
⑤最活泼的非金属元素或无氧酸可腐蚀玻璃的元素或气态氢化物最稳定的元素或阴离子的还原性最弱的元素:F。
⑥焰色反应呈黄色的元素:Na。焰色反应呈紫色(透过蓝色钴玻璃观察)的元素:K。
⑦单质密度最小的元素:H。单质密度最小的金属元素:Li。
⑧常温下单质呈液态的非金属元素:Br。常温下单质呈液态的金属元素:Hg。
⑨最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的短周期元素:Be、Al。
⑩元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素:N。
⑪单质为常见的半导体材料:Si、Ge。
⑫元素的气态氢化物能和它的氧化物在常温下反应生成该元素的单质的元素:S。
⑬元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
5.(2019·绵阳市高三第二次诊断性考试)W、X、Y和Z为原子序数依次增大的四种短周期主族元素。W为空气中含量最多的元素,短周期元素中X的原子半径最大,Y的周期数等于其族序数,Z的最外层电子数是最内层电子数的3倍。下列叙述错误的是( )
A.W、X、Y的最高价氧化物的水化物可两两反应生成盐和水
B.W、X、Z均可形成两种或两种以上的氧化物
C.简单离子的半径:Y<X<W<Z
D.含Y元素的盐溶液一定呈酸性
答案 D
解析 W、X、Y和Z为原子序数依次增大的四种短周期主族元素,W为空气中含量最多的元素,W为N元素;Z的最外层电子数是最内层电子数的3倍,其最外层有6个电子,为S元素;Y的周期数等于其族序数,原子序数大于W而小于Z,为Al元素;短周期元素中X的原子半径最大,则X为Na元素。W、X、Y分别是N、Na、Al元素,其最高价氧化物的水化物是硝酸、氢氧化钠、氢氧化铝,这三种化合物都能两两相互反应生成盐和水,A正确;W、X、Z分别是N、Na、S元素,N可以形成NO、NO2、N2O5等氧化物,Na可以形成Na2O、Na2O2,S可以形成SO2、SO3
,B正确;离子核外电子层数越多,离子半径越大,对于电子层结构相同的离子,离子半径随着原子序数增大而减小,W、X、Y、Z离子核外电子层数分别是2、2、2、3,且原子序数W<X<Y,所以简单离子半径Y<X<W<Z,C正确;含有Y的盐溶液可能呈酸性,如AlCl3等,可能呈碱性,如NaAlO2溶液,D错误。
6.(2019·A10联考段考)元素周期表中前20号部分元素,其相关信息如下表所示,回答下列问题:
元素
信息
W
其单质是密度最小的气体
X
其单质性质稳定,可通过分离液态空气法制备
Y
其一种单质可吸收紫外线,是地球的保护伞
Z
其中间层电子数是最内层和最外层电子数之和的两倍
M
与Z同主族,若人体缺乏此元素会导致骨质疏松症
(1)X2W4的电子式为________,其水溶液显弱碱性,则与足量的盐酸反应生成的盐化学式为________。
(2)用X的最高价氧化物的水化物稀溶液可以除去Au中的杂质Cu,其化学方程式为____________________。
(3)能证明M的金属性强于Z的实验事实是_______________________。
(4)在稀硫酸中,Cu2S与W2Y2反应可以得到蓝色溶液,且反应后的溶液中硫元素只有最高价,该反应的离子方程式为____________________;反应后可能会产生大量无色无味气体,其原因是________________。
答案 (1)HN,··N,··H N2H6Cl2
(2)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)Ca与水反应比Mg与水反应剧烈或Ca和Mg与同浓度的稀盐酸反应,Ca更加剧烈(答案合理即可)
(4)2H++Cu2S+5H2O2===2Cu2++SO+6H2O
Cu2+催化分解过量的H2O2产生了大量氧气(答案合理即可)
解析 H2是密度最小的气体,则W是H;N2的性质稳定,可通过分离液态空气法制备,则X是N;O3可吸收紫外线,是地球的保护伞,则Y是O;人体缺乏Ca时会导致骨质疏松,则M为Ca;与Ca同主族的前20号元素中,中间层电子数是最内层和最外层电子数之和的两倍的元素为镁,则Z为Mg。
(1)N2H4
中,每个N形成3个共用电子对,每个H形成1个共用电子对,可以推写出其电子式。
(3)金属性强弱的判断依据有:①金属单质与水或酸反应置换出H2的难易程度;②最高价氧化物的水化物的碱性强弱;③金属单质的还原性强弱。依此可知,金属性钙强于镁则有:Ca与水反应比Mg与水反应更剧烈,Ca(OH)2的碱性强于Mg(OH)2,还原性Ca强于镁等。
(4)H2O2不稳定,遇催化剂或受热分解速率加快。Cu2+、Fe3+等均可作H2O2分解的催化剂。
1.(2019·北京高考)2019年是元素周期表发表150周年。期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素
B.In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
答案 D
解析 由铟(49In)的原子结构示意图可推断In是第五周期第ⅢA族元素,A正确;In的中子数为115-49=66,电子数为49,因此In的中子数与电子数的差值为17,B正确;铟和铝同属于ⅢA族元素,前者位于第五周期,后者位于第三周期,因此原子半径:In>Al,C正确;铟和铷同属于第五周期元素,前者位于ⅢA族,后者位于ⅠA族,根据同周期主族元素最高价氧化物的水化物的碱性递变规律得:碱性In(OH)3<RbOH,D错误。
2.(2019·全国卷Ⅲ)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
答案 B
解析 X、Y、Z均为短周期主族元素,X与Z同族,Y最外层电子数等于X次外层电子数,Y的最外层电子数不可能是8,只能为2,且Y原子半径大于Z,所以Y为Mg,X、Y、Z原子的最外层电子数之和为10,故X为C,Z为Si。MgO的熔点高于CO2、CO的熔点,A错误;元素的非金属性越强,则其气态氢化物的热稳定性越强,C的非金属性强于Si,故CH4的热稳定性大于SiH4,B正确;X与Z形成的SiC是共价化合物,C错误;Mg能溶于浓硝酸,但是Si单质不能溶于浓硝酸,D错误。
3.(2018·全国卷Ⅰ)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
答案 B
解析 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃,生成物是HF,因此W是F,W与Y同族,则Y是Cl。W、X、Z的最外层电子数之和为10,则X、Z应分别是Mg、K或Na、Ca,金属钠或镁常温常压下是固态,A错误;CaH2或KH中含有离子键,属于离子化合物,B正确;Y与Z形成的化合物是氯化钾或氯化钙,其水溶液都呈中性,C错误;F是最活泼的非金属元素,没有正价,Cl元素的最高价是+7价,D错误。
4.(2018·全国卷Ⅱ)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
答案 A
解析 根据分析可知W、X、Y和Z分别是N、O、Na、Cl。氧元素与N、Na、Cl三种元素均可形成两种或两种以上的二元化合物,例如NO、NO2、Na2O、Na2O2、Cl2O7、ClO2
等,A正确;过氧化钠中含有离子键和共价键,B错误;N、O、Na三种元素的简单离子具有相同的电子层结构,均是10电子微粒,氯离子是18电子微粒,C错误;亚硝酸为弱酸,D错误。
5.(2018·全国卷Ⅲ)W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是( )
A.原子半径大小为WW
C.化合物熔点:Y2X3NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图中所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
答案 C
解析 气态氢化物稳定性与非金属性一致,非金属性O>N>Si,所以气态氢化物稳定性H2O>NH3>SiH4,A正确;氢元素可与非金属元素形成共价化合物(如H2O)和离子化合物(如NH4H),也可以与某些金属形成离子化合物(如NaH),B正确;该实验只能证明酸性:HCl>H2CO3>H2SiO3,由于HCl是无氧酸,不能用于元素非金属性强弱的比较,C错误;根据元素周期表知识判断,D正确。
11.(2016·全国卷Ⅰ)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小WX>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
答案 C
解析 根据题意可知,W、X、Y、Z分别为H、C、O、Cl。根据原子半径的变化规律,可知原子半径:HC,再由CCl4、ClO2中化合价的正负,可知非金属性:O>Cl>C,B错误;氧的氢化物可能为H2O或H2O2,常温常压下二者均为液态,C正确;碳的最高价氧化物的水化物H2CO3为弱酸,D错误。
2020还可能这么考
12.短周期主族元素X、Y、Z、W的原子半径依次增大,其中Y、Z元素原子序数相差8,Y单质能与Z元素的氧化物在一定条件下发生置换反应,Y元素最高价氧化物能与W元素的某种含氧化合物发生氧化还原反应生成X单质。下列说法正确的是( )
A.简单离子半径:W>X
B.简单氢化物的沸点:X>Z
C.元素X和W能形成的化合物均只含离子键
D.Z元素最高价氧化物对应水化物的酸性比Y的强
答案 B
解析 由题意可知,X为O元素,Y为C元素,Z为Si元素,W为Na元素。Na+的半径小于O2-的半径,A错误;水分子之间形成氢键,水的沸点高于SiH4的沸点,B正确;Na2O2中有共价键,C错误;H2CO3的酸性比H2SiO3强,D错误。