- 991.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1、已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。
下列说法中正确的是( )
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
2、下列各项比较中前者高于(或大于或强于)后者的是( )
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛()和对羟基苯甲醛()的沸点
D. C-O和Si-O的键能
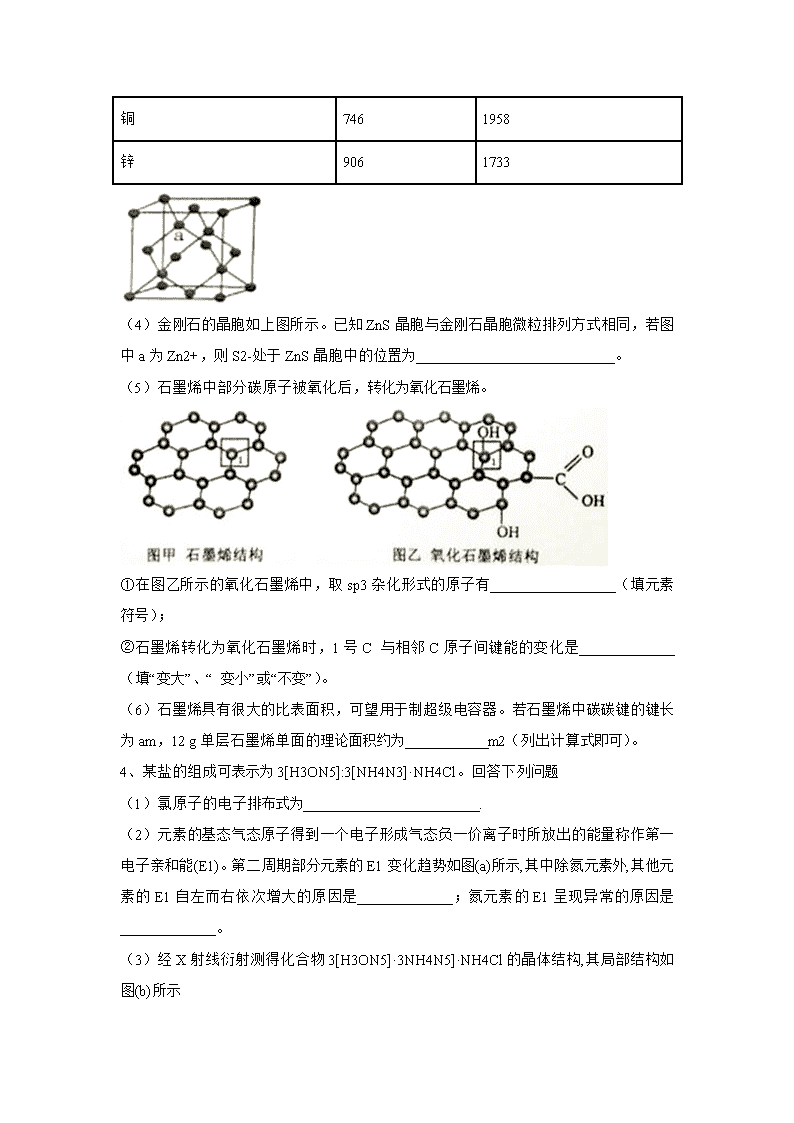
3、石墨、石墨烯及金刚石是碳的同素异形体。
(1) 以Ni—Cr—Fe 为催化剂,一定条件下可将石墨转化为金刚石。基态Fe原子未成对电子数为____________。设石墨晶体中碳碳键的键长为a m,金刚石晶体中碳碳键的键长为bm,则a_____b(填“>”、“<”或“=”),原因是_______________________________。
(2)比较下表碳卤化物的熔点,分析其熔点变化规律的原因是____________。
CCl4
CBr4
CI4
熔点/℃
-22.92
48.4(α型)
168(分解)
(3) 金、铜、锌等金属或合金常用作化学气相沉积法获取石墨烯的催化剂。左下表是铜与锌的部分电离能数据,对于“I1铜小于锌,而I2铜却大于锌”的事实,原因是_________________。
电离能/kJ·mol-1
I1
I2
铜
746
1958
锌
906
1733
(4)金刚石的晶胞如上图所示。已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为___________________________。
(5)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯。
①在图乙所示的氧化石墨烯中,取sp3杂化形式的原子有_________________(填元素符号);
②石墨烯转化为氧化石墨烯时,1号C 与相邻C原子间键能的变化是_____________(填“变大”、“ 变小”或“不变”)。
(6)石墨烯具有很大的比表面积,可望用于制超级电容器。若石墨烯中碳碳键的键长为am,12 g单层石墨烯单面的理论面积约为___________m2(列出计算式即可)。
4、某盐的组成可表示为3[H3ON5]:3[NH4N3]·NH4Cl。回答下列问题
(1)氯原子的电子排布式为________________________.
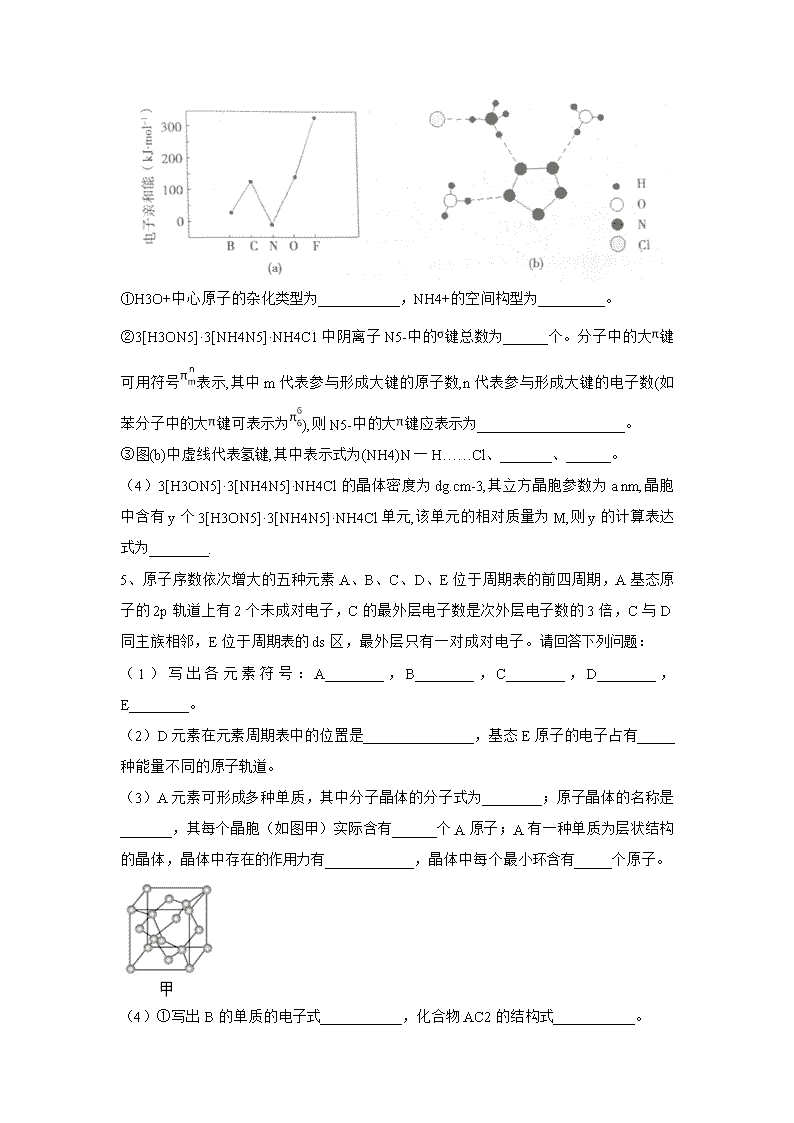
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_____________;氮元素的E1呈现异常的原因是_____________。
(3)经X射线衍射测得化合物3[H3ON5]·3NH4N5]·NH4Cl的晶体结构,其局部结构如图(b)所示
①H3O+中心原子的杂化类型为___________,NH4+的空间构型为_________。
②3[H3ON5]·3[NH4N5]·NH4C1中阴离子N5-中的键总数为______个。分子中的大键可用符号表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大键可表示为),则N5-中的大键应表示为____________________。
③图(b)中虚线代表氢键,其中表示式为(NH4)N一H……Cl、_______、______。
(4)3[H3ON5]·3[NH4N5]·NH4Cl的晶体密度为dg.cm-3,其立方晶胞参数为a nm,晶胞中含有y个3[H3ON5]·3[NH4N5]·NH4Cl单元,该单元的相对质量为M,则y的计算表达式为________.
5、原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,A基态原子的2p轨道上有2个未成对电子,C的最外层电子数是次外层电子数的3倍,C与D同主族相邻,E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)写出各元素符号:A________,B________,C________,D________,E________。
(2)D元素在元素周期表中的位置是_______________,基态E原子的电子占有_____种能量不同的原子轨道。
(3)A元素可形成多种单质,其中分子晶体的分子式为________;原子晶体的名称是_______,其每个晶胞(如图甲)实际含有______个A原子;A有一种单质为层状结构的晶体,晶体中存在的作用力有____________,晶体中每个最小环含有_____个原子。
(4)①写出B的单质的电子式___________,化合物AC2的结构式___________。
②用KMnO4酸性溶液吸收DC2气体时,MnO4﹣被还原为Mn2+,该反应的离子方程式为________________________________________________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图乙所示,X的化学式为______,D离子的配位数为______;若晶胞边长为a cm,则晶体X的密度计算式为ρ=______________g?cm-3(用a和NA的代数式表示)。
6、CO 易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5; [Cu(NH3)2]Ac 溶液用于除去CO的化学反应方程式:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3] Ac·CO (式中Ac-代表醋酸根)。请回答下列问题:
(1)C、N、O的第一电离能最大的是_____________,原因是___________________________。基态Fe 原子的价电子排布图为___________________________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_____________,羰基铁的结构如图,根据该图可知CO作为配位体是以__________原子为配位原子与Fe原子结合。
(3)离子水化能是气态离子溶于大量水中成为无限稀释溶液时释放的能量。离子在溶液中的稳定性可以从离子的大小、电荷、水化能等因素来解释。Cu2+和Cu+的水化能分别是-2121kJ·mol-1和-582 kJ·mol-1,在水溶液里Cu2+比Cu+稳定的原因是_______________________________。[Cu(NH3)2]+在水溶液中相对稳定,在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是________________________________。
(4)用[Cu(NH3)2]Ac除去CO的反应中,肯定有形成________________。
a.离子键 b.配位键 c.非极性键 d. σ键
(5)钙铜合金的晶体结构可看成(a) (b) 两种原子层交替堆积排列而成图(c),则该合金六方晶胞(即平行六面体晶胞)中含为Cu________个。已知同层的Ca-Cu的距离为294pm,根据图示求同层相邻Ca-Ca的距离__________pm (已知=1.73 计算结果保留整数)。
7、H、C、N、O、F、Ca是六种重要的元素请根据所学的物质结构与性质的4机关知识下列问题:
(1)基态碳原子的电子排布式为__,O和F形成的化合物中原子价层都满足8电子结构的结构式是__,O元素的化合价为________.
(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于__(填“吸收”或“发射”)光谱。
(3)某药物的结构简式为,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
(4)CO2属于_____(填“极性”或”非极性”)分子。CO32-的空间构型为_____,与其互为等电子体的分子和离子分别为_________(各写一种)。
8、Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物
Al元素及其化合物
电离能/(KJ/mol)
Mg:I1=738.14,I2=1451,I3=7733
Al:I1=578,I2=1817,I3=2745
熔点/℃
MgCl2:714
AlCl3:190(2.5×105Pa)
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。
9、现有①SO2②SO3③SO32-④SO42-四种粒子,回答下列问题:
(1)其中中心原子S的杂化方式为sp2的是__(填序号,下同);中心原子S的杂化方式为sp3的是_________.
(2)SO2在水中的溶解度比较大,原因是_____________。
(3)下列对H2SO3和H2SO4的说法正确的是_____(填字母)。
A.H2SO4比H2SO3易电离出H+是因为H2SO4分子中的非羟基氧多
B.H2SO4比H2SO3易电离出H+是因为H2SO4分子中中心原子S的孤电子对少
C.在H2SO4溶液中存在的粒子的空间构型有V形和正四面体形
(4)若丁二烯CH2=CH-CH=CH2中除含σ键外,还含有一个Π44键(Πmn键表示n个原子、m个电子组成的大п键),SO2含有大п键,可表示为___________。
10、短周期的7种元素A、B、C、D、E、F、G的原子序数依次增大,其中A原子中的电子只有1种运动状态,且与B同主族,C的基态原子2p能级上只有1个电子,F与A可形成两种常温下的液态化合物;F与G同主族。根据上述描述,请回答下列问题:
(1)上述7种元素中电负性最小的元素与A元素形成的化合物的电子式为______(用具体元素符号表示电子式),基态原子的一电离能最大的元素是_____(填元素符号)。
(2)1molD3A6链状分子中含有的σ键数为________。
(3)已知A2F2的分子结构如图所示:
①用电离方程式表示呈弱酸性的原因:______________。
②A2F2的沸点比A2F高的原因:_______________。
11、ⅣA族元素及其化合物在材料等方面有重要用途回答下列问题:
(1)碳的一种单质的结构如图所示碳原子的杂化轨道类型为______.
(2)分子的立体构型为______,属于______分子填“极性”或“非极性”.
(3)四卤化硅的沸点和二卤化铅的熔点如图所示.
的沸点依F、Cl、Br、I次序升高的原因是______.
结合的沸点和的熔点的变化规律,可推断:依F、Cl、Br、I次序,中的化学键的离子性______填“增强”“不变”或“减弱”.
(4)碳的另一种单质可以与钾形成低温超导化合物,晶体结构如图所示位于立方体的棱上和立方体的内部,此化合物的化学式为______,其晶胞参数为,晶体密度为______(列计算式).
12、锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:________。与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有________(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为________。
(2)PO的空间构型是________。
(3)与NH3互为等电子体的分子、离子有________、________(各举一例)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为_____。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为______。
13、铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态K原子核外电子排布简写式为___________。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________,各元素的第一电离能由大到小的顺序为_________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为_________。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_____晶体。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。
①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为____(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为_____g·cm-3(用含有r、NA的最简代数式表示)。
14、(1)固体可分为晶体、非晶体和准晶体三大类,可通过________________方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为_______________。
(2)PCl3的立体构型为______________,中心原子的杂化轨道类型_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3
BCl3
BBr3
BI3
沸点/K
172
285
364
483
①四种卤化物沸点依次升高的原因是___________________。
②B、C、N、O三种元素第一电离能由小到大的顺序为___________。
③用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:____________。
(4)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm,其原因是金刚石中只存在C-C间的________共价键,而石墨层内的C-C间存在_________键。
②金刚石晶胞含有___________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,列式表示碳原子在晶胞中的空间占有率__________(不要求计算结果)。
15、Fe、CO、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态CO原子的价电子排布式为____________,Co3+核外3d能级上有_________对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co+ 的配位数是______________,1mol 配离子中所含σ键的数目为_____________,配位体N3-中心原子杂化类型为____________________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是___________________。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________________。
(5)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
16、铜和硫的化合物在化工、医药材料等领域具有广泛的用途。回答下列问题:
(1)原子轨道是指电子在原子核外的___________,基态S原子的原子轨道数是____个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是______,占据该能级的电子数为__________。
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为_______。
(4)下图是含元素Cu、S的有机物的结构简式:
①该有机化合物结构中含有的化学键类型是_______(填“共价键““离子键”或“共价键、离子键”)、配位键,其中1个该有机物分子中配位键数为_____个,
这些配位键中提供孤电子对的元素是__________。
②S原子的杂化方式为_______、带*N原子的杂化方式为_______。
(5)下图是Cu-Au合金的一种立方晶体结构:
已知该合金的密度分dg/cm3,阿伏加德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为______cm(写出计算表达式)。
17、碳、氮、锌的单质及其化合物有广泛的应用。
(1)写出基态碳原子的价电子电子排布图____;1mol葡萄糖分子中含有σ键___个。
(2)Ge和C同主族,性质差异却很大。C原子间可以形成双键、三键,但是Ge原子之间难以形成双健或三键,从结构上分析,原因是______________________________。
(3)金属镍与氨气能形成配合物,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____________________,提供孤电子对的成键原子是_____________________。氨的沸点高于膦(PH3),原因是___________________。
(4)ZnO晶体具有四种晶体结构:闪锌矿结构、氯化钠结构、氯化铯结构、纤锌矿结构(六方结构,氧原子层呈六方紧密排列)
①氧化锌晶体容易发生结构改变的主要因素是____________。
a.电荷因素 b.键性因素 c.几何因素
②闪锌矿结构如图,品胞中Zn2+和O2-的最近距离为__________cm。(设晶胞边长为bmm)
18、亚铁氰化钾(结构式如图所示)属于欧盟批准使用的食品添加剂。亚铁氰化钾不稳定,受热易分解:3K4[Fe(CN)6]12KCN+Fe3C+2(CN)2↑+N2↑+C;K4[Fe(CN)6]+K2CO35KCN+KOCN+Fe+CO2↑。
(1)基态Fe原子的未成对电子数为___________;K4[Fe(CN)6]中Fe2+与CN-的中心原子形成的化学键类型为_________________,提供孤电子对的成键原子是________________。
(2)KOCN中阴离子OCN-的几何构型为__________,中心原子的杂化轨道类型为___________。O、C、N的第一电离能从大到小的顺序为_________________,电负性从大到小的顺序为___________________。
(3)(CN)2的结构式为_______________________。
(4)KCN的晶体结构如图所示,已知晶胞参数a=0.648nm。则K+的配位数为__________,紧邻的两个K+的距离为_____cm,该晶体的密度为______________g·cm-3。
19、磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为a nm 的In 原子有________个。
20、据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,
该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
21、翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(1)基态Cr原子的电子排布式为_______;Fe位于元素周期表的____区。
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为________,其中四种元素第一电离能由小到大的顺序是________。
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?________。
(4)在硅酸盐中存在结构单元,其中Si原子的杂化轨道类型为________。当无限多个(用n表示)分别以3个顶角氧和其他3个形成层状结构时(如图所示),其中Si、O原子的数目之比为________。若其中有一半的Si被Al替换,其化学式为________。
(5)Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为________,若Ca与O的核间距离为x nm,则该晶体的密度为_______g/cm3。
参考答案
1、【答案】C
【解析】 A、用均摊法分析,晶体晶胞中阴、阳离子的个数都为4,故A项错误。
B、阴、阳离子的配位数都是6,故B项错误。
C、该晶胞符合NaCl晶胞的特征,故C项正确。
D、根据氯化钠的晶胞结构图进行计算:设晶胞边长为a cm,则两个距离最近的阳离子的核间距离为a cm,4×M=NA·a3·d,可求出a,进而求得核间距,故D项错误。
综上所述,本题应选C。
2、【答案】D
【解析】
A、金属镁属于六方最密堆积,配位数为12,金属铜属于面心立方最密堆积,配位数为12,两者相同,故A错误;B、BF3中性原子是B,有3个σ键,孤电子对数为(3-3)/2=0,价层电子对数为3,CH4中心原子为C有4个σ键,无孤电子对,价层电子对数为4,前者小于后者,故B错误;C、前者形成分子内氢键,分子内氢键降低物质熔沸点,后者形成分子间氢键,分子间氢键增强物质的熔沸点,前者小于后者,故C错误;D、C的半径小于Si的半径,前者键长比后者短,因此前者的键能强于后者,故D正确。
3、【答案】 4 < 石墨晶体中碳碳键除σ键外还有大Π键,金刚石晶体中碳碳键只有σ键 分子结构相似,随相对分子质量依次增大,分子间作用力依次增强,故CCl4、CBr4、CI4熔点依次升高 Cu失去一个电子成为Cu+后,形成[Ar] 3d10,是能量较低的全充满结构 顶点、面心 C、O 变小 ×NA×
【解析】(1). 基态Fe原子的核外电子排布式为[Ar]3d64s2,未成对电子数为4,在金刚石晶体中,C原子采用sp3杂化,碳原子之间只存在σ键,而石墨晶体中的C原子采用sp2杂化,碳原子之间除了σ键外还有大π键,使得石墨晶体中的碳碳键的键长比金刚石晶体中碳碳键的键长小,故答案为:4;<;石墨晶体中碳碳键除σ键外还有大π键,金刚石晶体中碳碳键只有σ键;
(2). 碳卤化物都是分子晶体,分子间通过范德华力相结合,对于组成和结构相似的分子晶体,相对分子质量越大,范德华力越强,熔点越高,由于相对分子质量CCl4<CBr4<CI4,则熔点CCl4<CBr4<CI4,故答案为:分子结构相似,随相对分子质量依次增大,分子间作用力依次增强,故CCl4、CBr4、CI4熔点依次升高;
(3). 当原子轨道中的电子处于全满、半满或全空时较稳定,气态Cu
原子失去一个电子变成结构为[Ar]3d10的Cu+,是一种能量较低的稳定结构,而气态Zn原子失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,故答案为:Cu失去一个电子成为Cu+后,形成[Ar] 3d10,是能量较低的全充满结构;
(4). 图中a点为Zn2+,由均摊法可知,Zn2+的个数为:4×1=4,根据ZnS的化学式可知,只有S2-处于顶点和面心时,S2-的个数也为:8×1/8+6×1/2=4,故答案为:顶点、面心;
(5). ①. 氧化石墨烯中所标的1号碳原子形成3个碳碳单键和一个碳氧单键,C原子为sp3杂化,氧化石墨烯中羟基上的氧原子形成一个碳氧单键和一个氧氢键,还有2个孤电子对,所以羟基上氧原子为sp3杂化,故答案为:C、O;
②. 石墨烯转化为氧化石墨烯时,1号C 与相邻C原子间的大π键被氧化破坏变成了单键,键能减小,故答案为:变小;
(6). 已知石墨烯中碳碳键的键长为am,则其正六边形的面积为,根据均摊法可以计算出每个六边形所占有的碳原子个数为6×1/3=2,所以12g(即1molC)单层石墨烯实际占有的六边形个数为: ×NA,则单层石墨烯单面的理论面积约为×NA×,故答案为: ×NA×。
4、【答案】 1s22s22p63s23p5 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大 N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子 sp3杂化 正四面体 5 (H3O+)O—H…N(N) (NH)N—H…N(N) (或:×10-21)
【解析】(1)氯原子的核电荷数为17,其电子排布式为1s22s22p63s23p5 ;正确答案:1s22s22p63s23p5。
(2)同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合1个电子释放出的能量依次增大,氮原子的2p轨道为半充满状态,具有稳定性;正确答案:同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大;N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子。
(3)①H3O+中价层电子对个数都是3
且含有一对孤电子对,所以为三角锥形结构,中心原子的杂化类型为sp3杂化,NH4+中价层电子对个数是4且不含孤电子对,其空间构型为正四面体;正确答案:sp3;正四面体。
②如图2所示,3[H3ON5]·3[NH4N5]·NH4C1中阴离子N5-中的键总数为5个,根据已知信息,N5-中参与形成大键的原子数且5,形成大键的电子数为6,所以N5-中的大键表示为;正确答案:5; 。
③图(b)中虚线代表氢键,其中表示式为(NH4)N一H……Cl、(H3O+)O—H…N(N) 、(NH)N—H…N(N) ;正确答案:(H3O+)O—H…N(N) 、(NH)N—H…N(N) 。
(4)晶胞体积V=(a×10-7)3cm3, 晶胞质量为m=y×M/NA,密度为ρ=m/V,所以y=×10-21;正确答案:(或:×10-21)。
5、【答案】 C N O S Zn 第三周期ⅥA族 7 C60 金刚石 8 共价键、范德华力 2 O=C=O 5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+ ZnS 4 388/(NA?a3)
【解析】原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,C的最外层电子数是次外层电子数的3倍,则C的最外层有6个电子,C为O元素,C与D同主族相邻,则D为S元素;A基态原子的2p轨道上有2个未成对电子,而且A的原子序数比O小,所以A为C元素;B的原子序数介于A. C之间,所以B为N元素;E位于周期表的ds区,最外层只有一对成对电子,则E为Zn元素。
(1). 由以上分析可知,A为C元素、B为N元素、C为O元素、D为S元素、E为Zn元素,故答案为:C;N;O;S;Zn;
(2). D为S元素,有三个电子层,最外层有6个电子,所以S元素位于元素周期表的第三周期第VIA族,基态Zn原子的核外电子排布式为:[Ar]3d104s2,占有7种能量不同的原子轨道,故答案为:第三周期VIA族;7;
(3). A是C元素,可以形成金刚石、石墨、C60等多种单质,其中C60为分子晶体,属于原子晶体的是金刚石,由金刚石的晶胞结构示意图可知,C原子分别位于顶点、面和体内,根据“均摊法”有:8×1/8+6×1/2+4=8,则每个晶胞中实际含有8个C原子,碳有一种单质为层状结构的晶体,该晶体为石墨,石墨属于混合型晶体,层内的碳原子之间以共价键相结合,层与层之间以范德华力相结合,晶体中最小的环为6
个碳原子形成的环,每个C原子形成3个共价键,每个C原子为3个环共用,则根据“均摊法”有:6×1/3=2,即晶体中每个最小环含有2个原子,故答案为:C60;金刚石;8;共价键、范德华力;2;
(4). ①. B是N元素,N2中2个N原子之间以3个共用电子对相结合,N2的电子式为:,在CO2分子中,C原子和2个O原子之间分别以2个共用电子对相结合,CO2的结构式为:O=C=O,故答案为:;O=C=O;
②. 用KMnO4酸性溶液吸收SO2气体时,MnO4﹣被还原为Mn2+,则SO2被氧化成SO42﹣,根据得失电子守恒和原子守恒,该反应的离子方程式为:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+,故答案为:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+;
(5). S与Zn形成化合物X的晶胞中,S在晶胞内部,离子数为4,Zn在顶点和面心,Zn的离子数为1/8×8+1/2×6=4,所以X的化学式为ZnS;根据晶胞示意图可知,每个锌离子周围距离最近的有四个硫离子,每个硫离子周围距离最近的有4个锌离子,所以S离子的配位数为4;晶胞边长为a cm,晶胞的质量为4×97NA,所以晶体E的密度为= = 388/(NA?a3),故答案为:ZnS;4;388/(NA?a3)。
6、【答案】 N N的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能 分子晶体 C或碳 Cu2+的半径小且所带电荷多、水化能大 sp3、sp2 bd 5 509或510
【解析】(1)同一周期元素,元素电负性随着原子序数增大而增大,但是N的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能,所以这三种元素第一电离能为:N > O>C;铁原子的3d、4s能级为其价电子,基态铁原子的价电子排布为 3d64s2,排布图为;正确答案:N ;N的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能;。
(2)根据羰基铁的常温下为黄色油状液体,说明沸点低,为分子晶体;根据羰基铁的结构图,可知CO作为配位体是以C原子为配位原子与Fe
原子结合;正确答案:分子晶体;C或碳。
(3)Cu2+和Cu+的水化能分别是-2121kJ·mol-1和-582 kJ·mol-1,水化能越小,放出的热量越多,该离子越稳定,并且Cu2+半径比Cu+小,带电荷多,所以Cu2+比Cu+稳定;在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是sp3、sp2;正确答案:Cu2+的半径小且所带电荷多、水化能大 ;sp3、sp2。
(4)用[Cu(NH3)2]Ac除去CO的反应中,肯定有铜原子与氮原子、碳原子之间形成的配位键且也是σ键生成;正确选项b d。
(5)从图 c 可知, Ca 位于六棱柱的顶点(1/6)和底心(1/2) , 各有 12个和 2个, 即属于这个六棱柱的 Ca 为 3个; Cu 有两种情况, 在底面 (图 a )上,各有 6个(1/2) ,在中间一层(图 b ),内部 6个,边 (对图 c 来说是面上)上有 6个(1/2) ,共有 15个,根据原子个数比关系:N(Ca): N(Cu)=3:15=1:5,所以该合金六方晶胞中含Cu为5个;看图a,Cu位于3个Ca构成正三角形的重心,已知Ca-Cu为294pm,设Ca-Ca的距离为xpm, 根据勾股定理:x2=(x/2)2+(294+294/2)2, x=294√3=509; 正确答案:509。
7、【答案】 1s22s22p2 F-O-F +2 发射 sp2、sp3杂化 能 非极性 平面正三角形 SO3 NO3-或SiO32-
【解析】(1)碳为6号元素,基态碳原子的电子排布式为1s22s22p2;O和F形成的化合物中原子价层都满足8电子结构的结构式是F-O-F,F的非金属性较强,显-1价,则O元素的化合价为+2价;(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于发射光谱;(3) ,中氨基中N原子含有3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;另一个氮原子含有2个σ键,2个键,含有1对孤对电子,杂化轨道数为3,采取sp2杂化;与氨气分子相似,分子之间能形成氢键;(4)CO2原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子,属于非极性分子;C形成3个δ键,孤对电子数为(4+2?3×2)=0,为sp2杂化,立体构型为平面正三角形;CO32-中含一个C原子、三个O原子,带两负电荷,所以电子总数为32,与其互为等电子体的分子和离子分别为SO3、NO3-或SiO32-。
8、【答案】 6 六方最密 Al的价电子结构是3s23p1,失去1个电子之后就是3s2
稳定结构,Mg是3s2稳定结构 MgC12是高子晶体,AlCl3是分子晶体 sp3 (极性)共价键、配位键
【解析】(1)铜是29号元素,电子排布式为[Ar]3d10 4s1,基态Cu2+中电子占有的能级数目是6;(2) ①Mg原子的配位数是12,属于六方最密堆积方式;Al的价电子结构是3s23p1,失去1个电子之后就是3s2稳定结构,Mg是3s2稳定结构,故第一电离能Mg比Al大;②MgC12是高子晶体,AlCl3是分子晶体,熔点MgCl2比AlCl3高;③每个铝原子和四个氯原子形成共价键,采取sp3杂化;Al2Cl6分子中正负电荷中心重合,属于非极性分子,该分子中存在(极性)共价键、配位键;(3)金刚砂(SiC)的晶胞结构如图,则硅原子个数为,碳原子为4个;若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,V=,则Si原子的半径R为。
9、【答案】 ①② ③④ SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大 AC
【解析】(1)①SO2中S原子的价电子对数为=3,所以杂化类型为sp2;②SO3中S原子的价电子对数为=3,所以杂化类型为sp2;③SO32-中S原子的价电子对数为=4,所以杂化类型为sp3;④SO42-中S原子的价电子对数为=4,所以杂化类型为sp3;故①②中心原子S的杂化方式为sp2;③④中心原子S的杂化方式为sp3;(2) SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大;(3)A、同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性,选项A正确;B. 硫酸分子中的非羟基氧原子数比亚硫酸多,硫酸中心原子硫价态高,易于电离出H+,而不是中心原子的孤电子对的原因,选项B错误;C、在H2SO4溶液中存在的粒子的空间构型有水为V形和硫酸根离子为正四面体形,选项C
正确。答案选AC;(4) SO2中有3个原子,4个电子形成大п键,可表示为。
10、【答案】 N 8NA(或4.816×1024或8×6.02×1023) H2O2HO2-+H+ 因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高
【解析】短周期的7种元素A、B、C、D、E、F、G的原子序数依次增大,其中A原子中的电子只有1种运动状态,则为氢元素,且与B同主族,则B为锂元素,C的基态原子2p能级上只有1个电子,则C为硼元素,F与A可形成两种常温下的液态化合物水和双氧水,则F为氧元素;F与G同主族,则G为硫元素。D、E处于C、F之间,只能分别为碳元素和氮元素。(1)元素非金属性越弱电解性越弱,上述7种元素中电负性最小的元素为锂元素,与A元素形成的化合物氢化锂的电子式为,同周期元素从左到右第一电离能逐渐增大,N元素的2p轨道上为半满稳定结构,第一电离能反常增大,故基态原子的第一电离能最大的元素是N;(2) C3H6链状分子为丙烯分子,每个分子中含有8个σ键和1个键,1molC3H6链状分子中含有的σ键数为8NA;(3) ①H2O2不完全电离产生氢离子使溶液呈弱酸性H2O2HO2-+H+;②因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高。
11、【答案】 sp2 正四面体 非极性 属于分子晶体,相对分子质量越大,沸点越高 减弱
【解析】(1)碳的一种单质的结构如图(a)所示,应为石墨,在石墨晶体中,同层的每一个碳原子以与相邻的三个碳原子以σ键结合,采用sp2杂化,故答案为:sp2;
(2)SiCl4分子的中心原子为Si,形成4个σ键,价层电子对数为4,具有正四面体结构,属于非极性分子,故答案为:正四面体;非极性;
(3)①四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关,相对分子质量越大,沸点越高,故答案为:SiX4属于分子晶体,相对分子质量越大,沸点越高;
②PbX2的沸点逐渐降低,其中PbF2为离子晶体,PbBr2、PbI2为分子晶体,可知依F、Cl、Br、I次序,PbX2中的化学键的离子性减弱、共价性增强,故答案为:减弱;
(4)K位于棱和体心,晶胞中的个数为12×+9=12,C60位于顶点和面心,个数为8×+6×=4,化学式为K3C60,则晶胞的质量为g,其晶胞参数为1.4nm=1.4×10-7cm,则体积为(1.4×10-7)3cm3,所以密度为,故答案为:K3C60;。
12、【答案】 [Ar]3d9 K Cr OC>Fe>K 3:4 sp 分子 8
【解析】(1)钾(K)为19号元素,原子核外共有19个电子,由于3p和4s轨道能级交错,第19个电子填入4s轨道而不填入3p轨道,基态K原子核外电子排布式为1s22s22p63s23p64s1简写为:[Ar]4s1;Fe原子的基态电子排布式为:1s22s22p63s23p63d64s2,
C原子的基态电子排布式为:1s22s22p2,N原子的基态电子排布式为:1s22s22p3,则K、Fe、C、N基态原子核外未成对电子数依次为:1、4、2、3,所以K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是Fe(铁)。第一电离能是原子失去最外层的一个电子所需能量,第一电离能主要体现的是元素失电子的能力,C、N为非金属元素都较难失电子,C、N同周期,N原子序数大于C,且N最外层2p能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素;K、Fe是金属元素都较易失电子,且K比Fe活泼,故K的第一电离能小于Fe的第一电离能,综上分析,各元素的第一电离能由大到小的顺序为:N>C>Fe>K。
(2)(CN)2分子中存在碳碳键,结构式为NC-CN,共价单键是σ键,共价三键中含有2个π键1个σ键,则分子中σ键与π键数目之比为3:4。HCN的结构式为H-CN,所以碳为中心原子,形成4个共价键,没有孤电子对,碳的价层电子对为2,sp杂化。
(3)Fe(CO)5的熔点为253K,沸点为376K,熔沸点比较低,属于分子晶体。
(4)①铁的a堆积方式为体心立方堆积,与一个铁原子最近的铁原子距离为立方体边长的,这样的原子有八个,所以铁的配位数为8;如图所示:,晶胞中铁原子数为:8×+1×=2,体心立方晶胞中r= ,所以铁原子总体积=2×=2×= ,晶胞体积=a3,则该晶体中原子总体积占晶体体积的比值为。
②②铝的b堆积方式为面心立方堆积,晶胞中含有Al原子数为:8×+6×=4,则晶胞质量为: g;该晶胞结构侧面可用如图表示:,铝原子半径rpm=r×10-10cm,设晶胞边长为acm,晶胞边长a与铝原子的半径为r的关系为:
2a2=(4r×10-10)2,解得a=r×10-10,所以晶胞体积为:(r×10-10)3cm3,根据密度=质量÷体积,则晶体密度为: g÷(r×10-10)3cm3=g·cm-3。
14、【答案】 X-射线衍射 [Ar]3d54s2 三角锥形 sp3 分子结构相似,相对分子质量增大,分子间作用力逐渐增强 BS>Se 共价键 2 N、O sp3 sp2
【解析】(1)原子轨道是指电子在原子核外的空间运动的主要区域,基态S原子的电子排布式为1s22s22p63s23p4,s轨道只有1个轨道、p轨道有3个轨道,所以其原子轨道数是9个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是4s,占据该能级的电子数为1。
(3)Cl、S、Se在元素周期表中处于相邻的位置,Cl和S同周期、S和Se同主族,其非金属性由强到弱的顺序为Cl>S>Se,其第一电离能的大小顺序为Cl>S>Se。
(4)①该有机化合物结构中含有的化学键类型是共价键、配位键,该有机物分子中Cu原子与3个N原子和1个O原子成键,根据N和O的原子结构及其成键情况,可以判断 1个该有机物分子中配位键的数目为2个,这些配位键中提供孤电子对的元素是N、O。
②该有机物分子中S原子只形成了2个σ键,故S原子的杂化方式为sp3;带*N原子共形成3个σ键和1个π键,故其杂化方式为sp2。
(5)由Cu-Au合金的晶体结构可知,其晶胞中Cu、Au原子分别位于晶胞的面心和顶点,所以晶胞中Cu、Au原子数分别为3和1。已知该合金的密度分dg/cm3,阿伏加德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),设Cu原子的半径为x
、晶胞的边长为a,则,a=pm。NA个晶胞的质量和体积分别为389g和,所以,则铜原子的半径为cm。
17、【答案】 23NA Ge原子半径大,难以形成稳定的π键,不易形成双键或三键 配位键 N 氨分子间形成氢键 b ×b×10-1
【解析】(1)C原子的原子序数为6,基态C原子的价电子电子排布图为:,葡萄糖分子的结构式为:,1mol葡萄糖分子中含有23NA个σ键,答案为:、23NA
(2)Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;答案为:Ge原子半径大,难以形成稳定的π键,不易形成双键或三键
(3)[Ni(NH3)6]2+中Ni2+与NH3之间以配位键相结合,形成的化学键称为配位键,NH3的孤对电子占据Ni2+的空轨道,因此提供孤电子对的成键原子是N,NH3分子间存在氢键,分子间有氢键的物质熔化或气化时,除了要克服纯粹的分子间力外,还必须额外地供应一份能量来破坏分子间的氢键,导致氨的沸点高于膦(PH3)。答案为:配位键 、 N 、氨分子间形成氢键
(4)①ZnO晶体中的化学键既有离子键的成分,又有共价键的成分,两种成分的含量差不多,因而使得ZnO晶体中的化学键没有离子晶体那么强,导致其在一定的外界条件下更容易发生晶体结构上的改变。②求晶胞中Zn2+和O2-的最近距离,根据结构图,就是要求一个正四面体的顶点到中心的距离,也就是下图当中AG的距离,ABCD是锌,G是氧。
设棱CD的长如果是p,那么AH=p, AG:GH=3:1,中心把正四面体的高分成3:1的两份。从晶胞来看,面心立方堆积面上的对角线是关键。所以,CD×2=对角线长= ×晶胞边长,因此,CD=p= b,b是晶胞边长。Zn2+和O2-的距离是AG = AH = × p = p= × b = bmm= bcm答案为: b、 b
18、【答案】 4 配位键(填“共价键”不得分) C 直线形 sp N>O>C O>N>C NC-CN 6 4.58×10-8 1.587
【解析】(1)铁为26号元素,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2,3d中有4个未成对电子;K4[Fe(CN)6]中Fe2+与CN-的中心原子形成的化学键为配位键,提供孤电子对的成键原子是C,故答案为:4; 配位键;C;
(2)KOCN中阴离子OCN-与CO2为等电子体,结构相似,几何构型为直线形,中心原子的杂化轨道类型为sp杂化;同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,O、C、N的第一电离能从大到小的顺序为N>O>C,元素的非金属性越强,电负性数值越大,电负性从大到小的顺序为O>N>C,故答案为:直线形;sp;N>O>C;O>N>C;
(3) 氰分子为直线型,因C形成4个化学键、N形成3个化学键,则其结构式为N≡C-C≡N,故答案为:N≡C-C≡N;
(4)KCN的晶胞中含K+数为12×+1=4,CN-数8×+6×=4,晶体中K+周围最靠近的CN-数6,即晶体中K+的配位数为6;紧邻的两个K+的距离为面对角线的一半=0.648nm×=4.58×10-8 cm;晶胞的体积为a3=(0.648×10-7)3cm3,NA个晶胞的质量为4×(39+12+14)g=4×65g,则KCN 晶体的密度为g/cm3= =1.587 g/cm3,故答案为:6;4.58×10-8;1.587。
19、【答案】 磷的3P轨道处于半充满状态,较稳定 sp3 正四面体 NH3 分子间可以形成氢键,PH3不能 N 的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键 4 12
【解析】(1)P为15号元素,P的核外电子排布式为1s22s22p63s23p3,则其价电子排布式为3s23p3,所以基态磷原子价电子轨道表示式为,磷原子最外层能级中,3p电子处于半满状态,相对比较稳定,失电子较难。答案为: 、磷的3P轨道处于半充满状态,较稳定
(2)P2H4分子中磷原子可以形成3个σ键,还有1对孤对电子,所以磷原子杂化类型是sp3杂化;在白磷中,磷原子的5个价电子中的3个形成了3个σ键,还剩下1个未成键价电子对,其非π键价层电子对总数是4,需要形成4个杂化轨道而采用sp3杂化,所以白磷分子是正四面体形结构。答案为:sp3 、正四面体
(3)①NH3和PH3为分子晶体,随着相对分子质量的增大,分子间作用力逐渐增大,熔沸点逐渐升高,但是NH3分子间可以形成氢键,PH3不能,故NH3的沸点比PH3高;N的电负性大于P,NH3中N-H键的键长比PH3中P-H键的键长要短,所以在NH3中成键电子对更靠近N,排斥力更大,以致键角更大. ②P原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,所以难以形成π键。故答案为:
①NH3 分子间可以形成氢键,PH3不能 、N 的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 ②磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键
(4)根据晶胞图可知磷化铟晶胞中:In原子数目为8×+6×=4,P原子数目为4,所以In的配位数为4;由于晶胞的边长为a nm,设晶胞中在一个平面上处于对角线上的In原子间距离为x nm,则x2=a2+ a2,所以x=a nm ,因此与In原子间距离为anm的In原子有几个,也就是In原子周围与In原子处于对角线中心的In原子有几个,根据晶胞结构图可知有12个。答案为:4、 12
20、【答案】 p 5s25p4 6 球形 O>Cl>C 平面三角形 sp2、sp3 l3NA(或13×6.02×1023) H2O BC 8
【解析】(1)Te与O是同一主族元素,属于元素周期表中p区元素,Te为第5周期第ⅥA族元素,其基态原子的价电子排布式为5s25p4,故答案为:p;5s25p4;
(2)基态Na原子的电子排布式为1s22s22p63s1,核外电子占据的原子轨道总数为6,最高能层电子为3s,电子云轮廓图为球形,故答案为:6;球形;
(3)元素的非金属性越强,氧气与氯化氢能够反应生成氯气和水,氧元素的非金属性最强,电负性数值越大,C、O、Cl的电负性由大到小的顺序为O>Cl>C,故答案为:O>Cl>C;
(4)CO32-中C的价层电子对数=3+×(4+2-3×2)=3,几何构型为平面三角形;根据碳酸丙烯酯的结构简式,则其中碳原子有2种,不饱和的碳氧双键中的C原子采用sp2杂化,饱和的碳原子采用sp3杂化;1mol碳酸丙烯酯中含有6molC-H,4molC-O,2molC-C和1molC=O,共13mol,键的数目为13×6.02×1023,故答案为:平面三角形;sp2、sp3;13×6.02×1023;
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是H2O,该配离子包含的作用力有H-O极性键、配位键,故答案为:BC;
(6)晶胞中Na+离子数目为8,O2-离子数目为8×+6×=4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可知,每个Na+离子周围有4个O2-离子,Na+
离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,则O的配位数为8;晶胞质量为g,该晶胞的密度为ρg?cm-3,而晶胞体积为g÷ρg?cm-3=cm3,晶胞棱长为cm,则Na与O之间的最短距离为立方体对角线的=×cm,故答案为:8; ×。
21、【答案】 [Ar] 3d54s1 d区 Na2O·Al2O3·4SiO2 Na<Al<Si<O Fe的核电荷数较大,核对电子的引力较大,故Fe的原子半径小于Ca,Fe的金属键强于Ca sp3 2︰5 CaCrO3
【解析】(l) Cr为24号元素,根据核外电子排布规律基态Cr原子的电子排布式为[Ar] 3d54s1,Fe为26号元素,位于第三周期第VIII族,也就是元素周期表的d区。答案为:[Ar] 3d54s1 、d区
(2)硅酸铝钠中Na为+1价, Al为+3价, Si为+4价,O为-2价,所以表示为氧化物的化学式为Na2O·Al2O3·4SiO2;非金属性越强第一电离能越大,同一周期的元素自左向右第一电离能增大,因此Na、 Al、 Si、O 四种元素第一电离能由小到大的顺序是Na<Al<Si<O 。答案为:Na2O·Al2O3·4SiO2 、Na<Al<Si<O
(3)钙和铁处于同一周期,但铁的核电荷数大于钙,对最外层电子的吸引能力强,使最外层电子越靠近原子核,导致铁的原子半径小于钙,因此金属键强于钙,所以铁的熔沸点远大于钙。答案为:Fe的核电荷数较大,核对电子的引力较大,故Fe的原子半径小于Ca,Fe的金属键强于Ca
(4) 在硅酸盐中,硅酸根(SiO44-)为正四面体结构,每个Si与周围4个O形成4个σ键,Si无孤电子对,所以中心原子Si原子采取了sp3杂化方式;每个四面体通过三个氧原子与其他四面体连接形成层状结构,因而每个四面体中硅原子数是1,氧原子数=1+3×=,即Si与O的原子个数比为2:5,化学式为(Si2nO5n)2n-,若其中一半的Si被Al替换,其化学式为答案为:2:5、
(5) 根据晶胞结构图和均摊法可知,晶胞中O原子数为×6=3,Ca原子数为×8=1,Cr原子数为1,则化学式为CaCrO3;设晶胞的边长为acm,由于Ca与O的核间距离为xnm,则2a2=4x2,所以a=cm, CaCrO3的式量为:140,因此一个晶胞的质量m= g,而晶胞的体积V=cm3,所以该晶体的密度ρ=== g/cm3,答案为: CaCrO3、