- 1.11 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020 年广州市天河区高三(三模) 化学卷
可能用到的相对原子质量:H-1 N-14 O-16 Na-23 Mg-24 Cl-35.5 V-51
7.化学与生产、生活密切相关。下列有关说法正确的是
A.燃煤中加入生石灰可以有效减少碳排放
B.月饼包装盒内小袋铁粉主要作用为脱氧剂
C.热的纯碱溶液可用于洗涤煤油、柴油等油污
D.淀粉和纤维素在人体内最终水解为葡萄糖,为生命活动提供能量
8. Weiss 利用光敏剂 QD 制备 2-环已基苯乙烯(c)的过程如图。下列说法不正确的是
A. a 的二氯代物有 3 种 B.1mol b 完全燃烧消耗 10mol O2
C.c 具有顺式和反式 2 种结构 D.a、b、c 均能使溴水和稀高锰酸钾溶液褪色
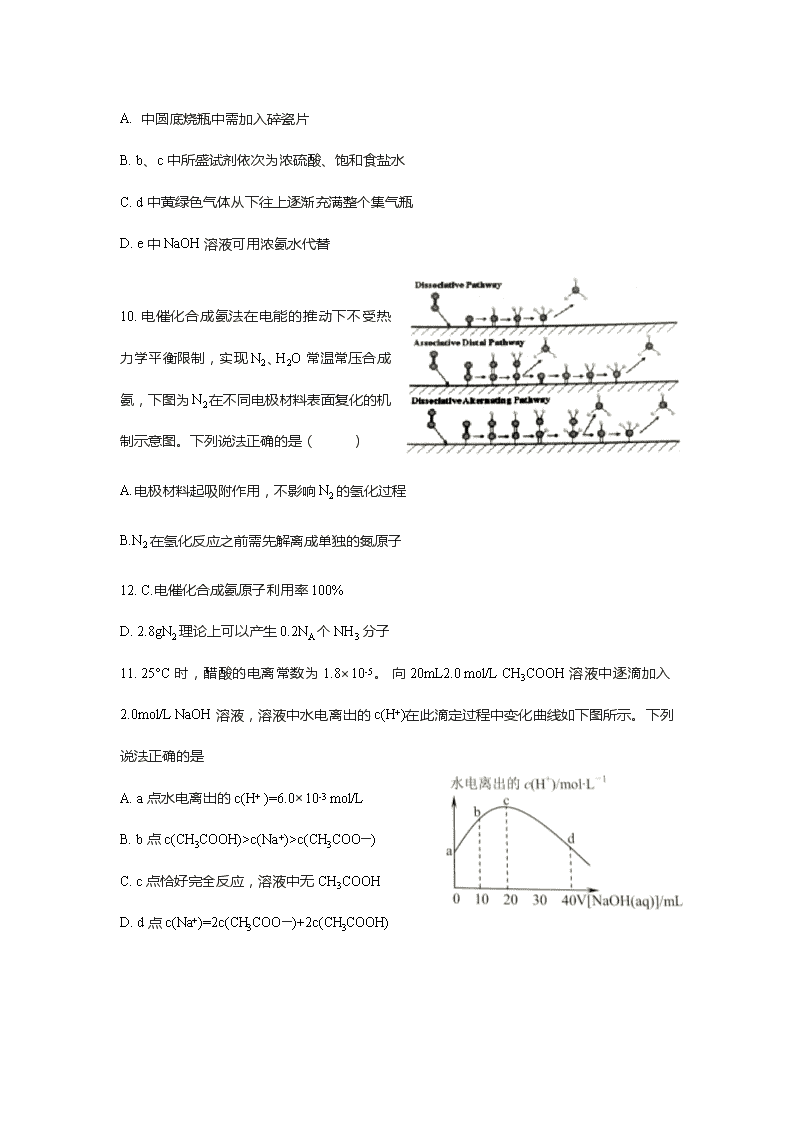
9.实验室制备一瓶纯净氯^气的反应装置如下图所示。关于实验操作或;叙述正确的是
A. 中圆底烧瓶中需加入碎瓷片
B. b、c 中所盛试剂依次为浓硫酸、饱和食盐水
C. d 中黄绿色气体从下往上逐渐充满整个集气瓶
D. e 中 NaOH 溶液可用浓氨水代替
10. 电催化合成氨法在电能的推动下不受热
力学平衡限制,实现 N2、H2O 常温常压合成
氨,下图为 N2 在不同电极材料表面复化的机
制示意图。下列说法正确的是( )
A.电极材料起吸附作用,不影响 N2 的氢化过程
B.N2 在氢化反应之前需先解离成单独的氮原子
12. C.电催化合成氨原子利用率 100%
D. 2.8gN2 理论上可以产生 0.2NA 个 NH3 分子
11. 25°C 时,醋酸的电离常数为 1.8×10-5。 向 20mL2.0 mol/L CH3COOH 溶液中逐滴加入
2.0mol/L NaOH 溶液,溶液中水电离出的 c(H+)在此滴定过程中变化曲线如下图所示。下列
说法正确的是
A. a 点水电离出的 c(H+ )=6.0×10-3 mol/L
B. b 点 c(CH3COOH)>c(Na+)>c(CH3COO—)
C. c 点恰好完全反应,溶液中无 CH3COOH
D. d 点 c(Na+)=2c(CH3COO—)+2c(CH3COOH)
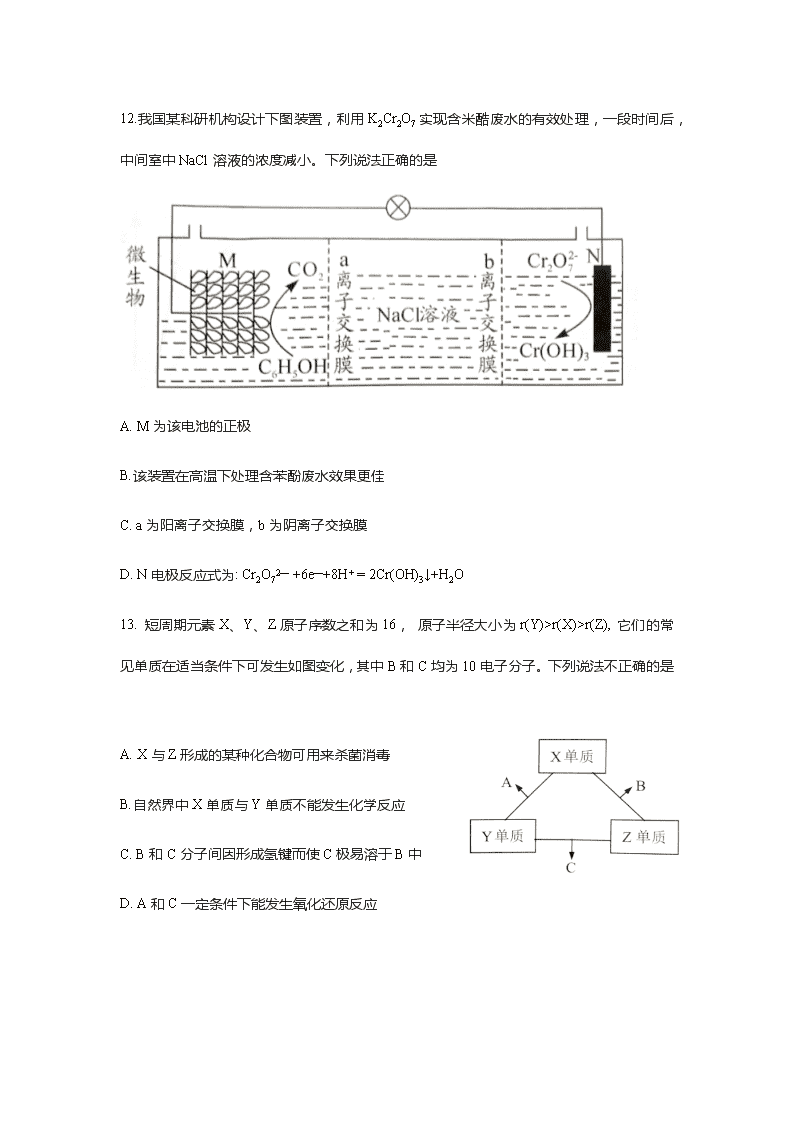
12.我国某科研机构设计下图装置,利用 K2Cr2O7 实现含米酷废水的有效处理,一段时间后,
中间室中 NaCl 溶液的浓度减小。下列说法正确的是
A. M 为该电池的正极
B.该装置在高温下处理含苯酚废水效果更佳
C. a 为阳离子交换膜,b 为阴离子交换膜
D. N 电极反应式为: Cr2O72— +6e—+8H+ = 2Cr(OH)3↓+H2O
13. 短周期元素 X、Y、Z 原子序数之和为 16, 原子半径大小为 r(Y)>r(X)>r(Z), 它们的常
见单质在适当条件下可发生如图变化,其中 B 和 C 均为 10 电子分子。下列说法不正确的是
A. X 与 Z 形成的某种化合物可用来杀菌消毒
B.自然界中 X 单质与 Y 单质不能发生化学反应
C. B 和 C 分子间因形成氢键而使 C 极易溶于 B 中
D. A 和 C 一定条件下能发生氧化还原反应
26.(14 分)亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃,遇
水易水解。它是有机合成中的重要试剂,可由 NO 与 Cl2 在常温常压下合成,某化学兴趣小
组设计下图装置制备 NOC1。回答下列相关问题:
(1)NOCl 分子中各原子均满足 8 电子稳定结构,NOCI 的电子式为
(2)装置乙中的液体为 ,装置丙作用是 .
(3)实验时,先通入 Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入 NO,这样操作
目的是 。待丁中烧瓶内有一定量液体生成时,停止实验。
(4)上述装置设计有一不妥之处,理由是
(用化学方程式表示)。
(5)测定 NOCl 的纯度:取所得产物 ag 溶于水,配制成 250mL 溶液;取 25.00mL.于
锥形瓶中,以 K2Cr2O7 溶液为指示剂,用 cmol.L-1AgNO3 标准溶液滴定至终点,消
耗标准溶液的体积为 24.00mL。滴定终点的现象是 ,亚硝酰氯
( NOCl ) 的 纯 度 为 。( Ag2CrO4 砖 红 色 :
Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4)
27.(15 分)五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。一种以钒渣
(主要含有 V2O3,还有少量 FeO、Al2O3、SiO2 等)为原料生产 V2O5 的工艺流程如下:
已知:VO2++H2O VO3++2H+
(1)“焙烧”时,V2O3 转化为 NaVO3 的化学方程式是 。
(2)滤渣 1 为 (填化学式),“酸浸”后,调 pH=7.6,除了得到沉淀
Fe(OH)3、 ,另一个目的是 .
(3)“沉钒”得到偏钒酸铵(NH4VO3)的离子方程式是 。图 1 是沉钒率随
温度的变化曲线,温度高于 80℃,沉钒率下降,其可能原因是
(4)在“煅烧”过程中,固体残留率(剩余固体质量/原始固体质量 x100%)随温度变化的曲线
如图 2 所示。NH4VO3 分解过程中,先后失去的物质分别是 、 。(填化学式)
(5)金矾液流电池的电解质溶液为 VOSO4.溶液,电池的工作原理为。
VO2++V2++2H+ VO2++H2O+V3+,电池充电时,阳极的电极反应式为 .
28.(14 分)甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2 和 H2)在催化剂
的作用下合成甲醇,可能发生的反应如下:
1.CO2(g)+3H2(g)⇄ CH3OH(g)+H2O(g) ΔH1
2.CO2(g)+H2(g)⇄ CO(g)+H2O(g) ΔH2
3.CH3OH(g)⇄ CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应 2 中相关化学键键能数据如下:
化学键 H-H C=O C≡O H-0
E/KJ·mol-1 436 803 1076 465
由此计算ΔH2= KJ·mol-1。已知ΔH1=-63KJ·mol-1,则ΔH3= KJ·mol-1。
(2)对于反应 1,不同温度对 CO2 的平衡转化率及催化剂的效率影响如下图所示,请回
答下列问题:
①下列说法不正确的是( )
A. M 点时平衡常数比 N 点时平衡常数大
B.温度低于 250℃时,随温度升高甲醇的平衡产率降低
C. 其他条件不变,若不使用催化剂,则 250℃时 CO2 的平衡转化率可能位于 M1
D.实际反应应尽可能在较低的温度下进行,以提高 CO2 的转化率
②若在刚性容器中充入 3molH2 和 1molCO2 发生反应 1,起始压强为 4MPa,则图中 M
点 CH3OH 的 体 积 分 数 为 ,250℃ 时 反 应 的 平 衡 常 数 Kp=
(MPa)-2
(保留三位有效数字);
③ 若 要 进 一 步 提 高 甲 醇 产 率 , 可 采 取 的 措 施 有
(写两条即可)
(3)相同条件下,一定比例 CO/CO2/H2 混合气体甲醇生成速率大于 CO2/H2 混合气体甲
醇生成速率,结合反应 1、2 分析原因: .
(4)以二氧化钛表面覆盖 Cu2A12O4 为催化剂,可以将 CO2 和 CH4 直接转化成乙酸,
CO2(g)+CH4(g)⇄ CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速
率如下图所示:
250~300 ℃时,乙酸的生成速率降低的主要
原因是 .
300~400℃时,乙酸的生成速率升高的主要
原因是 .
35. [化学 选修 3:物质结构与性质] (15 分)
黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。回答下列问题。
(1)基态硫原子中核外电子有______种空间运动状态。 Fe2+ 的电子排布式是
(2)液态 SO2 可发生自偶电离 2SO2 = SO2+ +SO2—, SO32— 的空间构型是_
与 SO2+互为等电子体的分子有 (填化学式,任写一一种)。
(3) CuCl 熔点 426℃,融化时几乎不导电,CuF 熔点 908℃,沸点 100℃,都是铜(I)的卤化
物,熔沸点相差这么大的原因是
(4) 乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫
原子的杂化形式是_____。 乙硫醇的沸点比乙醇的沸点
______ ( 填“高”或“低”),原因是
(5)黄铜矿主要成分 X 的晶胞结构及晶胞参数如图所示,X
的化学式是 ,其密度为 g/cm3 (阿伏加德罗常数的值用 NA 表示)。
36.[化学——选修 5:有机化学基础] (15 分)
已知:
回答以下问题:
(1) A 的化学名称为 。
(2) B 的结构简式为_______, C 中官能团的名称是_______.
(3)由 A 生成 D 的反应类型为_______________。
(4)由 C 和 E 生成 F 的化学方程式为__________________________________________
(5)芳香化合物 X 是 E 的同分异构体,可与 FeCl3 溶液发生显色反应,其核磁共振氢谱显示
有 3 种 不 同 化 学 环 境 的 氢 , 峰 面 积 比 为 6:2:2 。 写 出 两 种 符 合 要 求 X 的 结 构 简 式
_____________________________、_____________________________
(6)写出以 1-溴-2.苯基乙烷为原料制备化合物 的合成销路线(其他试剂任
选)。___________________________________________________