- 633.48 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
请回答下列问题:
(1)装置A中发生反应的化学方程式是________________________________________
________________________________________________________________________。
(2)装置C中看到的现象是________________________________________________________,证明________________________。
(3)装置B内盛有四氯化碳,实验中观察到的现象是________________________________,原因是________________________________________________________________________
________________________________________________________________________。
(4)如果没有B装置,将A、C直接相连,你认为是否妥当(填“是”或“否”)________________,理由是_______________________________________________
______________________________________________________________________________。
(5)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯________层(填“上”或“下”)为溴苯,这说明溴苯________________________________且___________________________。
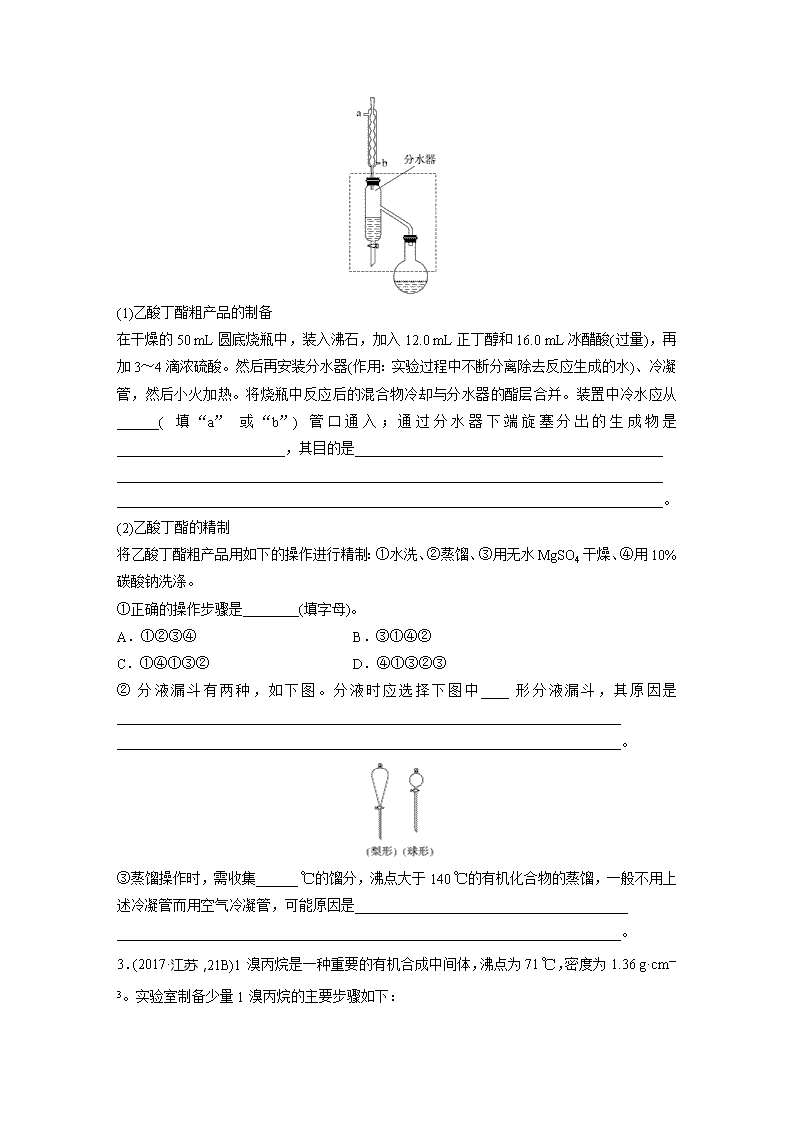
2.乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OHCH3COOCH2CH2CH2CH3+H2O
物质
乙酸
正丁醇
乙酸丁酯
熔点/ ℃
16.6
-89.5
-73.5
沸点/ ℃
117.9
117
126.0
密度/g·cm-3
1.1
0.80
0.88
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从______(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________________________,其目的是____________________________________________
______________________________________________________________________________
______________________________________________________________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填字母)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中____形分液漏斗,其原因是________________________________________________________________________
________________________________________________________________________。
③蒸馏操作时,需收集______ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是_______________________________________
________________________________________________________________________。
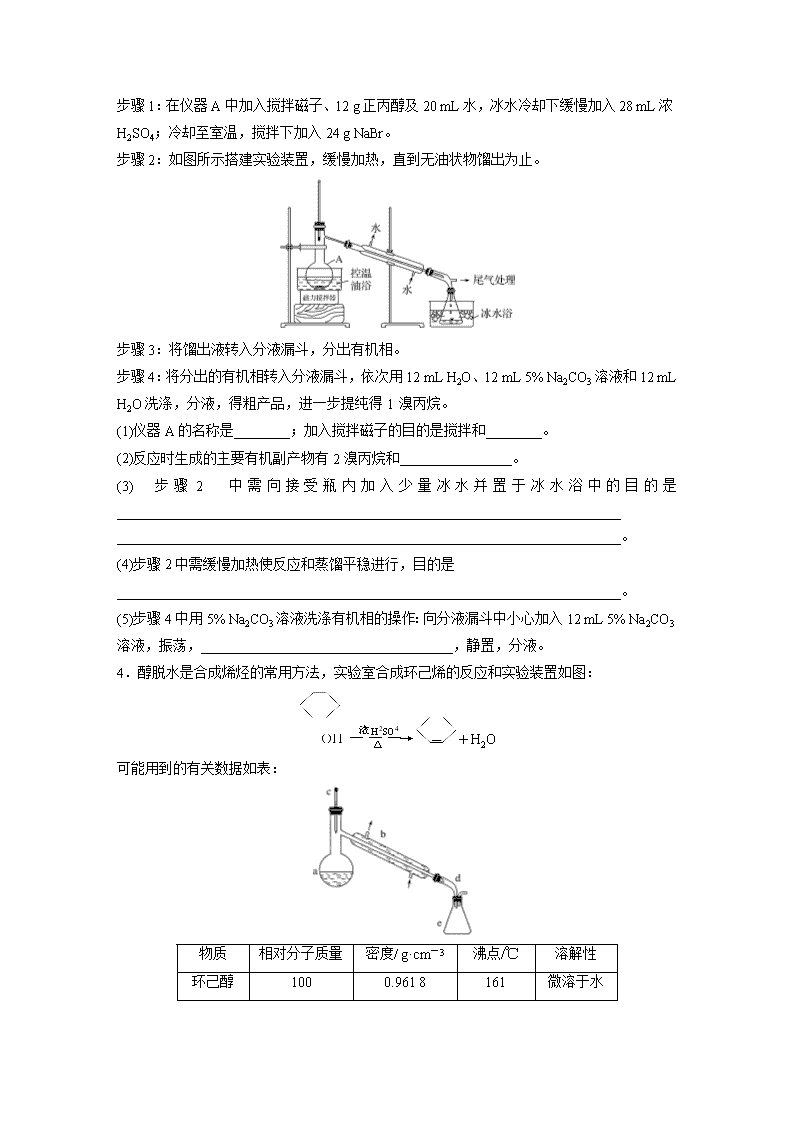
3.(2017·江苏,21B)1溴丙烷是一种重要的有机合成中间体,沸点为71 ℃,密度为1.36 g·cm-3。实验室制备少量1溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓
H2SO4;冷却至室温,搅拌下加入24 g NaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1溴丙烷。
(1)仪器A的名称是________;加入搅拌磁子的目的是搅拌和________。
(2)反应时生成的主要有机副产物有2溴丙烷和________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是________________________________________________________________________
________________________________________________________________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是
________________________________________________________________________。
(5)步骤4中用5% Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________________________________,静置,分液。
4.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
+H2O
可能用到的有关数据如表:
物质
相对分子质量
密度/ g·cm-3
沸点/℃
溶解性
环己醇
100
0.961 8
161
微溶于水
环己烯
82
0.810 2
83
难溶于水
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
请回答下列问题:
(1)装置b的名称是________________________。
(2)加入碎瓷片的作用是________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是____(填字母)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________________
________________________________________________________________________。
(4)分液漏斗在使用前须清洗干净并________________________________________;在本实验分离过程中,产物应该从分液漏斗的________________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_______________________________________
_____________________________________________________________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填字母)。
A.圆底烧瓶 B.温度计
C.吸滤瓶 D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是________(填字母)。
A.41% B.50% C.61% D.70%
5.(2014·全国卷Ⅰ,26)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量
密度/ g·cm-3
沸点/℃
水中溶解性
异戊醇
88
0.812 3
131
微溶
乙酸
60
1.049 2
118
溶
乙酸异戊酯
130
0.867 0
142
难溶
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是_________________________________________,
第二次水洗的主要目的是_______________________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__________________________________________
________________________________________________________________________。
(5)实验中加入少量无水MgSO4的目的是____________________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏____(填“高”或“低”) ,其原因是________________________________________________________
________________________________________________________________________。
6.(2019·聊城模拟)中国中医科学院青蒿素专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素为烃的含氧衍生物,无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差,青蒿素是高效的抗疟药。某学习小组模拟从青蒿中提取青蒿素,并设计实验测定青蒿素的分子结构。
(1)青蒿素的提取
从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺:
已知:乙醚沸点为35℃。
①操作Ⅰ的名称为________________。
②操作Ⅲ的主要过程可能是______________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(2)青蒿素分子式的测定
可用燃烧法测定青蒿素的实验式,所需装置如图:
①产生的氧气按从左到右流向,所选装置各接口的连接顺序是g→c→________________________→盛有碱石灰的干燥管(装置不能重复使用)。
②B装置的作用是_____________________________________________________________。
③E装置中CuO的作用是_____________________________________________________。
④称取28.2 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A装置质量增加66 g,C装置质量增加19.8 g,则该有机物的最简式为________________________________________________________________________
________________________________________________________________________。
⑤若把盛有碱石灰的干燥管的装置去掉,所测得样品中氧的质量分数会________(填“
偏大”“偏小”或“不变”)。
⑥要确定该有机物的分子式,还需要的物理量为________________。
⑦将青蒿素加入滴有酚酞的NaOH溶液中,溶液颜色无明显变化,加热并搅拌,溶液红色变浅,说明青蒿素可能与________(填字母)具有相同的性质。
A.乙醇 B.苯酚 C.丙酸 D.油脂
7.(2020·南京调研)已知反应原理:
主要实验装置和流程如图:
反应试剂、产物的物理性质如表:
名称
相对分子质量
性状
熔点/℃
沸点/℃
密度/ g·cm-3
溶解性
水
乙醇
乙醚
甲苯
92
无色液体易燃易挥发
-95
110.6
0.866 9
不溶
易溶
易溶
苯甲酸
122
白色片状或针状晶体
122.4
248
1.265 9
微溶
易溶
易溶
实验方法:一定量的甲苯和KMnO4溶液置于图甲装置中,在90 ℃时,反应一段时间,再停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯。
(1)无色液体A的结构简式为________________________________________。操作Ⅱ为________________________________________。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是________________________________________________________________________
________________________________________________________________________。
(3)下列关于仪器的组装或使用正确的是____________(填字母)。
A.抽滤可以加快过滤速率,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图甲回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入________________,分液,水层再加入________________,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220 g 产品,配成100 mL 溶液,取其中25.00 mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸的质量分数为__________。
答案精析
1.(1)2Fe+3Br2===2FeBr3,
(2)导管口有白雾,试管内有淡黄色的沉淀生成 有溴化氢生成
(3)液体变橙色 反应放热,挥发逸出的溴蒸气溶于四氯化碳中
(4)否 挥发逸出的溴蒸气能与硝酸银溶液反应
(5)下 不溶于水 密度比水大
2.(1)b 水 分离酯化反应生成的水,使平衡正向移动,提高反应产率
(2)①C ②梨 梨形分液漏斗靠近旋塞处比较细长,双液界面更清晰,分离更完全 ③126 防止因温差过大,冷凝管炸裂
3.(1)蒸馏烧瓶 防止暴沸
(2)丙烯、正丙醚
(3)减少1溴丙烷的挥发
(4)减少HBr挥发
(5)将分液漏斗下口向上倾斜、打开活塞排出气体
4.(1)直形冷凝管(或冷凝管)
(2)防止暴沸 B
(3)
(4)检查是否漏水(检漏) 上口倒出
(5)干燥(或除水)
(6)CD (7)C
5.(1)球形冷凝管
(2)洗掉大部分硫酸和醋酸 洗掉碳酸氢钠
(3)d
(4)提高醇的转化率
(5)干燥 (6)b (7)c
(8)高 会收集少量未反应的异戊醇
解析 (7)据+H2O可知,4.4 g异戊醇完全反应消耗3.0 g乙酸,故乙酸有剩余,生成乙酸异戊酯的理论产量为6.5 g,故该反应的产率为×
100%=60%。
(8)异戊醇的沸点为131 ℃,蒸馏时,若从130 ℃开始收集馏分,将会有一部分未反应的异戊醇被蒸出,使产率偏高。
6.(1)①过滤 ②B
(2)①dhifeab(或dhifeba) ②除去氧气中的水蒸气 ③将可能生成的CO氧化为CO2 ④C15H22O5 ⑤偏小
⑥该有机物的相对分子质量 ⑦D
7.(1) 蒸馏
(2)除去未反应的高锰酸钾
(3)ABD
(4)NaOH溶液 浓盐酸酸化
(5)96%
解析 (5)设产品中苯甲酸质量为m g,则
~KOH
122 g 1 mol
m g 4×2.4×10-3mol
=,
解得m=1.171 2,
产品中苯甲酸的质量分数为×100%=96%。