- 677.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
广东大埔华侨二中2020届高三1月化学测试题
相对原子质量:C 12 Na 23 O 16 K 39 Mn 55 Fe 56
一、选择题
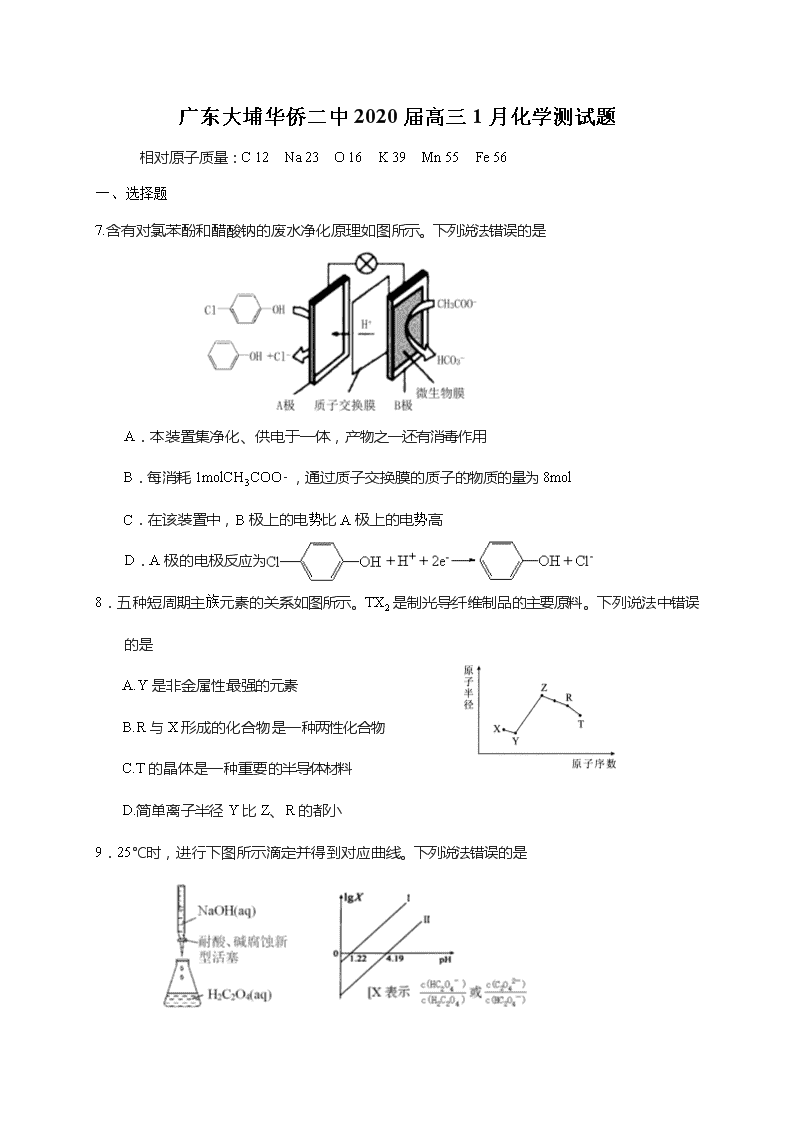
7.含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是
A.本装置集净化、供电于一体,产物之一还有消毒作用
B.每消耗1molCH3COO-,通过质子交换膜的质子的物质的量为8mol
C.在该装置中,B极上的电势比A极上的电势高
D.A极的电极反应为
8.五种短周期主族元素的关系如图所示。TX2是制光导纤维制品的主要原料。下列说法中错误的是
A.Y是非金属性最强的元素
B.R与X形成的化合物是一种两性化合物
C.T的晶体是一种重要的半导体材料
D.简单离子半径Y比Z、R的都小
9.25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是
A.Ka2(H2C2O4)=10-4.19
B.直线Ⅰ中X=
C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.Ⅰ、Ⅱ两条直线的斜率均为1
10.已知苯乙烯和立方烷的结构分别为(b)、(p)。
下列说法中正确的是
A. b、p难溶于苯
B. b、p互为同分异构体
C. b、p的一氯代物分别有6种和1种(不考虑立体异构)
D. b、p均不能使酸性KMnO4溶液退色
11.下列说法错误的是
A.建筑钢筋属于金属材料
B.制玻璃和水泥都要用到石灰石
C.天然气、水煤气、液化石油气均是化合物
D.聚乙烯、纤维素都属于高分子化合物
12.设NA为阿伏加德罗常数的值,下列说法正确是
A. 12g金刚石中含有共价键数目为4NA
B. 标况下2.24LSO3含有的氧原子数目为0.3 NA
C. 1 L 0.1 mol·L-1NH4NO3溶液中含有氮原子总数为0.2NA
D. 电解熔融氯化钠,当阳极生成2.24L氯气时,阴极产生0.1NA个Na
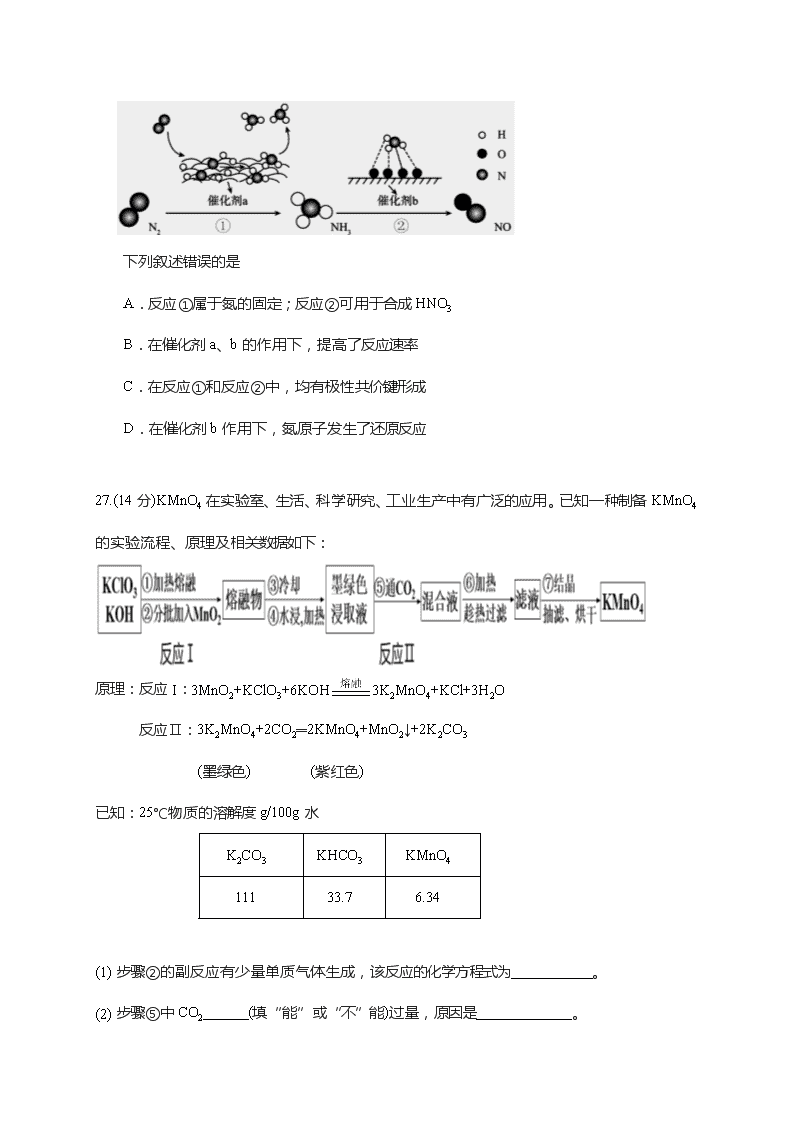
13.下图为N2分子在催化剂的作用下发生的一系列转化示意图:
下列叙述错误的是
A.反应①属于氮的固定;反应②可用于合成HNO3
B.在催化剂a、b的作用下,提高了反应速率
C.在反应①和反应②中,均有极性共价键形成
D.在催化剂b作用下,氮原子发生了还原反应
27.(14分)KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下:
原理:反应I:3MnO2+KClO3+6KOH3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知:25℃物质的溶解度g/100g水
K2CO3
KHCO3
KMnO4
111
33.7
6.34
(1) 步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。
(2) 步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。
(1) 流程中可循环利用的物质主要是_________(写化学式)。
(2) 忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。
(3) 草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;各
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
实验次数
V1(滴定前读数/mL)
V2(滴定后读数/mL)
(V2 -V1)/mL
1
2.65
22.67
20.02
2
2.60
23.02
20.42
3
2.60
22.58
19.98
已知:2MnO4﹣+ 5C2O42﹣+16H+ ═ 2Mn2++ 10CO2↑+ 8H2O
则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。
28.(14分)锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成,① 该反应的离子方程式为____________________;
② 如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。
(3) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(4) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
29.(15分)研究发现,反应CCl4(g)+H2(g)CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
⑴ CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:
CCl4(g)+H2(g)CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
⑵在密闭容器中,CCl4+H2CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验
序号
温度
/℃
初始CCl4浓度/
(mol·L-1)
初始H2浓度/
(mol·L-1)
CCl4的平
衡转化率
1
110
0.8
1.2
α1
2
110
1
1
50%
3
100
1
1
α3
① 实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。② 实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为
mol· L-1·min-1。
③ 110 ℃时,该反应的化学平衡常数的数值为________。
④ 实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
⑶ 120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。
① 图中表示H2起始浓度为2 mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
② 依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
34.(15分)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1) 写出基态Fe3+的核外电子排布式_________。
(2) K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12molσ键的K4[Fe(CN)6的物质的量为________mol。
(1) 黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(2) Fe、Na、K的晶体结构如图所示。
① 钠的熔点比钾更高,原因是__________________________.
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
35.(15分)以苯和丙酮为原料合成化妆品中间体M路线如下:
已知:
① R—CH==CH—R′+
(R、R′代表烃基或氢原子)
(1) A的结构简式为 ,A中含有的官能团名称是__________。
(2) 生成A和C的反应类型依次是____、_____。中间体M的分子式为_______。
(3) 写出流程中由苯生成D的化学方程式:___________________________。
(4) C为二烯烃(C8H14),写出符合下列条件的C的一种同分异构体的结构简式 。
① 含有六个碳形成的碳环
② 核磁共振氢谱图中显示有四组峰,且峰面积之比为3∶2∶1∶1
(5) 设计以乙醛(CH3CHO)、C2H2为原料制备的合成路线(用流程图表示,无机试剂任选):____________________________________。
答案与评分标准
7
8
9
10
11
12
13
C
D
B
B
C
C
D
(注:主观题回答合理的可给分,化学方程式或离子方程式没有配平的扣1分)
27. (14分)
⑴ 2KClO32KCl + 3O2↑ (2分)
⑵ 不能 (1分) CO2(过量)+KOH = KHCO3,因生成KHCO3的溶解度比
K2CO3的小,可能在KMnO4析出时结晶析出而影响产品的纯度。 (2分)
⑶ MnO2 (2分)
⑷ 31.6 (2分) 蒸发过度,使K2CO3伴随KMnO4析出 (2分)
⑸ 80.00% (,或0.8000,2分);偏高 (1分)
28. (14分)
(1) +5 (1分)
(2) 过滤 (1分)
(3) ① 4SnO+NO3-+7OH-=NH3↑+4SnO32- +2H2O (2分)
② c(OH-)=2.5mol/L、温度85 ℃ (2分)
(4) PbO+S2-+2H2O===PbS↓+4OH- (2分)
(5) A B (2分选1个对的给1分,全对的给2分,凡有错不得分)
(6) 抑制Sn2+的水解,促进阳极Sn的溶解(2分); Sn-2e-=Sn2+ (2分)
29. (15分)
⑴ △H2 -△H1+2△H3 (2分)
⑵ ① 大于 (2分)
② 5/6×10-3 (或0.00083,2分,合理给分)
③ 1 (2分) ④ D (3分)
⑶ ① d (2分) ② 4 (2分)
35.(15分)
⑴ 1s22s22p63s23p63d5 或[Ar]3d5 (1分)
⑵ 配位键、离子键 (2分) 1 (2分)
⑶ sp (2分) N>O>C (2分) O>N>C (2分)
⑷ ①Na的半径小,形成的金属键键能大,熔点高 (2分)
② (2分)
36.(15分)
(1) 或 (2分)
羟基、碳碳三键(或碳碳叁键) (2分)
(2) 加成反应、消去反应 (2分) C16H24 (2分)
(3) (2分)
(4) (2分)
(5)
(3分)