- 442.96 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密 ★ 启用前
2020 年全国 I 卷高考考前适应性试卷
化 学 (二)
注意事项:
1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答题前,考生务必将自
己的姓名、考生号填写在答题卡上。
2、回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,
如需改动,用橡皮擦干净后,再选涂其他答案标号。写在试卷上无效。
3、回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4、考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39
一、选择题:本大题共 7 小题,每小题 6 分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
7.中国五年来探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G 技术联通世界
等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是
A.我国近年来大力发展核电、光电、风电、水电。电能属于一次能源
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
C.大飞机 C919 采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
D.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
8.设 NA 为阿伏加德罗常数的值,下列叙述正确的是
A.23g 钠所含的核外电子数为 1.1NA
B.lL lmol·L−1 乙醛溶液中含有分子的数目为 NA
C.4.48L H2 和 CO 混合气体完全燃烧,消耗的氧分子数目为 0.1NA
D.2.13g 氯气与足量热的 NaOH 溶液充分反应生成 和 时,转移的电子数目
为 0.05NA
9.化合物(a)、 (b)、 (c)同属于薄荷系有机物,下列说法正确的是
A.b、c 互为同分异构体 B.a、b、c 都能使溴水褪色
C.由 a 生成 c 的反应是氧化反应 D.a、b、c 都属于芳香族化合物
10.LDFCB 是锂离子电池的一种电解质,该电解质阴离子由同周期元素 W、X、Y、Z 构成(如
下图),Y 的最外层电子数等于 X 的核外电子总数,四种元素最外层电子数之和为 20。下列说法正
确的是
A.原子半径∶W>X>Y>Z
B.四种元素的单质中,Z 的沸点最高
C.W、Z 形成的分子中各原子均满足 8 电子稳定结构
D.Y 分别与另外三种元素形成的二元化合物中,Y 的价态相同
11.燃煤工业锅炉烟气中含有 1%~3%的 CO 和 0.02%~0.04%的 NO,在新型催化剂作用下可消
除 CO 和 NO 两种有害气体,反应机理如图所示,在反应过程中 CO 可被 O2 氧化。下列说法中正确
的是
A.温度越高越有利于有害气体消除
B.O2 浓度越大催化除杂效果越好
C.催化反应的速率由氧化吸附过程决定
D.总反应方程式为 2NO+2CO=N2+2CO2
12.我国科学家已研制出一种可替代锂电池的“可充室温 Na-CO2 电池”,该电池结构如图所示。
电极材料为钠金属片和碳纳米管,电解液为高氯酸钠-四甘醇二甲醚。下列说法错误的是
A.电池放电时钠金属片发生氧化反应
B.电池工作时,外电路流过 0.01mol 电子,负极材料减重 0.23g
C.碳纳米管的作用主要是导电及吸附 CO2,电池充电时,应该与直流电源的正极相连
D.放电时负极反应为:C+2Na2CO3-4e−=3CO2↑+4Na+
2H O NaCl、 3NaClO
此 卷 只 装 订 不 密 封
班级 姓名 准考证号 考场号 座位号
高考考前适应性试卷·化学 第 3 页(共 8 页) 高考考前适应性试卷·化学 第 4 页(共 8 页)
13.分子式为 C5H10O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有(不含立体异构)
A.3 种 B.4 种 C.5 种 D.6 种
二、非选择题(共 43 分)
26.(14 分)实验室以扑热息痛(对乙酰氨基苯酚)为原料,经多步反应制甘素的流程如下:
AcHNOH 扑热息痛 非那西汀 … 甘素
步骤Ⅰ:非那西汀的合成
①将含有 1.0g 扑热息痛的药片捣碎,转移至双颈烧瓶中。用滴管加入 8mL 1mol/L NaOH 的 95%
乙醇溶液。开启冷凝水,随后将烧瓶浸入油浴锅。搅拌,达沸点后继续回流 15min。
②将烧瓶移出油浴。如图所示,用注射器取 1.0mL 的碘乙烷,逐滴加入热溶液中。继续将烧瓶
置于油浴回流 15min。
③将烧瓶从油浴中抬起,取下冷凝管趁热用砂芯漏斗抽滤,滤去不溶的淀粉(药片的填充物)。
将热滤液静置,得到沉淀。用另一个砂芯漏斗过滤得到非那西汀固体。
步骤Ⅱ:甘素的合成
①将非那西汀固体转移到圆底烧瓶中,加入 5mL 6mol/L 盐酸。加热回流 15min。
②加入 NaHCO3 调至 pH 为 6.0~6.5,再向反应液中加 1.37g 尿素和 2 滴乙酸。加热回流
60min。
③移出烧瓶,冷却,有沉淀析出,抽滤,用冰水洗涤,得到甘素。
(1)将药片捣碎所用的仪器名称为________________。
(2)实验中用油浴加热的优点是______________________。
(3)使用砂芯漏斗抽滤的优点是_________________且得到的沉淀较干燥。
(4)冷凝管的冷却水从________(填“a”或“b”)端进。
(5)步 骤 Ⅱ 中 向 热 溶 液 中 加 入 NaHCO3 中 和 , 为 避 免 大 量 CO2 逸 出 , 加 入 NaHCO3 时 应
__________________。
(6)用冰水洗涤甘素固体的操作是_________________。
27.(15 分)利用废旧镀锌铁皮(含 Fe、Zn、Fe2O3、ZnO)制备纳米 Fe3O4 及副产物 ZnO 的流程
如下:
已知:Zn 及其化合物的性质与 Al 及其化合物的性质相似,“滤液 1”中锌元素以 ZnO 2−2 形式存在。
回答下列问题:
(1)实验中需调节“滤液 1”的 pH 约为 8,pH 过大或过小都不利的原因是_______________。
(2)“滤渣 1”的主要成分是__________(填化学式,下同),“滤渣 2”的主要成分是_______。
(3)“部分氧化”阶段,ClO −3被还原为 Cl−,该反应的离子方程式是____________________。
(4)向“溶液 2”中通入 N2 的目的是__________________________________。
(5)某化学兴趣小组用 m1 g 废旧镀锌铁皮(Fe 元素的质量分数为 w)制备纳米 Fe3O4,最终得到 m2
g 产品,则产率为__________(用含 m1、m2 和 w 的代数式表示)。
(6)用酸性高锰酸钾溶液可测定产物 Fe3O4 中二价铁含量,用稀硫酸溶解 Fe3O4,再用酸性 KMnO4
标准溶液进行滴定,发生反应:5Fe2++MnO−4+8H+=Mn2++5Fe3++4H2O。
①判断该反应到达滴定终点的现象是______________________________________________。
②滴定操作中,若滴定前装有酸性 KMnO4 标准溶液的滴定管尖嘴部分无气泡,而滴定结束后
有气泡,则测得的二价铁含量__________(填“偏高”偏低”或“无影响”)。
28.(14 分)治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)CO 泄漏会导致人体中毒,用于检测 CO 的传感器的工作原理如图所示:写出电极 I 上发
生的反应式: 。
工作一段时间后溶液中 H2SO4 的浓度___________(填“变大”、“变小”或“不变”)
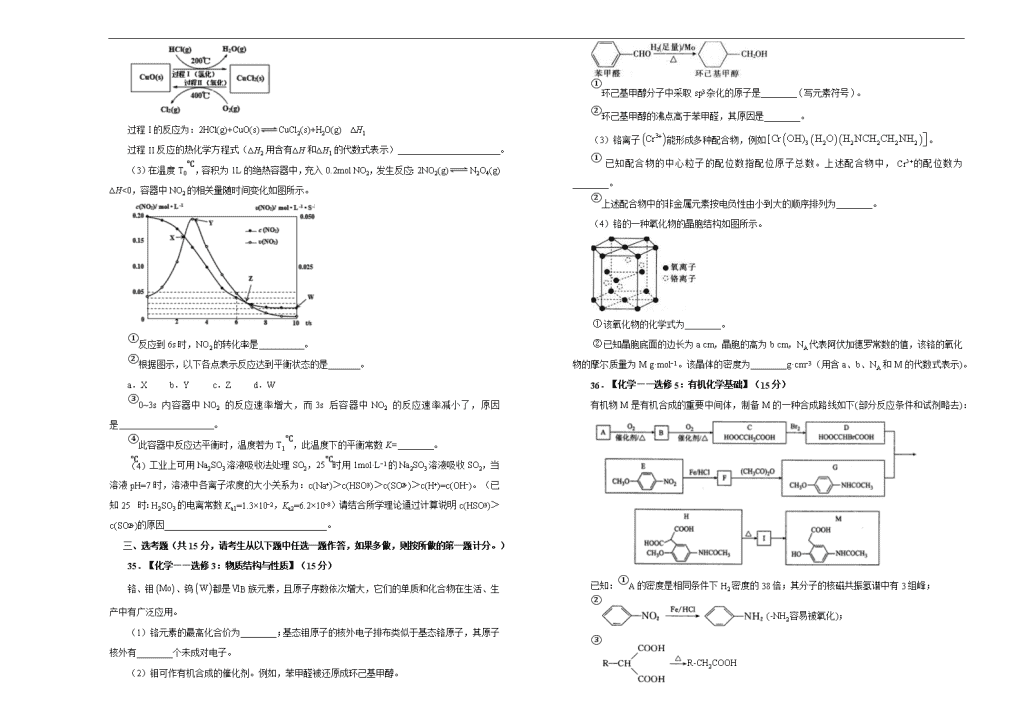
(2)用 O2 氧化 HCl 制取 Cl2,可提高效益,减少污染。反应为:4HCl(g)+O2(g) 2Cl2(g)
+2H2O(g) ∆H,通过控制条件,分两步循环进行,可使 HCl 转化率接近 100%,其原理如图所示:
过程 I 的反应为:2HCl(g)+CuO(s) CuCl2(s)+H2O(g) ∆H1
过程 II 反应的热化学方程式(∆H2 用含有∆H 和∆H1 的代数式表示) 。
(3)在温度 T0℃,容积为 1L 的绝热容器中,充入 0.2mol NO2,发生反应:2NO2(g) N2O4(g)
∆H<0,容器中 NO2 的相关量随时间变化如图所示。
①反应到 6s 时,NO2 的转化率是 。
②根据图示,以下各点表示反应达到平衡状态的是 。
a.X b.Y c.Z d.W
③0~3s 内 容 器 中 NO2 的 反 应 速 率 增 大 , 而 3s 后 容 器 中 NO2 的 反 应 速 率 减 小 了 , 原 因
是 。
④此容器中反应达平衡时,温度若为 T1℃,此温度下的平衡常数 K= 。
(4)工业上可用 Na2SO3 溶液吸收法处理 SO2,25℃时用 1mol·L−1 的 Na2SO3 溶液吸收 SO2,当
溶液 pH=7 时,溶液中各离子浓度的大小关系为:c(Na+)>c(HSO−3)>c(SO2−3 )>c(H+)=c(OH−)。(已
知 25℃时:H2SO3 的电离常数 Ka1=1.3×10−2,Ka2=6.2×10−8)请结合所学理论通过计算说明 c(HSO−3)>
c(SO2−3 )的原因____________________________________。
三、选考题(共 15 分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。)
35.【化学——选修 3:物质结构与性质】(15 分)
铬、钼 、钨 都是ⅥB 族元素,且原子序数依次增大,它们的单质和化合物在生活、生
产中有广泛应用。
(1)铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子
核外有________个未成对电子。
(2)钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
①环己基甲醇分子中采取 sp3 杂化的原子是________ 写元素符号 。
②环己基甲醇的沸点高于苯甲醛,其原因是________。
(3)铬离子 能形成多种配合物,例如 。
①已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
________。
②上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
(4)铬的一种氧化物的晶胞结构如图所示。
该氧化物的化学式为________。
已知晶胞底面的边长为 a cm,晶胞的高为 b cm,NA 代表阿伏加德罗常数的值,该铬的氧化
物的摩尔质量为 M g·mol−1。该晶体的密度为________g·cm−3(用含 a、b、NA 和 M 的代数式表示)。
36.【化学——选修 5:有机化学基础】(15 分)
有机物 M 是有机合成的重要中间体,制备 M 的一种合成路线如下(部分反应条件和试剂略去):
已知:①A 的密度是相同条件下 H2 密度的 38 倍;其分子的核磁共振氢谱中有 3 组峰;
② (-NH2 容易被氧化);
③ R-CH2COOH
( )Mo ( )W
( )
( )3Cr + ( )( )( 3 2 2 2 2 2[Cr OH) H O H NCH CH NH
3Cr +
①
②
高考考前适应性试卷·化学 第 7 页(共 8 页) 高考考前适应性试卷·化学 第 8 页(共 8 页)
请回答下列问题:
(1)B 的化学名称为______。A 中官能团的电子式为______。
(2)C ―→ D 的反应类型是______,I 的结构简式为______。
(3)F ―→ G 的化学方程式为 。
(4)M 不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的 E 的同分异构体有______。
①能与 FeCl3 溶液发生显色反应 ②能与 NaHCO3 反应 ③含有-NH2
(6) 参 照 上 述 合 成 路 线 , 以 为 原 料 ( 无 机 试 剂 任 选 ) , 设 计 制 备
的合成路线:______。
高考考前适应性试卷·化学答案 第 1 页(共 6 页) 高考考前适应性试卷·化学答案 第 2 页(共 6 页)
绝密 ★ 启用前
2020 年全国 I 卷高考考前适应性试卷
化学答案(二)
7.【答案】C
【解析】金属材料包括纯金属以及它们的合金,铝锂合金属于金属材料;答案选 C。
8. 【答案】D
【解析】1mol 钠所含的核外电子为 11mol,所含的核外电子数为 11NA,故 A 错误;1L 1mol·L−1
乙醛溶液中除含乙醛外,还含有 H2O,故所含有分子的数目大于 NA,故 B 错误;选项中没有指明气
体是否在标准状况下,所消耗氧气的物质的量也无法确定,故 C 错误;氯气与热 NaOH 溶液反应的
化学方程式为 ====△
,由上述化学方程式可知,3mol Cl2 发生反应
时转移 5mol 电子,2.13g 氯气的物质的量为 0.03mol,转移电子为 0.05mol,故 D 正确;答案选 D。
9. 【答案】A
【解析】b 和 c 的分子式为 C10H18O,结构不同,属于同分异构体,故 A 正确;a、c 含有碳碳
双键,能使溴水褪色,b 不含有碳碳双键,不能使溴水褪色,故 B 错误;对比 a 和 c 结构简式,a 生
成 c 发生加成反应,故 C 错误;芳香族化合物含有苯环,这三种化合物不含有苯环,不属于芳香族
化合物,故 D 错误。
10. 【答案】A
【解析】Y 的最外层电子数等于 X 的核外电子总数,且 Y 能形成化合物,则 X 的核外电子总数
最多为 7,根据该阴离子中 X 的成键特点可知 X 应为ⅣA 族元素,则 X 为 C,Y 的最外层电子数为
6,四种元素同周期,均为第二周期元素,所以 Y 为 O 元素;Z 只能形成 1 个共价键,则 Z 为 F;
四种元素最外层电子数之和为 20,W 的最外层电子数为 20-4-6-7=3,为 B 元素。同一周期原子序数
越大原子半径越小,则原子半径:W>X>Y>Z,故 A 正确;F、O 的单质常温下为气态,沸点低,
B、C 的单质常温下为固态,沸点高,故 B 错误;BF3 中,B 原子最外层电子数为 6,不满足 8 电子
稳定结构,故 C 错误;O 元素与其他 C、B 元素形成二元化合物显负-2 价,与 F 元素形成二元化合
物 OF2,显正价,O 的价态不同,故 D 错误;故答案为 B。
11. 【答案】C
【解析】温度过高,使催化剂失去活性,不利于有害气体的消除,故 A 错误;O2 浓度稍微增大,
可以利于反应正向进行,但是 O2 浓度太大会把一氧化碳氧化,则不利于有害气体的消除,故 B 错误;
催化反应的速率由慢反应决定的,即氧化吸附过程决定,故 C 正确;根据两步反应,①2NO+O2 =====
催化剂
2NO2,②2NO2+4CO =====
催化剂
N2+4CO2,①+②,得到的总反应为 2NO+O2+4CO =====
催化剂
N2+4CO2,故 D 错误;答案选 C。
12. 【答案】D
【解析】根据图示,原电池中电子由负极流向正极,则钠为负极,电极反应为:Na-e−=Na+;碳
纳米管为正极,电极反应为3CO2+4e−+4Na+=C+2Na2CO3,电池总反应为:4Na+3CO2 2Na2CO3+C。
故 A 正确,D 错误;根据分析,钠为负极,电极反应为 Na-e−=Na+,电池工作时,外电路流过 0.01mol
电子,则产生 0.01mol Na+,负极材料减重 0.01mol×23g/mol=0.23g,故 B 正确;根据分析,钠为负
极,碳纳米管为正极,充电为放电的逆过程,电池充电时,正极变为阳极,应该与直流电源的正极
相连,故 C 正确;答案选 D。
13. 【答案】B
【解析】分子式为 C5H10O2 且与 NaHCO3 溶液反应能产生气体,则该有机物中含有−COOH,可
写为 C4H9−COOH,−C4H9 的异构体有:−CH2CH2CH2CH3,−CH(CH3)CH2CH3,−CH2CH(CH3)CH3,
−C(CH3)3,故符合条件的有机物的同分异构体数目为 4;故选 B。
26. 【答案】(1)研钵
(2)加热均匀,温度易于控制
(3)加快过滤速度
(4)a
(5)分多次加入
(6)向过滤器中加入冰水至刚刚没过固体,进行抽滤,再重复 2 次
【解析】(1)将固体药品研碎应该在硏钵中进行;(2)油浴加热类似于水浴加热,可提供恒定的温
度,且加热温度均匀,使反应温度易于控制;(3)使用砂芯漏斗抽滤,能够增大被过滤的固体上下方
的气体压强差,使液体可以快速流动,过滤速度较快,因此可加快过滤速度;(4)冷凝时应使冷却水
充满冷凝管,要采用逆流原理,冷却水应从下口进入上口排出,故冷却水要从 a 口进入;(5)为避免
大量 CO2 溢出,每次应生成少量 CO2,则可采取少量多次加入的方法;(6)洗涤固体,可向过滤器中
加入冰水至刚刚没过固体,进行抽滤,为保证沉淀洗涤干净,同时又要防止因洗涤次数过多导致物
质因溶解而损失,一般重复洗涤 2~3 次。
27. 【答案】( 1)pH 过小,导致氢氧化锌沉淀溶解;pH 过大,ZnO 2−2 不会完全转化为
Zn(OH)2,ZnO 的产率减小
(2)Fe、Fe2O3 Zn(OH)2
(3)6Fe2++ClO−3+6H+=6Fe3++Cl−+3H2O
(4)防止 Fe2+被氧化
(5)
2 3 26NaOH+3Cl 5NaCl+NaClO +3H O∆
2 3 26NaOH+3Cl 5NaCl+NaClO +3H O∆
放电
充电
2
1
21m 100%29m w
×
高考考前适应性试卷·化学答案 第 3 页(共 6 页) 高考考前适应性试卷·化学答案 第 4 页(共 6 页)
(6)当滴入最后一滴 KMnO4 溶液时,溶液变成浅红色,且半分钟内不褪色 偏低
【解析】由流程图可知,废旧镀锌铁皮(含 Fe、Zn、Fe2O3、ZnO)加 NaOH 后,Zn、ZnO 转化为
ZnO2−2 ,进入滤液 1 中,Fe2O3、Fe 不与 NaOH 反应,进入到滤渣 1 中。滤渣 1 经水洗、酸溶,转化
为含有 Fe2+和 Fe3+的溶液,加入 NaClO3 氧化,使部分 Fe2+转化为 Fe3+,再加入 NaOH,在 N2 的保
护下使 Fe2+和 Fe3+转化为纳米 Fe3O4。滤液调 pH 后 ZnO 2−2 转化为 Zn(OH)2 沉淀下来,滤渣 2 即为
Zn(OH)2,经灼烧后转化为 ZnO。(1)根据分析,滤液 1 中为 ZnO2−2 ,pH 过小,会导致 Zn(OH)2 沉
淀溶解:Zn(OH)2+2H+=Zn2++2H2O;由于 ZnO 2−2 在强碱中可稳定存在,pH 过大,ZnO 2−2 不会完全转
化为 Zn(OH)2,最终生成的 ZnO 减少;(2)由分析可知,滤渣 1 的主要成分是 Fe、Fe2O3,滤渣 2
的主要成分是 Zn(OH)2;(3)部分氧化过程中,Fe2+被氧化为 Fe3+,根据题意,ClO −3被还原为 Cl−,
故离子方程式为:6Fe2++ClO−3+6H+=6Fe3++Cl−+3H2O;(4)由于部分氧化之后,溶液中的 Fe2+和 Fe3+
已经符合纳米 Fe3O4 要求的比例,而在加 NaOH 的过程中,Fe2+易被氧化,故通 N2 的目的是防止 Fe2+
被氧化;(5)Fe3O4 中 Fe 占的比例为 ,m1 g 废旧镀锌铁皮(Fe 元素的质量分数为
w ) 理 论 上 能 产 生 Fe3O4 的 质 量 为 , 最 终 得 到 m2 g 产 品 , 则 产 率 为
;(6)①用酸性 KMnO4 溶液可测定产物 Fe3O4 中的 Fe2+,当 Fe2+被滴定
完后,溶液中出现 KMnO4,溶液变为浅红色,所以滴定终点现象为:当滴入最后一滴 KMnO4 溶液
时,溶液变成浅红色,且半分钟内不褪色。②若滴定前装有酸性 KMnO4 标准溶液的滴定管尖嘴部
分无气泡,而滴定结束后有气泡,说明滴定使用的 KMnO4 标准溶液体积偏小,导致计算时算出的 Fe2+
含量也偏小。
28. 【答案】(1)CO-2e−+H2O=CO2+2H+ 不变
(2)2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) ∆H2=∆H-2∆H1
(3)80% d 反应放热,体系的温度升高,反应速率加快,后来 NO2 浓度减小,反应速
率随之减小 225
( 4 ) 根 据 Ka2=c(SO2−3 )·c(H+)/c(HSO−3)=6.2×10−8 , 将 c(H+)=1.0×10−7 代 入 得 出
c(SO2−3 )/c(HSO−3)=6.2
×10−1<1,所以 c(HSO−3)>c(SO2−3 )
【解析】(1)根据图示可知电极 I 上 CO 失电子被氧化为 CO2,电解质溶液为硫酸溶液,所以电
极 方 程 式 为 CO-2e−+H2O=CO2+2H+ ; 电 极 Ⅱ 上 氧 气 被 还 原 生 成 水 , 电 极 方 程 式 为
O2+4e−+4H+=2H2O,所以总反应为 2CO+O2=2CO2,不影响硫酸的浓度,即硫酸的浓度不变;(2)总反
应为 4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ∆H ①;过程 I 的反应为:2HCl(g)+CuO(s)
CuCl2(s)
+H2O(g) ∆H1 ② ; 根 据 盖 斯 定 律 ①-②×2 可 得 过 程 II 反 应 的 热 化 学 方 程 式 为
2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) ∆H2=∆H-2∆H1,因整个过程中 HCl 的转化率接近 100%,所以过
程 II 用“=”;(3)①据图可知 6s 时,c(NO2)=0.04mol/L,初始 c(NO2)=0.20mol/L,所以转化率为
=80%;②据图可知 X、Y、Z 三个点速率还在随时间发生改变,W
点速率不在改变,所以 W 点可以表示反应达到平衡状态,所以选 d;③该反应放热,随反应进行体
系内温度升高,反应速率加快,但后来 NO2 的浓度减小,浓度对反应速率的影响占主导,所以反应
速率减慢;④据图可知平衡时 c(NO2)=0.02mol/L,则∆c(NO2)=0.20mol-0.02mol/L=0.18mol/L,根据
方程式可知平衡时 c(N2O4)=0.09mol/L,所以平衡常数 K= =225;(4)根据 Ka2=
=6.2×10−8,将 c(H+)=1.0×10−7 代入得出 =6.2×10−1<1,所以 c(HSO−3)>c(SO2−3 )。
35. 【答案】(1)+6 6
(2)C、O 环己基甲醇分子间能够形成氢键
(3)6
(4)
【解析】 为 24 号元素,价电子排布式为 ,最高正价为 价;基态钼原子的核外
电子排布类似于基态铬原子,价电子排布式为 ,其原子核外有 6 个未成对电子; 环己
基甲醇中 C 均以单键连接,采取 杂化,O 原子的杂化轨道数为 4,也采取 杂化; 环己基
甲醇中含有羟基,分子间存在氢键,沸点较高; 中 2 个 N 原子均与 形
成配位键,配体有 3 个 OH−、1 个 H2O 和 1 个 ,故 的配位数为 6; 同周
期从左到右,元素的电负性逐渐增大,氢的电负性在四种元素中最小,故电负性: ;
(4)①每个晶胞中含有 数目为:4; 数目为: ,故化学式为 ;
每 个 晶 胞 的 质 量 , 晶 胞 的 体 积 , 故 晶 胞 的 密 度
。
56 3 21=56 3+16 4 29
×
× ×
1 1m 29m=21 21
29
w w
2 2
1 1
m 21m= 100%29m 29m
21
w w
×
2CuO/CuCl
-1 -1
-1
0.20mol L -0.04mol L 100%0.20mol L
×
2
0.09
0.02
( ) ( )
( )
+2-
3
-
3
HSO
HSO
c c
c
( )
( )
2-
3
-
3
SO
HSO
c
c
H C N O< < <
2 3Cr O 2
A
4 3M
9N a b⋅
( )1 Cr 5 13d 4s 6+
5 14d 5s ( )2 ①
3sp 3sp ②
( ) 2 2 2 23 H NCH CH NH① 3Cr +
2 2 2 2H NCH CH NH 3Cr + ②
H C N O< < <
3Cr + 2O − 1 112 2 3 66 2
× + × + = 2 3Cr O
②
A
2M gN
= 2 33 3a bcm2
= ×
高考考前适应性试卷·化学答案 第 5 页(共 6 页) 高考考前适应性试卷·化学答案 第 6 页(共 6 页)
36. 【答案】(1)丙二醛
(2)取代反应
(3) +(CH3CO)2O +CH3COOH
(4)d
(5) 、 (符合要求均可)
(6)
【解析】(1)~(5)A 的密度是相同条件下 H2 密度的 38 倍,则 A 的相对分子质量为 76,其
分子的核磁共振氢谱中有 3 组峰,A 能连续被氧化生成二元酸,则 A 为二元醇,A、B、C 中碳原子
个数相等,则 A 为 HOCH2CH2CH2OH,B 为 OHCCH2CHO,C 发生取代反应生成 D;根据已知②
知,E 发生还原反应生成 F 为 ,F 发生取代反应生成 G,D 与 G 发生取代反应
生成 H,H 加热发生已知③的反应生成的 I 为 ,I 发生取代反应生成 M;
(1)B 为 OHCCH2CHO,B 的化学名称为丙二醛,A 是 HOCH2CH2CH2OH,A 中官能团为羟基,A 中
官 能 团 的 电 子 式 为 ; (2)C 的 结 构 简 式 为 HOOC-CH2-COOH , D 的 结 构 简 式 为
HOOCCHBrCOOH,C 与 Br2 发生取代反应产生 HOOC-CHBr-COOH 和 HBr;I 的结构简式为
;(3)F 发生取代反应生成 G,F→G 的化学方程式为
+(CH3CO)2O CH3COOH+
;(4)a.M 中苯环能发生加成反应,a 不符合题意;b.酚羟基能发生氧化
反应,b 不符合题意;c.羧基、酚羟基和肽键都能发生取代反应,c 不符合题意;d.羧基、酚羟基
和肽键都不能发生消去反应,d 符合题意;故合理选项是 d;(5)E 的同分异构体符合下列条件:①
能与 FeCl3 溶液发生显色反应,说明含有酚羟基;②能与 NaHCO3 反应,说明含有羧基,③含有-
NH2,如果-OH、-COOH 相邻,有 4 种;如果-OH、-COOH 相间,有 4 种;如果-OH、-COOH 相对,
有 2 种 , 所 以 符 合 条 件 的 有 10 种 , 其 中 两 种 同 分 异 构 体 的 结 构 简 式 是 : 、
; (6) 以 为 原 料 ( 无 机 试 剂 任 选 ) , 设 计 制 备
的合成路线, 可由对氨基苯甲酸发生缩
聚反应得到,氨基可由硝基还原得到,羧基可由醛基氧化得到,醛基可由醇羟基氧化得到,醇羟基
可由卤代烃发生水解反应得到,其合成路线为
。