- 327.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高一化学
(本试卷共100分,考试时间60分钟)
一、单选题(共24小题,每小题2分,共48分)
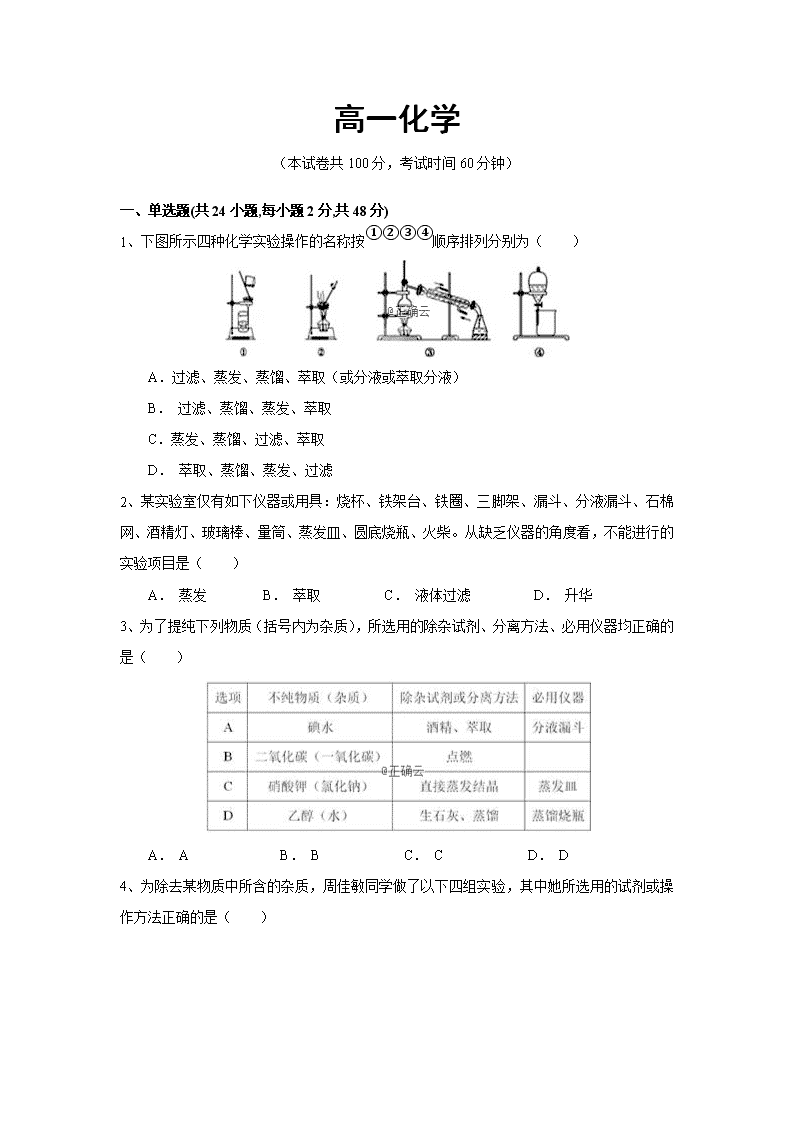
1、下图所示四种化学实验操作的名称按①②③④顺序排列分别为( )
A.过滤、蒸发、蒸馏、萃取(或分液或萃取分液)
B. 过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取
D. 萃取、蒸馏、蒸发、过滤
2、某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。从缺乏仪器的角度看,不能进行的实验项目是( )
A. 蒸发 B. 萃取 C. 液体过滤 D. 升华
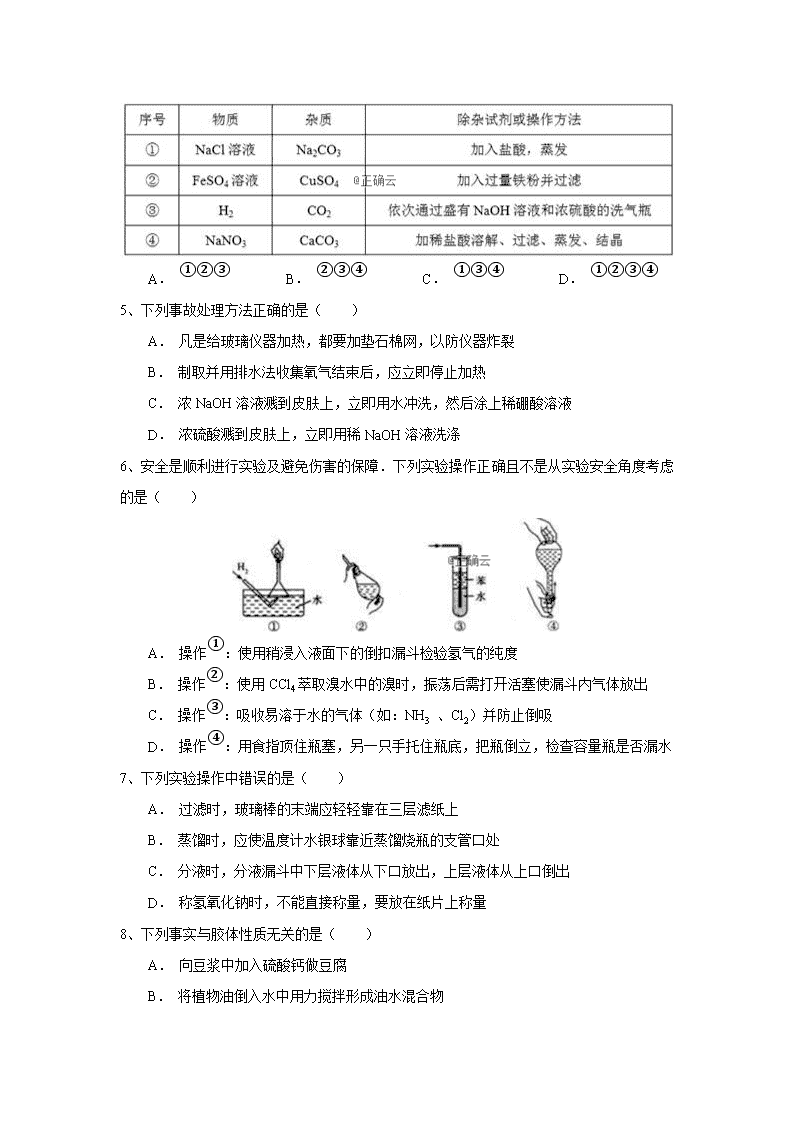
3、为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器均正确的是( )
A. A B. B C. C D. D
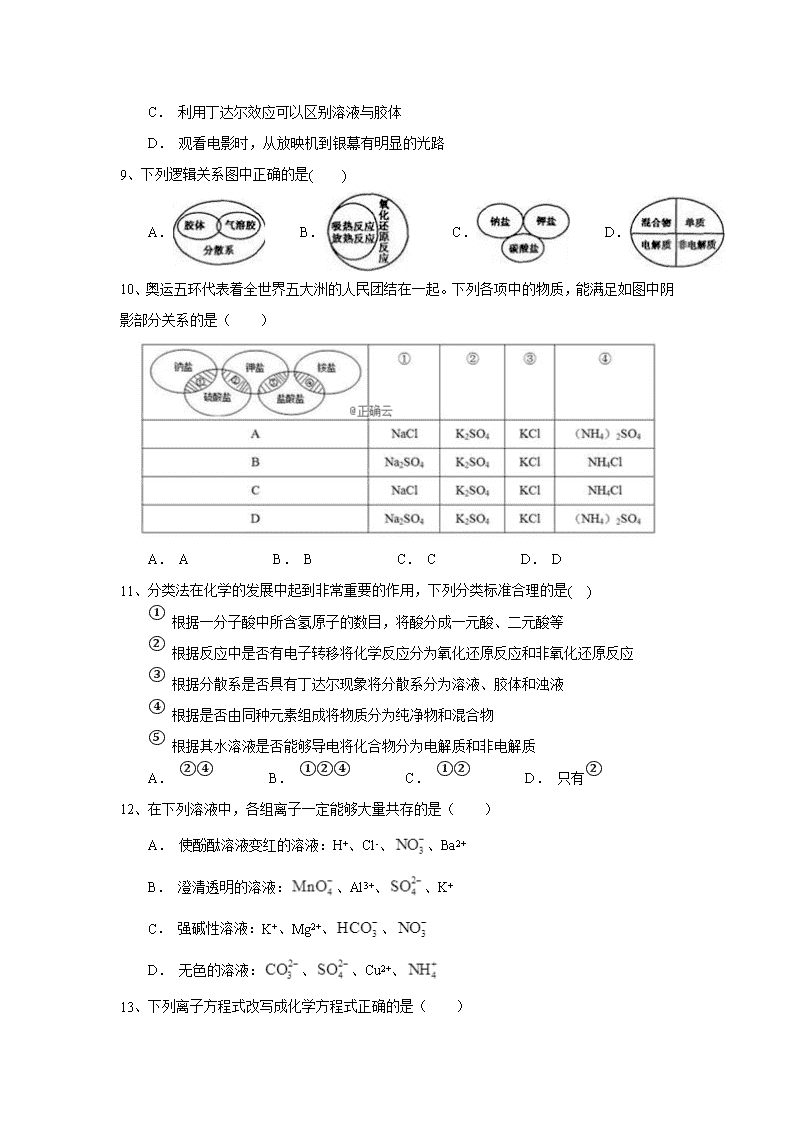
4、为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )
A. ①②③ B. ②③④ C. ①③④ D. ①②③④
5、下列事故处理方法正确的是( )
A. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
B. 制取并用排水法收集氧气结束后,应立即停止加热
C. 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D. 浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤
6、安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )
A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收易溶于水的气体(如:NH3 、Cl2)并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
7、下列实验操作中错误的是( )
A. 过滤时,玻璃棒的末端应轻轻靠在三层滤纸上
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 称氢氧化钠时,不能直接称量,要放在纸片上称量
8、下列事实与胶体性质无关的是( )
A. 向豆浆中加入硫酸钙做豆腐
B. 将植物油倒入水中用力搅拌形成油水混合物
C. 利用丁达尔效应可以区别溶液与胶体
D. 观看电影时,从放映机到银幕有明显的光路
9、下列逻辑关系图中正确的是( )
A. B. C. D.
10、奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )
A. A B. B C. C D. D
11、分类法在化学的发展中起到非常重要的作用,下列分类标准合理的是( )
① 根据一分子酸中所含氢原子的数目,将酸分成一元酸、二元酸等
② 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④ 根据是否由同种元素组成将物质分为纯净物和混合物
⑤ 根据其水溶液是否能够导电将化合物分为电解质和非电解质
A. ②④ B. ①②④ C. ①② D. 只有②
12、在下列溶液中,各组离子一定能够大量共存的是( )
A. 使酚酞溶液变红的溶液:H+、Cl-、、Ba2+
B. 澄清透明的溶液:、Al3+、、K+
C. 强碱性溶液:K+、Mg2+、、
D. 无色的溶液:、、Cu2+、
13、下列离子方程式改写成化学方程式正确的是( )
A. Cu2++2OH﹣===Cu(OH)2↓ CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.+2H+===CO2↑+H2O BaCO3+2HCl===BaCl2+CO2↑+H2O
C. Ca2++===CaCO3↓ Ca(NO3)2+Na2CO3===CaCO3↓+2NaNO3
D. H++OH﹣===H2O Ba(OH)2+H2SO4===BaSO4+2H2O
14、下列反应的离子方程式错误的是( )
A. 碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
B. 硫酸铵溶液与氢氧化钡溶液反应:+OH﹣===NH3•H2O
C. CO2通入足量澄清石灰水中:CO2+Ca2++2OH﹣===CaCO3↓+H2O
D. CuO与盐酸反应:CuO+2H+===Cu2++H2O
15、下列各组离子在溶液中能大量共存,加入OH-有沉淀生成,加入H+有气体生成的一组离子是( )
A. K+ Mg2+ Cl- B. K+ Cu2+ Na+
C. Na+ D. Cl- K+
16、在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、、、OH-。已知两烧杯中各含三种离子,且甲烧杯的溶液呈蓝色,则乙烧杯中大量存在的离子是( )
A. Cu2+ H+ B. K+ OH-
C. OH- D. K+ H+
17、甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是( )
A. BaCl2、Na2CO3、AgNO3、盐酸 B. BaCl2、Na2CO3、盐酸、AgNO3
C. Na2CO3、盐酸、AgNO3、BaCl2 D. AgNO3、盐酸、BaCl2、Na2CO3
18、对于某些离子的检验及结论一定正确的是( )
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有
C. 加入AgNO3溶液,生成白色沉淀,加稀硝酸沉淀不溶解时,能确定有Cl-存在
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
19、有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )
A. BaCl2、CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在
D. C为单一溶质溶液
20、某溶液中含有较大量的Cl﹣、CO、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A. ①②④②③ B. ④②①②③ C. ①②③②④ D. ④②③②①
21、除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是( )
A. Na2CO3 、AgNO3 、HNO3 B. AgNO3 、Na2CO3 、HCl
C. AgNO3 、Na2CO3 、HNO3 D. AgNO3 、K2CO3 、HNO3
22、从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A. 2NaBr+Cl2===2NaCl+Br2
B. AlCl3+3NaAlO2+6H2O===4Al(OH)3↓+3NaCl
C. 2H2S+SO2===2H2O+3S↓
D. 2CO+O2===2CO2
23、关于氧化还原反应的说法,正确的是( )
A. 物质失去的电子数越多,其还原性越强
B. 物质所含元素化合价升高的反应叫还原反应
C. 某元素由化合态变为游离态,则它一定被还原
D. 置换反应一定属于氧化还原反应
24、常温下,在溶液中可发生以下反应:①2Fe2++Br2===2Fe3++2Br﹣②2Br﹣+Cl2===Br2+2Cl﹣③2Fe3++2I﹣===2Fe2++I2
,由此判断下列说法正确的是( )
A. 铁元素在反应①中被还原,在③中被氧化
B. 反应②中CI2作氧化剂,Br﹣被还原
C. 氧化性强弱顺序为Cl2>I2>Br2>Fe3+
D. 还原性强弱顺序为I﹣>Fe2+>Br﹣>Cl﹣
二、填空题
25.(10分)完成下列反应的离子方程式:
(1)写出氢氧化钡溶液与硫酸铜溶液反应的离子方程式: 。
(2)写出石灰石与稀盐酸反应的离子方程式: 。
(3)碳酸钙固体中加入足量醋酸: 。
(4)氧化铁和稀硫酸溶液反应: 。
(5)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀: 。
26.(9分)下列物质:(1)Fe、(2)干冰、(3)NaCl溶液、(4)Cu(OH)2、(5)熔融MgCl2、(6)NH4Cl溶液、(7)酒精、(8)石灰水、(9)CH3COOH 、(10)CuSO·5H2O、(11)KNO3晶体、(12)蔗糖、(13)碱石灰 、(14)石墨(用序号作答)。
其中
(1)以上物质属于电解质的是 ;
(2)以上物质属于非电解质的是 ;
(3)以上物质能导电的是 ;
三、实验题(12分)
27.(12分)分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
可能用到的有关数据如下:
Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的
(填“上口倒出”或“下口倒出”)。
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
四、推断题
28.(9分).现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了确定四种溶液各是什么,将它们随意编上A、B、C、D后,产生的现象如下表所示。根据实验现象按要求回答:
写出上述实验中②③④的离子方程式:
②______________________________________________________________________;
③______________________________________________________________________;
④______________________________________________________________________。
29.(12分)某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是____________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是__________________,有关反应的离子方程式为____________________。
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________________,有关反应的离子方程式为____________________。
(4)原溶液中可能大量存在的阴离子是____________(填序号)。
A.Cl- B. C. D.OH-