- 1.07 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
贵州省黔东南州2020届高三高考模拟考试
可能用到的相对原子质量:H1 Li7 C12 N14 O16 Na23 Mg24 S32 Ni59
第Ⅰ卷
一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活密切相关。下列说法正确的是( )
A.利用二氧化硅与碳酸钙常温反应制备陶瓷
B.纺织业利用氢氧化钠的强氧化性将其作为漂洗的洗涤剂
C.利用明矾的水溶液除去铜器上的铜锈,因Al3+水解呈酸性
D.“丹砂(主要成分为硫化汞)烧之成水银,积变又还成丹砂”中发生的反应为可逆反应
8.设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.11g的D218O中含有的中子数为5NA
B.1L pH=2的H2SO3溶液中H+的数目为0.02NA
C.将0.1mol Cl2通入足量FeI2溶液中,转移电子数目为0.2NA
D.标准状况下,4.48L甲烷与足量Cl2完全反应生成CH3Cl的分子数目为0.2NA
9.有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式如图所示,下列关于邻二乙烯苯的说法不正确的是( )
A.1 mol邻二乙烯苯含有5 mol碳碳双键
B.所有的原子可能在同一平面
C.能发生加成反应,也能发生取代反应
D.苯环上的二氯代物有4种(不考虑立体结构)
10.下列实验装置或操作能达到相应实验目的( )
A.①② B.③④ C.②③ D.②④
11.元素周期表的一部分如图所示,W、X、Y、Z均为短周期元素,X与Z的最高正价之和与W的相等,下列说法误的是( )
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水库中,Z的单质不发生反应
12.科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是( )
A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
13.25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.25℃时,H2CO3的一级电离价Ka1(H2CO3) =1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O ⇌ H2CO3+OH-的Kb=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
第Ⅱ卷
二、非选择题
(一)必考题
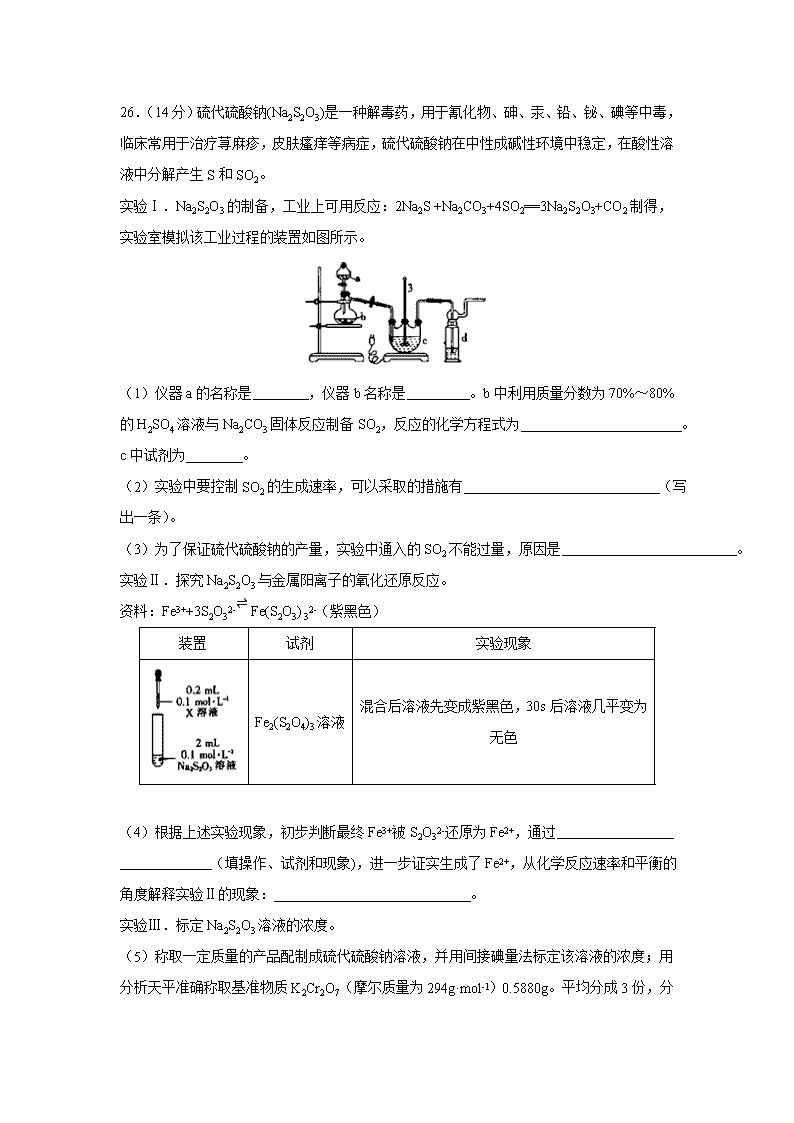
26.(14分)硫代硫酸钠(Na2S2O3)是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症,硫代硫酸钠在中性成碱性环境中稳定,在酸性溶液中分解产生S和SO2。
实验Ⅰ.Na2S2O3的制备,工业上可用反应:2Na2S +Na2CO3+4SO2==3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示。
(1)仪器a的名称是 ,仪器b名称是 。b中利用质量分数为70%~80%的H2SO4溶液与Na2CO3固体反应制备SO2,反应的化学方程式为 。c中试剂为 。
(2)实验中要控制SO2的生成速率,可以采取的措施有 (写出一条)。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是 。
实验Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌ Fe(S2O3) 32-(紫黑色)
装置
试剂
实验现象
Fe2(S2O4)3溶液
混合后溶液先变成紫黑色,30s后溶液几平变为无色
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过
(填操作、试剂和现象),进一步证实生成了Fe2+,从化学反应速率和平衡的角度解释实验Ⅱ的现象: 。
实验Ⅲ.标定Na2S2O3溶液的浓度。
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度;用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g·mol-1
)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I—+Cr2O72-+14H+==3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-==2I—+S4O62-,三次消耗Na2S2O3溶液的平均体积为25.00mL,则所标定的硫代硫酸钠溶液的浓度为 mol·L-1。
27.(14分)2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4。部分工艺流程如下(该流程可能造成水体砷污染):
已知:滤液1、滤液2中部分离子的浓度(g·L-1)
Li+
Ni+
Mg+
滤液1
22.72
20.68
60.18
滤液2
21.94
7.7×10-3
7.8×10-3
Ⅰ.制备Li2C2O4
(1)滤渣2的主要成分有 (填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为 。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式 。
Ⅱ.制备 LiFePO4
(4)将电池Li2C2O4和FePO4置于高温下反应,生成LiFePO4和一种温室气体,该反应的化学方程式是 。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是 (任写一点)。
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(V),其机制模型知图,其中零价铁与过硫酸钠反应的离子方程式是 。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数为 。
28.(15分)甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛,回答下列问题:
已知:Ⅰ.2CH2=CH2(g)+O2(g)⇌2(g) ΔH1<0
Ⅱ.CH2=CH2(g)+3O2(g)⇌2CO2(g)+2H2O(l) ΔH2
Ⅲ.2(g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3
(1)若反应Ⅲ是在一定温度下可自发进行,则ΔH3 (填“>”“<”或“=”)
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则△H2= kJ·mol-1。
(3)实验测得2CH2=CH2(g)+O2(g)⇌2(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),
v逆=k逆·c2()(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数 (填“大于”“小于”或“等于”) k逆增大的倍数。
②若在1L的密闭容器中充入1mol CH2=CH2(g)和1mol O2(g),在一定温度下只发生反应Ⅰ,经过10min 反应达到平衡,CH2=CH2(g)的转化率为40%,则0~10min内,v(O2)= ,k正/k逆= (保留两位有效数字)。
(4)下列有关环氧乙烷制备的说法正确的是 (填字母)。
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水
图1 环氧乙烷选择性与进料气体初始温度关系
图2 乙烯转化率-环氧乙烷选择性与进料气体流速关系
(5)一种以天然气为物燃料的固体氧化物燃料电池的原理如图3所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。
A极上的电极反应式为 ;若电路中转移0.1mol电子,则消耗标准状况下CH4的体积为 L。
(二)选考题
35.[化学——物质结构与性质](15分)
2018年11月《Nature Energy》报道了中科院大连化学物理研究所科学家用Ni—BaH2/Al2O3、Ni—LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 ;基态Ni2+的核外电子排布式为 ,若该离子核外电子空间运动状态有15种,则该离子处于 (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3-的空间构型为 。
②甘氨酸中N原子的杂化类型为 ,分子中σ键与π键的个数比为 ,晶体类型是 ,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是 。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图1所示,导致这种变化的原因是 。
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg·cm-3,则阿伏加德罗常数NA= (列出表达式)mol-1。
36.[化学——有机化学基础](15分)
化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:
(1)ClCH2CH2C1的名称是 。
(2)E中不含氧的官能团的名称为 。
(3)C的分子式为 ,B→C的反应类型是 。
(4)筛选C→D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
组别
加料温度
反应溶剂
AlCl3的用量(摩尔当量)
①
-30~0℃
1 eq
②
-20~-10℃
1 eq
③
-20~-10℃
ClCH2CH2Cl
1 eq
上述实验筛选了 和 对物质D产率的影响。此外还可以进一步探究
对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式: 。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③1 mol M只能与1mol NaOH反应。
(6)结合上述合成路线,写出以、CH3I和SOCl2为基本原料合成的路线图。(其他所需无机试剂及溶剂任选)
已知,RCOOHRCOCl。
【参考答案】