- 611.60 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
石嘴山市第三中学高二期末考试化学试题
可能用到的原子量;H 1 O 16 N 14 C 12 Cu 64 Fe-56
一、选择题(单选题,每小题 3 分,共 54 分)
1、下列分别是利用不同能源发电的实例,其中不属于新能源开发利用
的是( )
2、下列化学用语对事实的表述不正确的是( )
A.电解精炼铜的阴极反应:Cu2+ +2e− Cu
B.常温时,0.1mol/L 氨水的 pH=11.1:NH3·H2O NH4
++OH−
C.醋酸钠使酚酞溶液变红:CH3COONa+H2O=CH3COOH+NaOH
D.由 Na 和 Cl 形成离子键的过程:
3、用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中
加适量水,就能使溶液浓度恢复到电解前浓度的是( )
A.AgNO3 B.K2S C.Na2CO3 D.CuSO4
4、镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电
池的电解质溶液为 KOH 溶液,其充、放电按下式进行:Cd+2NiOOH+
2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A.放电时负极得电子,质量减轻 B.放电时负极附近的 PH 增大
C.充电时该电池的正极与外加电源的负极相连
D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
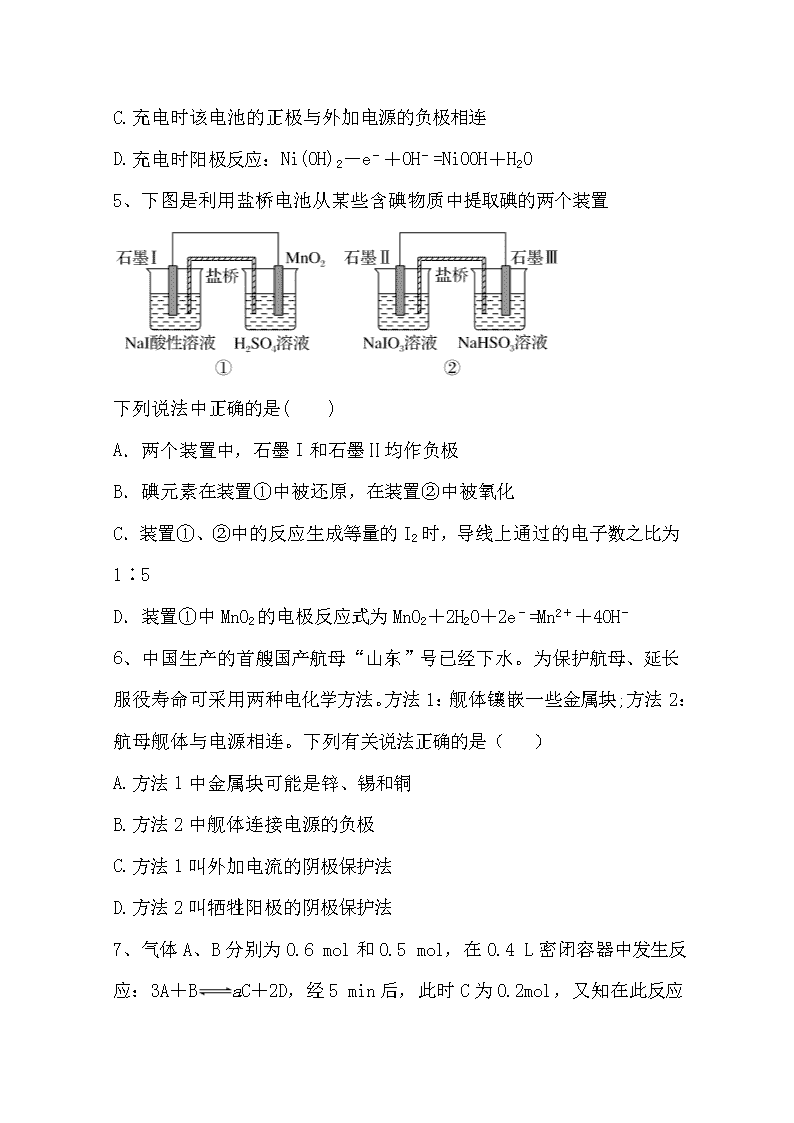
5、下图是利用盐桥电池从某些含碘物质中提取碘的两个装置
下列说法中正确的是( )
A.两个装置中,石墨 I 和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①、②中的反应生成等量的 I2 时,导线上通过的电子数之比为
1∶5
D.装置①中 MnO2 的电极反应式为 MnO2+2H2O+2e-=Mn2++4OH-
6、中国生产的首艘国产航母“山东”号已经下水。为保护航母、延长
服役寿命可采用两种电化学方法。方法 1:舰体镶嵌一些金属块;方法
2:航母舰体与电源相连。下列有关说法正确的是( )
A.方法 1 中金属块可能是锌、锡和铜
B.方法 2 中舰体连接电源的负极
C.方法 1 叫外加电流的阴极保护法
D.方法 2 叫牺牲阳极的阴极保护法
7、气体 A、B 分别为 0.6 mol 和 0.5 mol,在 0.4 L 密闭容器中发生反
应:3A+B aC+2D,经 5 min 后,此时 C 为 0.2mol,又知在此反应
时间内,D 的平均反应速率为 0.1 mol·(L·min)-1,下列结论正确的
是( )
A.A 的平均反应速率为 0.1 mol·(L·min)-1
B.a 值为 2
C.B 的转化率为 50%
D.此时,反应混合物总的物质的量为 1 mol
8、一定温度下,10 mL 0.40 mol·L-1 H2O2 溶液发生催化分解。不同
时刻测得生成 O2 的体积(已折算为标准状况)如下表。
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min 的平均反应速率:v(H2O2)≈3.3×10-2 mol·L-1·min-1
B.6~10 min 的平均反应速率:v(H2O2)<3.3×10-2 mol·L-1·min-1
C.反应至 6 min 时,c(H2O2)=0.30 mol·L-1
D.反应至 6 min 时,H2O2 分解了 50%
9、在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g)+
2NO(g)ΔH>0,达到平衡。当改变其中一个条件 X,Y 随 X 的变化符合
图中曲线的是( )
A.当 X 表示温度时,Y 表示 NO2 的物质的量
B.当 X 表示压强时,Y 表示 NO2 的百分含量
C.当 X 表示反应时间时,Y 表示混合气体的密度
D.当 X 表示 NO2 的物质的量时,Y 表示 O2 的物质的量
10、在恒容密闭容器中,CO 与 H2 发生反应 CO(g)+2H2(g) CH3OH(g)
ΔH<0,达到平衡后,若只改变某一条件,下列示意图正确的是( )
11、下列说法中正确的是( )
A.显酸性的溶液是酸溶液,显碱性的溶液是碱溶液
B.盐促进水的电离,酸碱抑制水的电离
C.常温下,某溶液中水电离出的 H+浓度为 1×10-9 mol/L,该溶液不一定是碱溶
液
D.中性溶液即 pH=7 的溶液
12、25 ℃时,下列溶液的酸性最强的是( )
A.0.01 mol/L 的 HCl 溶液
B.pH=2 的 H2SO4 溶液
C.c(OH-)=10-13 mol/L 的溶液
D.pH=1 的 HNO3 溶液加水稀释为原来的 2 倍
13、在不同温度下,水溶液中 c(H+)与 c(OH-)有如图所示关系。下列
说法正确的是( )
A.c 点对应的溶液 PH=6,显酸性
B.T℃ 下,水的离子积常数为 1×10-12
C.T<25℃
D.纯水仅升高温度,可以从 a 点变到 d
14、常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.由水电离出的 H+浓度为 1×10-9 mol/L 的溶液中:Al3+、SO4
2-、Na+、
Cl-
B.遇酚酞变红的溶液中:NO3
-、Na+、SiO3
2-、K+
C.c(NO3
-)=1mol/L 的溶液中:H+、Fe2+、Cl-、NH4
+
D.pH=1 的溶液中:HCO3
-、SO4
2-、K+、Cl-
15、现有 0.1mol·L-1 氨水 10mL,加蒸馏水稀释到 1L 后,下列变化中
正确的是( )
①电离程度增大②[NH3·H2O]增大③NH +
4 数目增多④[OH-]增大⑤导电
性增强⑥ [NH+
4 ]
[NH3·H2O]增大⑦[NH+
4 ][OH-]
[NH3·H2O] 减小
A.①②③B.①③⑤C.①③⑥ D.②④⑥
16、用黄色的 FeCl3 溶液分别进行下列实验,解释或结论不正确的是
( )
选项 实验 现象 解释或结论
A 加入 FeCl3 固体 溶液变成红褐色 FeCl3 的水解程度变大
B 加入等体积水 溶液颜色变浅 [Fe3+]变小
C 加入足量 Fe 粉 溶液颜色变浅绿色 2Fe3++Fe===3Fe2+
D 将 FeCl3 溶液微热 溶液变成红褐色 水解反应ΔH>0
17、相同温度下,三种酸的电离常数如表,下列判断正确的是( )
酸 HX HY HZ
电离常数 Ka 9×10-7 mol/L 9×10-6 mol/L 2×10-2 mol/L
A. 相同温度下,1mol/LHX 溶液的电离常数大于 0.1mol/LHX
B.相同温度下,0.1mol/L 的 NaX、NaY、NaZ 溶液,NaZ 溶液 pH 最大
C.反应 HZ+Y-= HY+Z-能够发生
D.三种酸的酸性强弱关系:HX>HY>HZ
18、常温下,将 pH=9 和 pH=11 的两种强碱溶液等体积混合,则混合
溶液的 pH 为( )
A.10.7 B.9.3 C.10 D.无法确定
二、非选择题(本题包括 4 个小题,共 66 分)
19、(8 分)
按要求对下列物质进行分类:①HF②Cu③BaSO4④盐酸⑤Al(OH)3⑥乙醇
⑦NH3⑧Ba(OH)2⑨NaHCO3⑩ NH3·H2O(请用相应的序号填 )
(1)属于非电解质的是__________________
( 2 ) 属 于 强 电 解 质 的 是 ___________ ( 3 ) 属 于 弱 电 解 质 的 是
___________
20、(20 分)
(1)写出 NaHSO4 溶液的电离方程式
写出 Na2CO3 水解的离子方程式
(2)25℃时,pH= a 的 NaOH 溶液中, 溶液的 C(OH-) =______ mol/L。
(3)在一定温度下,有 a.盐酸 b.硫酸 c.醋酸三种酸:(请用相应
字母填)
①当三种酸物质的量浓度相同时,c(H+ )由大到小的顺序是
____________。
②同体积、同物质的量浓度的三种酸,中和 NaOH 的能力由大到小的
顺序是_____。
③若三者 PH 相同且体积相等,中和 NaOH 的能力由大到小的顺序是
____________。
(4)有下列盐溶液:
①MgCl2 ②KNO3 ③KClO ④CH3COONH4 ⑤NaCN⑥Fe2(SO4)3(请用相应的
序号填写)。
呈酸性的是________,呈碱性的是________,呈中性的是________
(5)请写出明矾(K Al(SO4)2 .12 H2O)做净水剂净水时的离子方程
式
(6)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生反应的
离子方程式:
(7)物质的量浓度相同的
①氯化铵;② 碳酸氢氨;③ 硫酸氢氨;④硫酸氨 4 种溶液中,c(NH4
+)
由大到小的顺序是_____ (请用相应的序号填写)
21、(11 分)
人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着
越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都
离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污
染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海
水之间含盐量的差别进行发电,在海水中电池反应可表示为:
5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl
① 该 电 池 的 负 极 反 应 式 是
________________________________________
②在电池中,Na+不断移动到“水”电池的________极(填“正”或
“负”)
③外电路每通过 4 mol 电子时,生成 Na2Mn5O10 的物质的量是________
(2)中国科学院应用化学研究所在甲醇(CH3OH 是一种可燃物)燃料电池
技术方面获得新突破。甲醇燃料电池的工作原理如图所示。
①该电池工作时,b 口通入的物质为________________
②该电池负极的电极反应式________________
③工作一段时间后,当 6.4 g 甲醇完全反应生成 CO2 时,有________
个电子转移。
(3)Ag2O2 是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶
液为 KOH 溶液,电池放电时正极的 Ag2O2 转化为 Ag,负极的 Zn 转化为
K2Zn(OH)4 , 写 出 该 电 池 反 应 方 程 式 :
__________________________________________
22、(10 分))二氧化锰是化学工业中常用的氧化剂和催化剂。我国主
要以贫菱锰矿(有效成分为 MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s) MnO(s)+CO2(g) △H1=+amol/L
ii 2MnO(s)+O2(g) 2MnO2(s) △H2=+bmol/L
①反应 i 的化学平衡常数表达式 K ___________
②焙烧 MnCO3 制取 MnO2 的热化学方程式是_________________
(2)焙烧(装置如图 1)时持续通入空气,并不断抽气的目的是
________________
(3)在其他条件不变时,某科研团队对影响转化率的生产条件进行了
研究,结果如图 2、图 3 所示。
①常压下,要提高 MnCO3 的转化率,应选择的生产条件是____________
焙烧 6 8 h 。
②图 3 中,焙烧 8h 时,MnCO3 的转化率:干空气<湿空气,原因是
______________。
23、(10 分)根据环保要求,在处理有氰电镀废水时,剧毒的 CN-离子
在催化剂 TiO2 颗粒作用下,先用 NaClO 将 CN-离子氧化成 CNO-(CN-和
CNO-中 N 元素均为-3 价),再在酸性条件下继续与 NaClO 反应生成 N2、
CO2 和 Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定 CN-
被处理的百分率。
现将浓缩后含 CN-离子的污水与过量 NaClO 溶液的混合液倒入甲中,塞
上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,
关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应
_________________,乙中的反应:_____________________。
(2)上述实验是通过测定 CO2 的量来确定对 CN-的处理效果。
丙 装 置 中 的 试 剂 是 ______________ , 丁 装 置 的 目 的 是
________________________ ; 干 燥 管 Ⅱ 的 作 用 是
______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的 CN-被处
理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的
原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰
性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反
应式是___________________。
24、(10 分))亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验 Fe3+,
也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3
=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式
(2)与 CN-互为等电子体的分子是_______,K4[Fe(CN)6]中的作用力除离
子键和共价键外,还有___________。含有 12mol σ键的 KFe[Fe(CN)6]
的物质的量为___________mol。
(3)黄血盐中 C 原子的杂化方式为______;C、N、O 的第一电离能由大
到小的排序为________,
(4)Fe、Na、K 的晶体结构如图所示。
①钠的熔点比钾更高,原因是_____________。
②Fe 原子半径是 r cm,阿伏加德罗常数为 NA,铁的相对原子质量为 a,
则铁单质的密度是_______g/cm3。
答题卡
1 2 3 4 5 6 7 8 9
C C C D C B B C A
10 11 12 13 14 15 16 17 18
B C C B B C A C A
19、(6 分)(1)⑥⑦(2)③⑧⑨(3)①⑤⑩
(每问两分,多选不给分,选对一个给 1 分)
20(18 分)(没有标注的给 1 分)
(1)NaHSO4=Na++H++SO4
2- CO3
2-+H2O HCO3
-+OH-(写出第一步即可)
(2)10 a -14mol/L
(3)①b>a>c ②b>a=c ③c>a=b
(4)①⑥, ③⑤,②④,(每问两分,多选不给分,选对一个给 1 分)
(5)Al3++3H2O Al(OH)3+3H+(2 分)
(6)Al3++3HCO3
- =3CO2↑+Al(OH)3↓(2 分)
(7)④> ③> ①>②(2 分)
21、(10 分)
(1)①Ag-e-+Cl-===AgCl(1 分) ②正(1 分) ③2 mol (1 分)
(2)①CH3OH (1 分)②CH3OH-6e-+H2O===CO2+6H+(2 分)③1.2NA(2
分)
(3)Ag2O2+2Zn+4KOH+2H2O===2K2Zn(OH)4+2Ag(2 分)
22、(10 分)(各 2 分)
(1)① 2c CO 或[CO2]
②2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g) △H1=+(2a+b)mol/L
(2)保持 2O 的浓度,降低 2CO 的浓度,使平衡正向移动,提高碳酸锰的
转化率 (3) ①湿空气中, 0350 C 左右 ② 干空气中没有催化
剂,反应速率比湿空气中慢,8h 时未达到平衡。
23、(12 分)
(1)CN-+ClO-
2TiO
CNO-+Cl- ,2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O
(各 2 分)
(2)浓硫酸 ;(1 分)除去 Cl2;(1 分)
防止空气中的 CO2、水蒸气进入干燥管 I,影响 CO2 的测量(2 分)
(3)偏低(1 分);前面装置中残留有 CO2 未被完全吸收(1 分)
(4) CN- +12OH--10e- =2CO3
2- +N2↑+6H2O (2 分)
24、(10 分)
(1)1S22 S22P63 S23 P63d5 (2)N2 配位键 ;1(3)sp;N>O>C ; (4)
① K 和 Na 的价电子数相同,但 Na 原子半径小于 K 原子半径,所以 Na
金属键更强,熔点更高(2 分) ② 3
A
3 3a
32N r (2 分)