- 292.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题限时集训(十三) 物质结构与性质(选修③)
(限时:45分钟)
(对应学生用书第153页)
1.(2019·唐山模拟)原子序数依次增大的四种元素A、B、C、D分别依次处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为________________________,第一电离能最小的元素是________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________________________(填化学式)。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为________;另一种的晶胞如图二所示,该晶胞的空间利用率为________。
图一 图二 图三
(4)D元素形成的单质,其晶体的堆积模型为________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键
③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是
______________________________________________________
_____________________________________________________。
请写出上述过程的离子方程式:__________________________
______________________________________________________,
_____________________________________________________。
[解析] 原子序数依次增大的四种元素A、B、C、D分别依次处于第一至第四周期,自然界中存在多种A的化合物,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为铜元素;结合原子序数可知,C只能处于第三周期,B与C可形成正四面体形分子,则C为氯元素。(3)图一为石墨的平面结构,在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化;图二为金刚石的晶胞,一个晶胞中含碳原子数为8×+6×+4=8,令碳原子直径为a,晶胞中C原子总体积=8×π()3,碳原子与周围的4个原子形成正四面体结构,中心碳原子与正四面体顶点原子相邻,中心碳原子到底面距离为,则正四面体的高为(a+)=,设正四面体的棱长为x,则斜面的高为x,底面中心到边的距离为x×,再根据勾股定理:()2+(x×)2=(x)2,整理得x=,故晶胞棱长=×=,则晶胞体积为()3,晶胞空间利用率={[8×π()3]÷()3}×100%=π≈34%。
[答案] (1) Cu (2)HF>HI>HBr>HCl (3)sp2 34% (4)面心立方最密堆积 ①②③ (5) 首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液 Cu2++2NH3·H2O===Cu(OH)2↓+2NH Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
2.(2019·武汉模拟)磷及其化合物与人们的健康和生活密切相关。请回答下列问题:
(1)基态磷原子价电子轨道表示式为________,其第一电离能比硫的________(填“大”或“小”)。
(2)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为________,PO
的立体构型为________,该化合物所含元素电负性最大的是________。
(3)P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键数目是________。
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为________,其为________元酸,原因是____________________
_____________________________________________________。
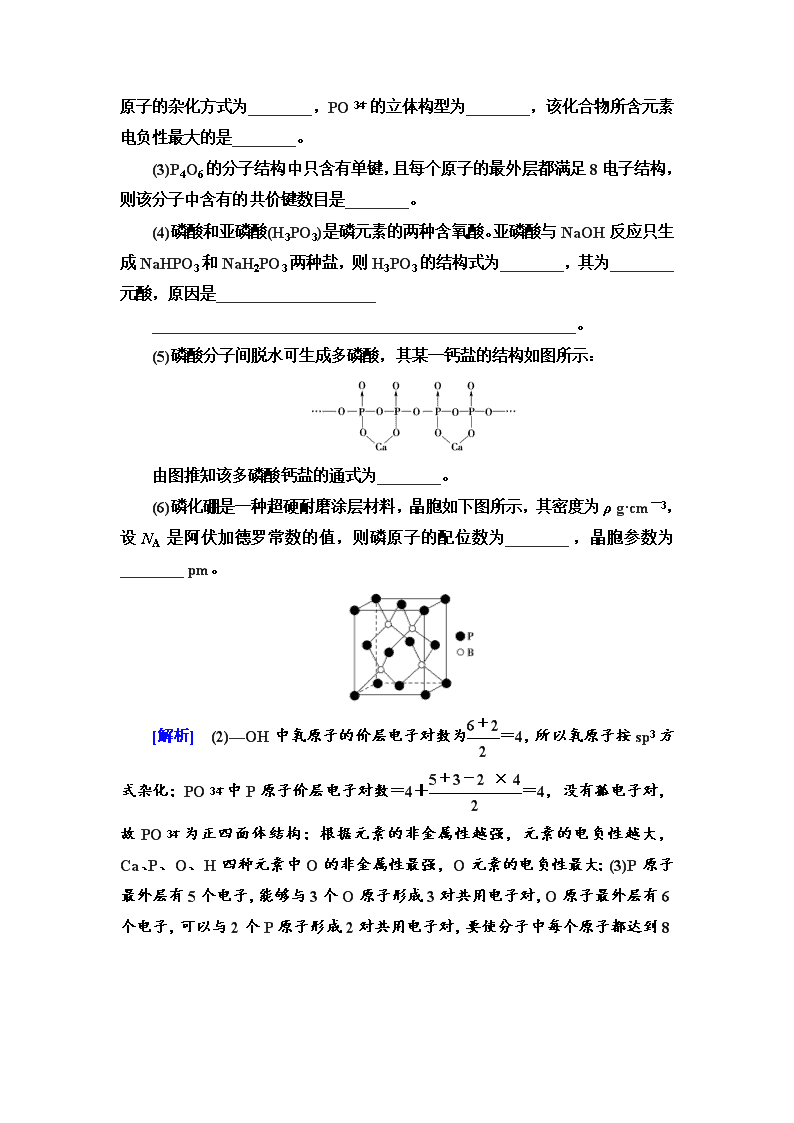
(5)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
由图推知该多磷酸钙盐的通式为________。
(6)磷化硼是一种超硬耐磨涂层材料,晶胞如下图所示,其密度为ρ g·cm-3,设NA是阿伏加德罗常数的值,则磷原子的配位数为________,晶胞参数为________ pm。
[解析] (2)—OH中氧原子的价层电子对数为=4,所以氧原子按sp3方式杂化;PO中P原子价层电子对数=4+=4,没有孤电子对,故PO为正四面体结构;根据元素的非金属性越强,元素的电负性越大, Ca、P、O、H四种元素中O的非金属性最强,O元素的电负性最大;(3)P原子最外层有5个电子,能够与3个O原子形成3对共用电子对,O原子最外层有6个电子,可以与2个P原子形成2对共用电子对,要使分子中每个原子都达到8电子稳定结构,其结构式为
,可见分子中含有的共价键为12个;(4)亚磷酸与NaOH溶液发生酸碱中和反应只生成NaHPO3和NaH2PO3两种盐,羟基H原子能电离产生H+,说明H3PO3分子中含有2个—OH,它属于二元酸,由于P最外层有5个电子,则结构式为POHOOHH或POHOOHH;(5)由图推知该多磷酸钙盐最小的重复单元是CaP2O6,所以该多磷酸钙盐的通式为(CaP2O6)n;(6)根据晶体结构可知每个B原子被四个距离相等且最近的P原子包围,每个P原子被四个距离相等且最近的B原子包围,所以P原子的配位数是4;在一个晶胞中含有的P原子数目:8×+6×=4,在一个晶胞中含有的B原子数目:4×1=4,即1个晶胞中含有4个BP,晶胞的质量是m== g,由于晶胞密度为ρ g·cm-3,所以晶胞的体积为== cm3,所以晶胞参数为 cm=×1010 pm。
[答案] (1) 大 (2) sp3 正四面体形 O(或氧元素) (3)12 (4) 二 一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离 (5) (CaP2O6)n (6)4 ×1010
3.(2019·张家口模拟)Se是迄今为止发现的最重要的抗衰老元素,也有抗癌之王的美誉。回答下列问题:
(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有________个;第四周期的过渡金属中,基态原子核外未成对电子数与基态Se原子相同的有________种。
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为__________________________。
(3)H2Se属于________(填“极性”或“非极性”)分子;其熔点低于同条件下NaH熔点的原因为__________________________
_____________________________________________________。
(4)SeO2的立体构型为________;SeO3中Se原子的杂化形式为________。
(5)写出一种与SeO互为等电子体的分子式________。
(6)Se能与形成具有多种生物活性的配合物。1 mol 中含有σ键的数目为________。
(7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为a pm,阿伏加德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为________(列出计算式即可)。
[解析] (3)H2Se分子内为极性共价键,根据价层电子对互斥理论可知,该分子价层电子对数为4,有2对孤电子对,则其分子的立体构型为V形,极性键的极性向量和不等于零,所以该分子为极性分子,又因为NaH形成的晶体为离子晶体,而H2Se形成的晶体属于分子晶体,所以其熔沸点较NaH低。(6)根据上述分析可知,1 mol 分子中σ键数目等于共价键数,所以σ键数目总数=2×12 mol(苯环上)+5×1 mol(酚羟基) +5×1 mol(杂环)= 34 mol。(7)设硒化锌的摩尔质量为M g·mol-1,该晶胞中含有硒原子数为8×+6×=4,含有锌原子数为4,其化学式可表示为ZnSe,根据晶胞中ρ=可得,ρ= ,化简整理得M=。
[答案] (1)9 2 (2)Br>As>Se (3)极性 H2Se形成的晶体属于分子晶体,NaH形成的晶体为离子晶体 (4)V形 sp2 (5)CX4、SiX4
(X代表卤原子)等中的一种 (6) 34NA (7) g·mol-1
4.(2019·德州模拟)镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________。
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2===CH—CH2OH)的绿色高效合成。丙烯醇中碳原子的杂化类型有________________;丙醛(CH3CH2CHO)与丙烯醇(CH2===CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是______________________________________________________
_____________________________________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉。羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为________。
(4)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3 的立体构型为________;与SCN-互为等电子体的分子有____________________(填分子式)。
(5)“NiO”晶胞如图:
①氧化镍晶胞中原子坐标参数A为(000),B为(110),则C原子坐标参数为_____________________________________________________。
②已知氧化镍晶胞密度d g·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为________ nm(用代数式表示)。
[解析] (2)丙烯醇中碳原子形成了一个碳碳双键,其余为碳氧、碳氢单键,所以C原子的杂化类型有sp2和sp3杂化,丙醛(CH3CH2CHO)与丙烯醇(CH2===CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,是因为丙烯醇分子间存在氢键。 (4)NH3分子中N原子是sp3杂化,且具有一对孤对电子,则NH3的立体构型为三角锥形,与SCN-互为等电子体的分子有N2O或CO2。 (5)①
晶胞是正方体结构,且氧化镍晶胞中原子坐标参数A为(000),B为(110),则C原子坐标参数为(,11);②已知氧化镍晶胞密度d g·cm-3,设Ni2+半径为r nm,O原子半径为x nm,晶胞的参数为a nm,一个晶胞中含有4个NiO,则m(晶胞)= g,V(晶胞)=a3,则可以得到(a×107)3·d=,a=×107 nm,又因为晶胞对角线3个O原子相切,晶胞参数a=2x+2r,即4x=a,x=a,带入计算可得到r=-a=××107 nm。
[答案] (1)3d84s2 (2)sp2、sp3 丙烯醇中分子间存在氢键 (3)O>C>Ni (4)三角锥形 N2O或CO2
(5) ××107
5.(2019·厦门模拟)钴及其化合物在生产生活中有广泛的应用。回答下列问题:
(1)基态钴原子价电子排布式为________。
(2)Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为______________________________________________________
_____________________________________________________。
(3)[Co(NO)4]2-中Co2+的配位数为4,配体中N的杂化方式为________,该配离子中各元素I1由小到大的顺序为________(填元素符号),1 mol该配离子中含σ键数目为________NA。
(4)八面体配合物CoCl3·3NH3结构有________种,其中极性分子有________种。
(5)配合物Co2(CO)8的结构如下图,该配合物中存在的作用力类型有________(填字母)。
A.金属键 B.离子键
C.共价键 D.配位键
E.氢键 F.范德华力
(6)钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为________,晶体中Al3+占据O2-形成的________(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为________ g·cm-3(列出计算式,不必计算)。
[解析] (3)配体NO中心原子N的价电子层电子为3对,为平面三角形,杂化方式为sp2;非金属性越强,第一电离能越大,由于N的电子排布是半满稳定结构,所以第一电离能大于O,所以I1由小到大的顺序为Co<O<N;硝酸根中σ键有3个,则一个[Co(NO)4]2-离子中含σ键数目为4+3×4=16,则1 mol该配离子中含σ键数目为16NA。(4)根据八面体的立体构型知,配合物CoCl3·3NH3结构有2种,因为不能形成对称结构,其中极性分子也是2种。(6)根据钴蓝晶体晶胞结构分析,一个晶胞中含有的Co、Al、O个数分别为8×+6×+4=84×4=168×4=32,所以化学式为CoAl2O4;根据结构观察,晶体中Al3+占据O2-形成的八面体空隙;该晶胞的体积为(2a×10-7)3 cm3,该晶胞的质量为(32×16+16×27+8×59)/NA= g,则钴蓝晶体的密度为 g·cm-3。
[答案] (1)3d74s2 (2)Co3+可与NH3形成较稳定的配合物 (3)sp2 CoGe>Zn
(5)sp3 共价键
(6)×107