- 132.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题十 电化学基础
1.如图是某同学设计的铜锌原电池装置,实验时,观察到滤纸上紫色小点向A极移动。下列说法不正确的是( )
A.A为Zn片,发生氧化反应
B.电子由B经导线移向A
C.B电极发生的电极反应式为2H++2e-===H2↑
D.若将Cu片移出滤纸,锌片会继续溶解
答案 B
解析 A项,原电池中阴离子向负极移动,MnO向A极移动,则A极为Zn,作为原电池的负极,正确;B项,电子由A(负极)经导线流向B(正极),错误;C项,H+在Cu电极上得电子,正确;D项,Zn会与滤纸上的稀硫酸反应而溶解,正确。
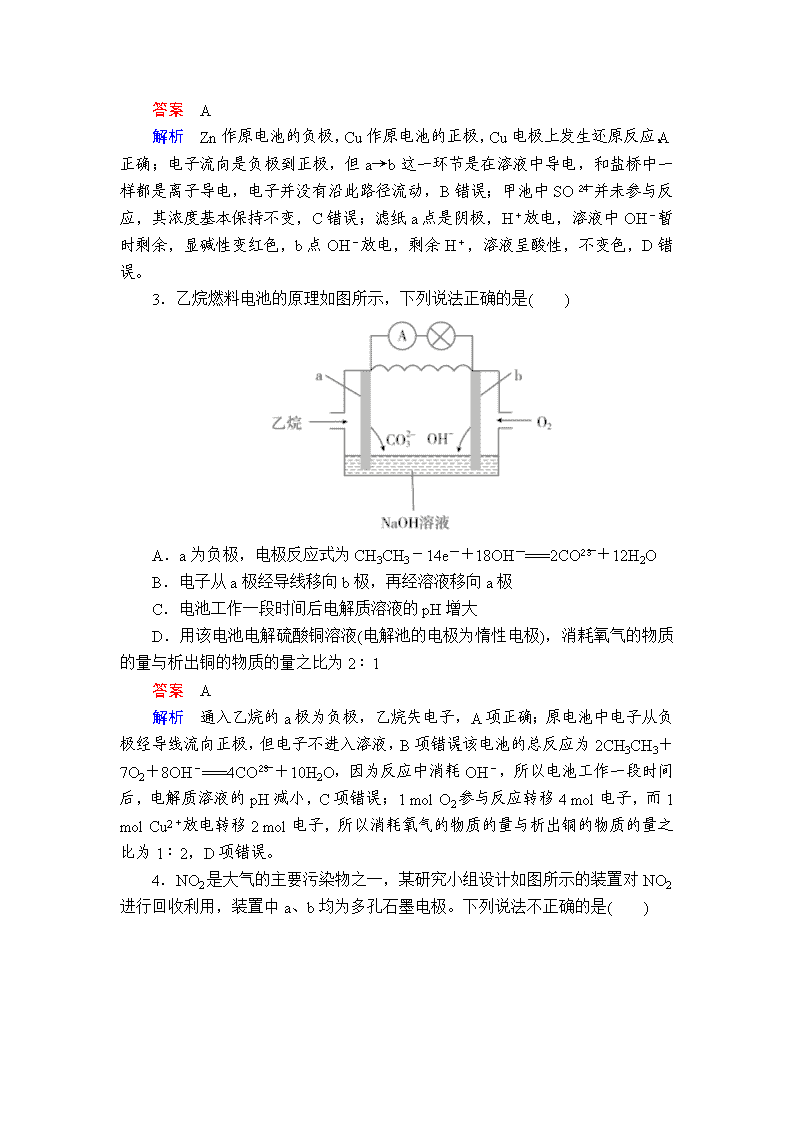
2.将下图所示实验装置的K闭合,下列判断正确的是( )
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO)增大
D.片刻后可观察到滤纸b点变红色
答案 A
解析 Zn作原电池的负极,Cu作原电池的正极,Cu电极上发生还原反应,A正确;电子流向是负极到正极,但a→b这一环节是在溶液中导电,和盐桥中一样都是离子导电,电子并没有沿此路径流动,B错误;甲池中SO并未参与反应,其浓度基本保持不变,C错误;滤纸a点是阴极,H+放电,溶液中OH-暂时剩余,显碱性变红色,b点OH-放电,剩余H+,溶液呈酸性,不变色,D错误。
3.乙烷燃料电池的原理如图所示,下列说法正确的是( )
A.a为负极,电极反应式为CH3CH3-14e-+18OH-===2CO+12H2O
B.电子从a极经导线移向b极,再经溶液移向a极
C.电池工作一段时间后电解质溶液的pH增大
D.用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2∶1
答案 A
解析 通入乙烷的a极为负极,乙烷失电子,A项正确;原电池中电子从负极经导线流向正极,但电子不进入溶液,B项错误;该电池的总反应为2CH3CH3+7O2+8OH-===4CO+10H2O,因为反应中消耗OH-,所以电池工作一段时间后,电解质溶液的pH减小,C项错误;1 mol O2参与反应转移4 mol电子,而1 mol Cu2+放电转移2 mol电子,所以消耗氧气的物质的量与析出铜的物质的量之比为1∶2,D项错误。
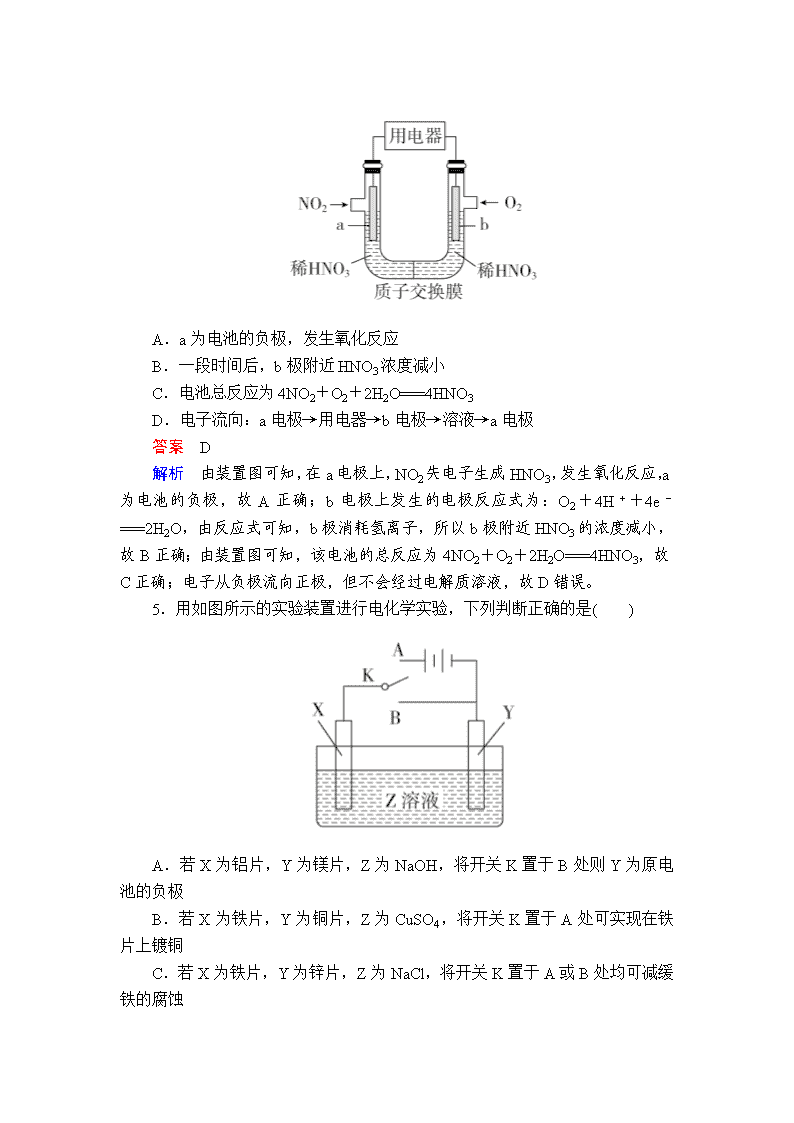
4.NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2进行回收利用,装置中a、b均为多孔石墨电极。下列说法不正确的是( )
A.a为电池的负极,发生氧化反应
B.一段时间后,b极附近HNO3浓度减小
C.电池总反应为4NO2+O2+2H2O===4HNO3
D.电子流向:a电极→用电器→b电极→溶液→a电极
答案 D
解析 由装置图可知,在a电极上,NO2失电子生成HNO3,发生氧化反应,a为电池的负极,故A正确;b电极上发生的电极反应式为:O2+4H++4e-===2H2O,由反应式可知,b极消耗氢离子,所以b极附近HNO3的浓度减小,故B正确;由装置图可知,该电池的总反应为4NO2+O2+2H2O===4HNO3,故C正确;电子从负极流向正极,但不会经过电解质溶液,故D错误。
5.用如图所示的实验装置进行电化学实验,下列判断正确的是( )
A.若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B.若X为铁片,Y为铜片,Z为CuSO4,将开关K置于A处可实现在铁片上镀铜
C.若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D.若X、Y均为碳棒,Z为NaOH,将开关K置于A处,Y极发生的反应为2H++2e-===H2↑
答案 D
解析 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处,形成原电池,发生的反应为铝与氢氧化钠溶液反应,则铝为原电池的负极,A项错误;若X为铁片,Y为铜片,Z为CuSO4,将开关K置于A处,形成电解池,铁为阳极,铜为阴极,不能实现在铁片上镀铜,B项错误;若X为铁片,Y为锌片,Z为NaCl,将开关K置于A处,形成电解池,铁为阳极,腐蚀速率加快,C项错误;若X、Y均为碳棒,Z为NaOH,将开关K置于A处,构成电解池,本质上是电解水,Y极为阴极,Y极发生的反应为2H++2e-===H2↑,D项正确。
6.某化学研究性学习小组的同学在学习了电化学相关知识后,将所学知识整合得到如图所示装置,用于电解饱和食盐水。
请回答下列问题:
(1)甲池中Al极为________极,乙池中C2极为________极。
(2)甲池中发生反应的总化学方程式为_________________________。
(3)若向乙池中滴加酚酞试液,则C1极附近观察到的现象为__________,
C2极的电极反应式为_______________________________________________
________________________________________________________________。
(4)当C1极析出224 mL(标准状况)气体时,转移电子的物质的量为________。
答案 (1)负 阳
(2)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(3)产生无色气体,溶液变红 2Cl--2e-===Cl2↑
(4)0.02 mol
解析 (1)由图可知,甲池为原电池,乙池为电解池,甲池中,由于电解质是氢氧化钠,Al失电子,故Al为负极,Mg为正极,乙池中C2极与原电池的正极相连,为阳极。
(2)甲池中铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的总化学方程式为2Al+2H2O+2NaOH===2NaAlO2+3H2↑。
(3)乙池为电解饱和食盐水的装置,C1极为阴极,得电子发生还原反应:2H2O+2e-===H2↑+2OH-,若向乙池中滴加酚酞试液,则C1极附近观察到的现象为产生无色气体,溶液变红,C2极是阳极,失电子发生氧化反应:2Cl--2e-===Cl2↑。
(4)C1极析出224 mL氢气,物质的量为0.01 mol,根据电极反应式,转移电子的物质的量为0.02 mol。