- 1.48 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
8
讲 水溶液中的离子平衡
-
2
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
考点一
溶液中的
“
三大平衡
”
及其影响因素
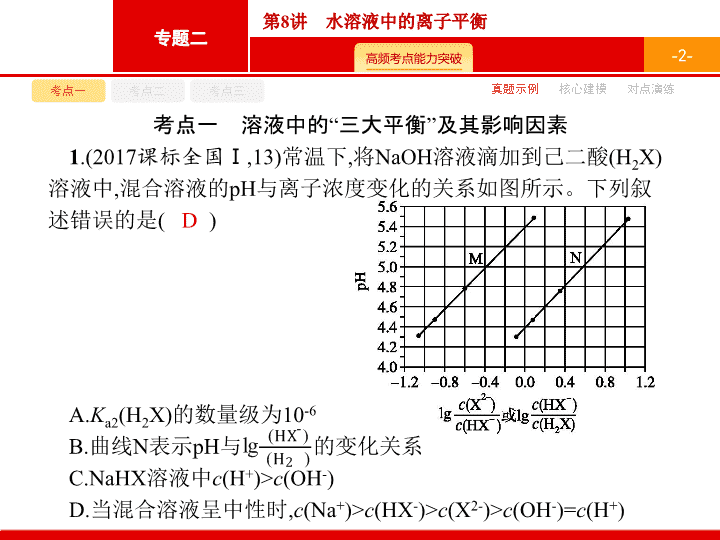
1
.(2017
课标全国
Ⅰ
,13)
常温下
,
将
NaOH
溶液滴加到己二酸
(H
2
X)
溶液中
,
混合溶液的
pH
与离子浓度变化的关系如图所示。下列叙述错误的是
(
)
A.
K
a2
(H
2
X)
的数量级为
10
-6
B.
曲线
N
表示
pH
与
的变化关系
C.NaHX
溶液中
c
(H
+
)>
c
(OH
-
)
D.
当混合溶液呈中性时
,
c
(Na
+
)>
c
(HX
-
)>
c
(X
2-
)>
c
(OH
-
)=
c
(H
+
)
D
-
3
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
-
4
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
2
.(2017
课标全国
Ⅱ
,12)
改变
0.1 mol·L
-1
二元弱酸
H
2
A
溶液的
pH,
溶液中
H
2
A
、
HA
-
、
A
2-
的物质的量分数
δ
(X)
随
pH
的变化如图所示
。
下列叙述错误的是
(
)
A.pH=1.2
时
,
c
(H
2
A)=
c
(HA
-
)
B.lg[
K
2
(H
2
A)]=-4.2
C.pH=2.7
时
,
c
(HA
-
)>
c
(H
2
A)=
c
(A
2-
)
D.pH=4.2
时
,
c
(HA
-
)=
c
(A
2-
)=
c
(H
+
)
D
-
5
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
-
6
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
3
.(2016
课标全国
Ⅰ
,12)298 K
时
,
在
20.0 mL 0.10 mol·L
-1
氨水中滴入
0.10 mol·L
-1
的盐酸
,
溶液的
pH
与所加盐酸的体积关系如图所示。已知
0.10 mol·L
-1
氨水的电离度为
1.32%,
下列有关叙述正确的是
(
)
A.
该滴定过程应该选择酚酞作为指示剂
B.M
点对应的盐酸体积为
20.0 mL
C.M
点处的溶液中
c
(
)=
c
(Cl
-
)=
c
(H
+
)=
c
(OH
-
)
D.N
点处的溶液中
pH<12
D
-
7
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
-
8
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
4
.(2016
课标全国
Ⅲ
,13)
下列有关电解质溶液的说法正确的是
(
)
D
-
9
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
-
10
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
D
-
11
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
解析
:
由图像知
,0.10
mol
·
L
-1
的
MOH
溶液的
pH
为
13,
说明
MOH
为强碱
,ROH
溶液的
pH
小于
13,
说明
ROH
为弱碱
,
所以
MOH
的碱性强于
ROH
的碱性
,A
选项正确
;
稀释有利于弱电解质的电离
,
故
B
选项正确
;
若两溶液无限稀释则接近中性
,
则它们的
c
(OH
-
)
相等
,C
选项正确
;
当
时
,MOH
溶液的
pH
为
11,ROH
溶液的
pH
为
10,
若两溶液同时升高温度
,ROH
溶液中存在电离平衡
,
平衡会右移
,
c
(R
+
)
增大
,
c
(M
+
)
不变
,
故比值减小
,D
项错误。
-
12
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
1
.
电离平衡与水解平衡的
比较
-
13
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
-
14
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
2
.
沉淀溶解平衡的应用
实例
-
15
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
-
16
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
误区警示
1
.“
电离平衡
”
分析判断中的常见误区
(1)
忽视电离平衡的微弱思想
,
误认为弱电解质在加水稀释的过程中
,
电离程度增大
,
电离出的离子浓度增大。
(2)
忽视水的电离平衡的存在
,
误认为弱电解质在加水稀释的过程中
,
溶液中离子浓度都减小。
(3)
误认为电离平衡正向移动
,
弱电解质的电离程度一定增大。如向醋酸溶液中加入少量冰醋酸
,
平衡向电离方向移动
,
但醋酸的电离程度减小。
(4)
误认为由水电离出的
c
(H
+
)=1.0×10
-13
mol
·
L
-1
的溶液一定呈碱性。如
25
℃
,0.1
mol
·
L
-1
的盐酸或氢氧化钠溶液中由水电离的
c
(H
+
)
都为
1.0×10
-13
mol
·
L
-1
。
-
17
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
2
.“
水解平衡
”
常见的认识误区
(1)
误认为水解平衡向正向移动
,
离子的水解程度一定增大。如向
FeCl
3
溶液中加入少量
FeCl
3
固体
,
平衡向水解方向移动
,
但
Fe
3+
的水解程度减小。
(2)
由于加热可促进盐类水解
,
错误地认为可水解的盐溶液在蒸干后都得不到原溶质。其实不一定
,
对于那些水解程度不是很大
,
水解产物离不开平衡体系的情况
[
如
Al
2
(SO
4
)
3
、
NaAlO
2
、
Na
2
CO
3
]
来说
,
溶液蒸干后仍得原溶质。
-
18
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
1
.(2017
广东广州二模
)25
℃
时
,pH=2
的
HA
和
HB
各
1 mL
分别加水稀释
,pH
随溶液体积变化如图所示。下列叙述正确的是
(
)
A.
K
W
的数值
:
a
点大于
c
点
B.
溶液中的总酸量
:
a
点大于
b
点
C.HB
的电离程度
:
b
点大于
c
点
D.
将
a
点与
b
点两溶液同时升高温度
,
则
减小
D
-
19
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
解析
:
两种酸开始时
pH
均为
2,
稀释
1×10
3
倍后
HA
pH=5,
而
HB
pH<5,
所以
HA
为强酸
,HB
为弱酸。
25
℃
时
,
K
W
=1×10
-14
是一个常数
,A
错误。两种酸开始
pH=2,HB
为弱酸
,
所以溶液中的总酸量
a
点小于
b
点
,B
错误。稀释促进电离
,HB
的电离程度
:
c
点大于
b
点
,C
错误。将
a
点与
b
点两溶液同时升高温度
,
因为
HA
是强酸
,
所以
c
(A
-
)
不变
,HB
为弱酸
,
升高温度促进电离
,
c
(B
-
)
增大
,
所以
减小
,D
正确。
-
20
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
2
.(2017
江西九江模拟
)25
℃
时
,
向
100 mL 0.1 mol·L
-1
NH
4
HSO
4
溶液中滴加
0.1 mol·L
-1
NaOH
溶液
,
得到的溶液
pH
与
NaOH
溶液体积的关系曲线如图
(H
2
SO
4
视为二元强酸
)
。下列说法错误的是
(
)
D
-
21
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
-
22
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
3
.(2017
甘肃平凉二模
)
下列各表述与示意图一致的是
(
)
-
23
-
考点一
考点二
真题示例
核心建模
对点演练
考点三
A.
图
①
表示
25
℃
时
,
用
0.1 mol·L
-1
盐酸滴定
20 mL 0.1 mol·L
-1
NaOH
溶液
,
溶液的
pH
随加入盐酸体积的变化
B.
图
②
中曲线表示反应
N
2
(g)+O
2
(g) 2NO(g)
Δ
H
>0,
正、逆反应速率随温度的变化
C.
图
③
中曲线表示
10 mL 0.01 mol·L
-1
醋酸的电离度
α
随加水量的变化
D.
图
④
中曲线表示
AgCl
的溶度积
K
sp
随盐酸浓度
c
(HCl)
的变化
答案
解析
解析
关闭
强酸与强碱的滴定终点
,pH
会发生较明显变化
,
有一个突变区间
,A
错误。随着温度升高
,
正、逆反应速率都在增大
,B
错误。弱电解质的电离度随着加水量增加逐渐增大
(
越稀越电离
),C
正确。
K
sp
不受反应物浓度的影响
,
只受温度的影响
,D
错误。
答案
解析
关闭
C
-
24
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
考点二
溶液中的
“
四大平衡常数
”
1
.(2017
课标全国
Ⅰ
,27
节选
)Li
4
Ti
5
O
12
和
LiFePO
4
都是锂离子电池的电极材料
,
可利用钛铁矿
(
主要成分为
FeTiO
3
,
还含有少量
MgO
、
SiO
2
等杂质
)
来制备。工艺流程如下
:
回答下列问题
:
若
“
滤液
②
”
中
c
(Mg
2+
)=0.02 mol·L
-1
,
加入双氧水和磷酸
(
设溶液体积增加
1
倍
),
使
Fe
3+
恰好沉淀完全即溶液中
c
(Fe
3+
)=1.0×10
-5
mol·L
-1
,
此时是否有
Mg
3
(PO
4
)
2
沉淀生成
?
(
列式计算
)
。
FePO
4
、
Mg
3
(PO
4
)
2
的
K
sp
分别为
1.3×10
-22
、
1.0×10
-24
。
-
25
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
-
26
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
2
.(2017
课标全国
Ⅲ
,13)
在湿法炼锌的电解循环溶液中
,
较高浓度的
Cl
-
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入
Cu
和
CuSO
4
,
生成
CuCl
沉淀从而除去
Cl
-
。根据溶液中平衡时相关离子浓度的关系图
,
下列说法错误的是
(
)
A.
K
sp
(CuCl)
的数量级为
10
-7
B.
除
Cl
-
反应为
Cu+Cu
2+
+2Cl
-
==2CuCl
C.
加入
Cu
越多
,Cu
+
浓度越高
,
除
Cl
-
效果越好
D.2Cu
+
==Cu
2+
+Cu
平衡常数很大
,
反应趋于完全
C
-
27
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
-
28
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
答案
:
8.7×10
-7
N
2
H
6
(HSO
4
)
2
-
29
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
答案
:
4.7×10
-7
-
30
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
水的离子积常数、电离平衡常数、水解平衡常数、溶度积常数是溶液中的四大常数
,
它们均只与温度有关。电离平衡常数、水解平衡常数和水的离子积常数随着温度的升高而增大
,
因为弱电解质的电离和水的电离、水解反应均为吸热过程。有关常数的计算
,
要紧紧围绕它们只与温度有关
,
而不随其离子浓度的变化而变化来进行。
(1)CH
3
COONa
、
CH
3
COOH
混合溶液中
,
K
a
、
K
h
、
K
W
的关系是
K
W
=
K
a
·
K
h
。
(2)M(OH)
n
悬浊液中
K
sp
、
K
W
、
pH
间关系
-
31
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
方法技巧
溶度积规则
当
Q
c
>
K
sp
时
,
溶液过饱和
,
有沉淀析出
,
直至溶液饱和
,
达到新的平衡
;
当
Q
c
=
K
sp
时
,
溶液饱和
,
沉淀与溶解处于平衡状态
;
当
Q
c
<
K
sp
时
,
溶液未饱和
,
无沉淀析出
,
若加入过量难溶电解质
,
难溶电解质溶解直至溶液饱和。
-
32
-
考点一
考点二
考点三
真题示例
核心建模
对点演练
D
-
33
-
考点一
考点二
考点三
真题示例
核心建模
对点演练
-
34
-
考点一
考点二
考点三
真题示例
核心建模
对点演练
D
-
35
-
考点一
考点二
考点三
真题示例
核心建模
对点演练
-
36
-
考点一
考点二
考点三
真题示例
核心建模
对点演练
D
-
37
-
考点一
考点二
考点三
真题示例
核心建模
对点演练
解析
:
用
0.1
mol
·
L
-1
的盐酸滴定
0.1
mol
·
L
-1
的氨水时
,
恰好完全反应时生成的氯化铵水解溶液显酸性
,
应该选用在酸性条件下变色的指示剂
,A
错误。
0.2
mol
·
L
-1
的醋酸与
0.1
mol
·
L
-1
的氢氧化钠溶液等体积混合
,
反应后溶液中含有等物质的量的醋酸和醋酸钠
,
根据电荷守恒
,
c
(CH
3
COO
-
)+
c
(OH
-
)=
c
(Na
+
)+
c
(H
+
),
因为醋酸钠水解
,
c
(CH
3
COOH
)>
c
(Na
+
),
因此
c
(CH
3
COO
-
)+
c
(OH
-
)<
c
(CH
3
COOH
) +
c
(H
+
),B
错误。
pH=3
的醋酸与
pH=11
的氨水等体积混合
,
反应后溶液显中性
,
但醋酸铵水解
,
促进水的电离
,
所得溶液中有水电离出的
H
+
,
c
(H
+
)>1×10
-7
mol
·
L
-1
,C
错误。
pH=3
的盐酸与
pH=11
的氨水等体积混合
,
反应后溶液中氨水过量
,
氨水的电离程度大于氯化铵的水解程度
,
溶液显碱性
,
所得溶液中
c
(NH
3
·
H
2
O)>
c
(
)>
c
(Cl
-
),D
正确。
-
38
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
考点三
酸碱中和滴定原理及其应用
1
.(2017
课标全国
Ⅱ
,28
节选
)
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下
:
Ⅰ
.
取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与
Mn(OH)
2
碱性悬浊液
(
含有
KI)
混合
,
反应生成
MnO(OH)
2
,
实现氧的固定。
Ⅱ
.
酸化、滴定
-
39
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
回答下列问题
:
取
100.00 mL
水样经固氧、酸化后
,
用
a
mol·L
-1
Na
2
S
2
O
3
溶液滴定
,
以淀粉溶液作指示剂
,
终点现象为
;
若消耗
Na
2
S
2
O
3
溶液的体积为
b
mL,
则水样中溶解氧的含量为
mg·L
-1
。
答案
:
当最后一滴标准液滴入时
,
溶液由蓝色变为无色
,
且半分钟内无变化
80
ab
解析
:
该实验用硫代硫酸钠标准液滴定
I
2
,
选用淀粉溶液作指示剂
,
终点现象为当最后一滴标准液滴入时
,
溶液由蓝色变为无色
,
且半分钟内无变化
(
或不恢复蓝色
);
由得失电子守恒可得关系式
: O
2
~2MnO(OH)
2
~2I
2
~4Na
2
S
2
O
3
-
40
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
答案
:
2.0×10
-5
5.0×10
-3
-
41
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
3
.(2015
全国卷
Ⅱ
,28
节选
)
二氧化氯
(ClO
2
,
黄绿色易溶于水的气体
)
是高效、低毒的消毒剂。回答下列问题
:
用下图装置可以测定混合气中
ClO
2
的含量
:
-
42
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
Ⅰ
.
在锥形瓶中加入足量的碘化钾
,
用
50 mL
水溶解后
,
再加入
3 mL
稀硫酸
;
Ⅱ
.
在玻璃液封装置中加入水
,
使液面没过玻璃液封管的管口
;
Ⅲ
.
将一定量的混合气体通入锥形瓶中吸收
;
Ⅳ
.
将玻璃液封装置中的水倒入锥形瓶中
;
Ⅴ
.
用
0.100 0 mol·L
-1
硫代硫酸钠标准溶液滴定锥形瓶中的溶液
(
),
指示剂显示终点时共用去
20.00 mL
硫代硫酸钠溶液。在此过程中
:
(1)
玻璃液封装置的作用是
。
(2)
Ⅴ
中加入的指示剂通常为
,
滴定至终点的现象是
。
(3)
测得混合气中
ClO
2
的质量为
g
。
-
43
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
答案
:
(1)
吸收残余的二氧化氯气体
(
避免碘的逸出
)
(2)
淀粉溶液 溶液由蓝色变为无色
,
且半分钟内溶液颜色不再改变
(3)0.027 00
解析
:
(1)
因
ClO
2
易溶于水
,
所以玻璃液封装置作用是吸收残余
ClO
2
气体。
(2)
因淀粉遇
I
2
变蓝
,
所以用淀粉溶液作指示剂。滴定至终点的现象为溶液由蓝色变为无色
,
且半分钟内颜色不再改变。
-
44
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
(1)
酸碱中和滴定原理
:H
+
+OH
-
==H
2
O,
即
c
标
·
V
标
=c
待
·
V
待
。
(2)
酸碱中和滴定的关键
:
①
准确测定
V
标
和
V
待
,
正确使用酸式、碱式滴定管。
②
准确判断中和反应是否恰好完全进行
,
借助酸碱指示剂判断滴定终点。
(3)
酸碱中和滴定实验操作
:
①
滴定前的准备工作。
a.
滴定管的检漏
:
关闭活塞
,
加水观察活塞周围有无水渗出
;
旋转活塞
180°
再检验有无水渗出。
b.
洗涤
:
滴定管用水洗后一定要用待装液进行润洗
;
锥形瓶水洗后不能进行润洗。
c.
装液调零
:
将溶液装入滴定管中
,
赶出气泡
,
并将液面调节到
0
刻度或
0
刻度以下。
②
滴定操作
(
以盐酸标准液滴定
NaOH
溶液为例
)
。左手握活塞并旋转开关
,
右手摇动锥形瓶
,
眼睛注视锥形瓶中溶液颜色的变化
,
颜色突变且半分钟内不恢复
,
说明达到滴定终点。
-
45
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
规律方法
1
.
滴定终点的判断
:
当滴入最后一滴标准溶液后
,
溶液变色
,
且半分钟内不再恢复原来的颜色。
2
.
滴定原理的应用
:
酸碱中和滴定是中学阶段重要的定量实验之一
,
在科学实验中占有十分重要的地位
,
高考中也非常重视对滴定知识的考查
,
经常将此原理与操作方法扩展到氧化还原反应滴定和沉淀滴定中进行考查。
3
.
滴定误差分析
:
判断依据是计算公式
:
c
(
待测
)=
。
c
(
标准
)
、
V
(
待测
)
在误差分析时是定值
,
因此只需分析各种原因导致所耗标准液体积
[
V
(
标准
)]
变大还是变小
,
若
V
(
标准
)
变大
,
则
c
(
待测
)
偏高
;
若
V
(
标准
)
变小
,
则
c
(
待测
)
偏低。
-
46
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
D
-
47
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
-
48
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
2
.(2017
山东滨州二模
)
室温下向
10 mL 0.1 mol·L
-1
NaOH
溶液中加入
0.1 mol·L
-1
的一元酸
HA
溶液
pH
的变化曲线如图所示。下列说法正确的是
(
)
A.
a
点所示溶液中
c
(Na
+
)>
c
(A
-
)>
c
(H
+
)>
c
(HA)
B.
a
、
b
两点所示溶液中水的电离程度相同
C.pH=7
时
,
c
(Na
+
)=
c
(A
-
)+
c
(HA)
D.
b
点所示溶液中
c
(A
-
)>
c
(HA)
D
解析
:
a
点
NaOH
与
HA
恰好完全反应
,
溶液的
pH
为
8.7,
呈碱性
,
说明
HA
为弱酸
,NaA
发生水解反应
,
c
(Na
+
)>
c
(A
-
)>
c
(HA)>
c
(H
+
),A
错误。
a
点
NaA
发生水解反应
,
促进了水的电离
,
所以
a
点水的电离程度大于
b
点
,B
错误。根据电荷守恒
,
c
(H
+
)+
c
(Na
+
)=
c
(OH
-
)+
c
(A
-
),pH=7,
则
c
(H
+
)=
c
(OH
-
),
则
c
(Na
+
)=
c
(A
-
),C
错误。
b
点
HA
过量
,
溶液呈酸性
,HA
的电离程度大于
NaA
的水解程度
,
所以
c
(A
-
)>
c
(HA),D
正确。
-
49
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
3
.
实验室现有
3
种酸碱指示剂
,
其
pH
的变色范围如下
:
甲基橙
:3.1~4.4
石蕊
:5.0~8.0
酚酞
:8.2~10.0
用
0.100 0 mol·L
-1
NaOH
溶液滴定未知浓度的
CH
3
COOH
溶液反应恰好完全时
,
下列叙述正确的是
(
)
A.
溶液呈中性
,
可选用甲基橙或酚酞作指示剂
B.
溶液呈中性
,
只能选用石蕊作指示剂
C.
溶液呈碱性
,
可选用甲基橙或酚酞作指示剂
D.
溶液呈碱性
,
只能选用酚酞作指示剂
D
解析
:
NaOH
溶液与
CH
3
COOH
溶液反应恰好完全时
,
生成
CH
3
COONa,CH
3
COONa
为强碱弱酸盐
,
水解后溶液呈碱性
,
应选用变色范围与
CH
3
COONa
溶液
pH
接近的酚酞作指示剂。
-
50
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
4
.(2017
广东肇庆三模
)
常温下
,
向
10 mL 0.1 mol·L
-1
的
HR
溶液中逐滴滴入
0.1 mol·L
-1
的
NH
3
·H
2
O
溶液
,
所得溶液
pH
及导电性变化如图。下列分析不正确的是
(
)
A.
a~b
点导电能力增强
,
说明
HR
为弱酸
B.
b
点溶液
pH=5,
此时酸碱恰好中和
C.
c
点溶液存在
c
(
)>
c
(R
-
)
、
c
(OH
-
)>
c
(H
+
)
D.
b~c
任意点溶液均有
c
(H
+
)·
c
(OH
-
)=
K
W
=1.0×10
-14
B
-
51
-
真题示例
核心建模
对点演练
考点一
考点二
考点三
解析
:
根据图像可知
,
a~b
点导电能力增强
,
说明
HR
为弱电解质
,
在溶液中部分电离
,
加入氨水后生成强电解质
,
离子浓度增大
,A
正确。
b
点时滴入的
NH
3
·
H
2
O
溶液为
10
mL,
此时恰好完全反应
,
对应图中
pH
曲线的
pH=7,
故
B
错误。
c
点时溶液的
pH>7,
混合液显示碱性
,
则
c
(OH
-
)>
c
(H
+
),
结合电荷守恒可知
:
c
(
)>
c
(R
-
),C
正确。
b~c
点
,
溶液的温度不变
,
则水的离子积不变
,D
正确。