- 117.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
云南省云天化中学2019-2020学年高一下学期开学考试试题
可能用到的相对原子质量:H-1 C-12 O-16 N-14 S-32 Fe-56 Al-27
第I卷(选择题,共48分)
一、选择题:(本题共12小题,每小题4分,共48分)。在每小题给出的四个选项中,只有一项符合题目要求。
1.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是( )
A. 雾是一种胶体 B. 光是一种胶体
C. 空气中的小水滴颗粒大小约为10﹣9m~10﹣7m D. 发生丁达尔效应
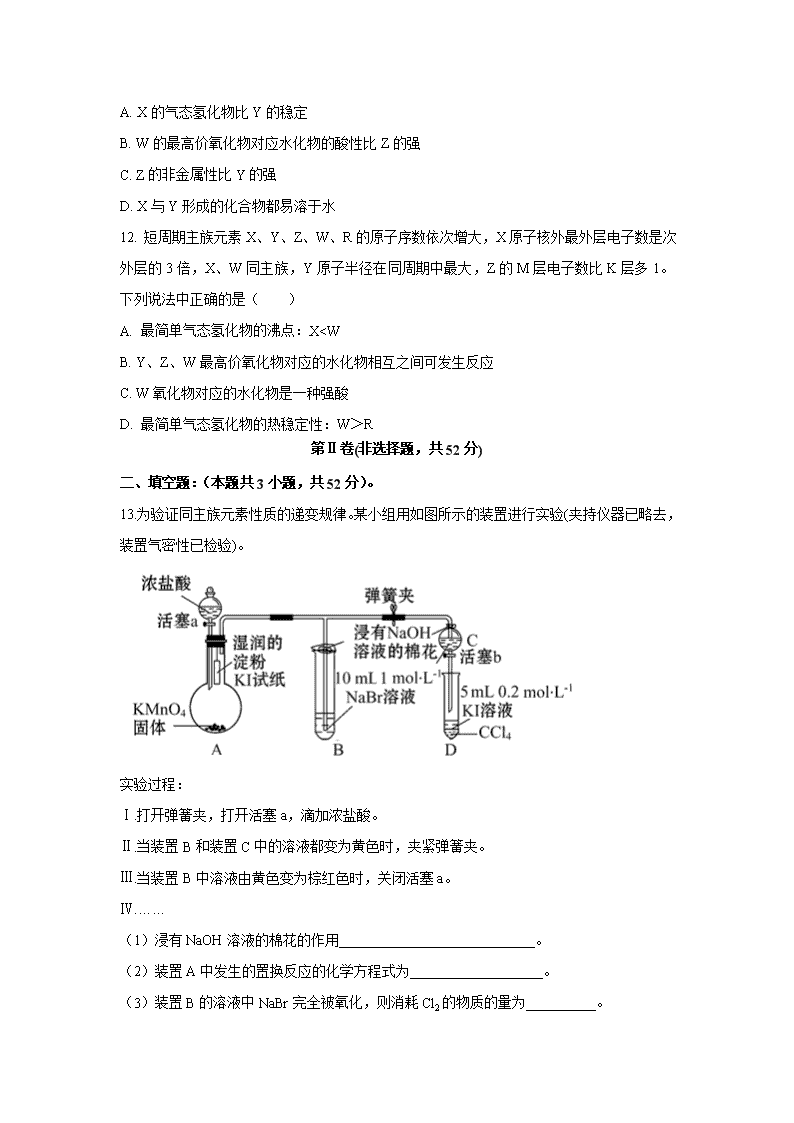
2.下列实验装置能达到实验目的的是( )
①分离乙醇和水
②用自来水制取蒸馏水
③从食盐水中获取氯化钠
④用排空气法收集氯气(Cl2)
A.①② B.②③ C.③④ D.①④
3.下列转化过程中必须加入还原剂的是( )
A.FeS→H2S B. SO2→SO32- C. Fe3+→Fe2+ D. Cu→Cu2+
4.日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
A. 钢铁生锈 B. 充有H2的“喜羊羊”娃娃遇明火发生爆炸
C. 食物腐败变质 D. 大理石雕像被酸雨腐蚀毁坏
5.在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Mg2+、Cl-、SO42-
B. 在无色透明的溶液中:K+、Cu2+、NO3-、SO42-
C. 含有0.1mol/LCa2+的溶液中:Na+、K+、CO32-、Cl-
D. 室温下,强酸性溶液中:Na+、Fe3+、NO3-、SO42-
6.每年10月23日上午6:02到晚上6:02被誉为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。NA为阿伏加德罗常数,下列说法中正确的是( )
A. 标准状况下,22.4L CCl4含有NA个CCl4分子
B. 1mol/L Mg(NO3)2溶液中含有NO3﹣的数目为2NA
C. 等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度也相等
D. 5.6g铁与足量盐酸反应转移的电子数为0.2NA
7.下列表示物质变化的化学用语正确的是( )
A.NH3·H2O的电离方程式:NH3·H2O=NH4++OH-
B.稀硫酸溶液中滴加少量氢氧化钡溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.用醋酸除去水垢:
D.用盐酸除去混在铜粉中的少量铁粉杂质:6H+ + 2Fe=2Fe3++ 3H2↑
.8. 下列叙述正确的是( )
A. 碱金属性质相似,均为银白色(铯除外)的柔软金属,密度都比较小
B. 碱金属单质在空气中燃烧生成的都是过氧化物
C. 碱金属单质的熔沸点随原子序数的增加而升高
D. Li、Na、K都可以保存在煤油中
9. 2019年是国际化学元素周期表年。下列有关元素周期表的说法正确的是( )
A. 最新的元素周期表有八个周期
B. 主族就是周期表中只有短周期元素的纵列
C. 一般在过渡元素中寻找一些化学反应新型催化剂
D. 元素周期表第8、9、10三纵列合称ⅧB族,是元素周期表中元素种类最多的族
10. Xn-含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )
A. (A-N+n)mol B. (n+A) mol
C. (N+n) mol D. (N-a) mol
11. X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
12. 短周期主族元素X、Y、Z、W、R的原子序数依次增大,X原子核外最外层电子数是次外层的3倍,X、W同主族,Y原子半径在同周期中最大,Z的M层电子数比K层多1。下列说法中正确的是( )
A. 最简单气态氢化物的沸点:X________>________
(3)写出③的单质置换出⑥的单质的化学方程式:__________________;
①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为_____________;
⑨的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的离子方程式为________。
15.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl____S(填“>”或“<”),反应的离子方程式为_______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。
(3)仪器A的名称为___________,干燥管D的作用为___________________。
(4)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B中装有KMnO4
固体,则A中试剂为___________,观察到C中溶液____________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液 ________(填现象),即可证明。但有的同学认为盐酸具有挥发性,HCl可进入C中干扰实验,应在两装置间添加装有 _________溶液的洗气瓶除去。
【参考答案】
1-5 :C B C D D 6-10 : D B A C A 11-12 : B B
13.(1)吸收逸出的Cl2,防止污染环境 (2) Cl2+2KI=I2+2KCl (3)0.005mol (4) 打开活塞b,将装置C中的少量溶液滴入装置D中,然后关闭活塞b,取下装置D振荡,静置后CCl4 层变为紫红色
14.(1)Ne K 2F2+2H2O=4HF+O2 Br2
(2)HF HCl HBr
(3)2Mg+CO22MgO+C Al(OH)3+NaOH=NaAlO2+2H2O
Al2O3+6H+=2Al3++3H2O
15.(1)钾 铝
(2)> Cl2+S2- =S↓+2Cl-
(3)分液漏斗 防止倒吸
(4)浓盐酸 变蓝色 NaOH溶液
(5)产生白色沉淀 NaHCO3