- 1.11 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 原电池原理及其应用
一、原电池的工作原理
1.原电池
将①
化学
能转化为②
电
能的装置。
2.构成条件
(1)具有两个
活泼性不同
的电极(金属和金属或金属和导电的非金属)。
(2)电解质溶液。
(3)形成闭合回路。
3.原电池的两极
考点
清单
负极:活泼性较③
强
的金属,发生④
氧化
反应。
正极:活泼性较⑤
弱
的金属或能导电的非金属,发生⑥
还原
反应。
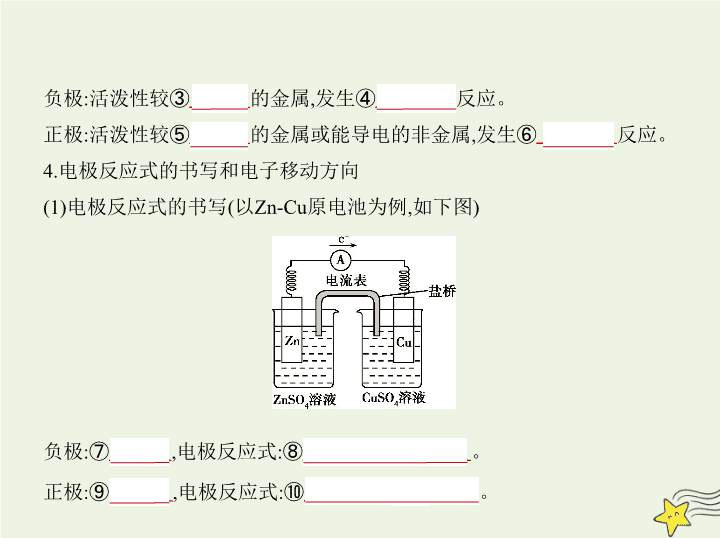
4.电极反应式的书写和电子移动方向
(1)电极反应式的书写(以Zn-Cu原电池为例,如下图)
负极:⑦
Zn
,
电极反应式:⑧
Zn-2e
-
Zn
2+
。
正极:⑨
Cu
,电极反应式:⑩
Cu
2+
+2e
-
Cu
。
电池总反应:
Zn+Cu
2+
Zn
2+
+Cu
。
(2)电子移动方向
电子由
负极
释放,经
外电路
流入
正极
,电解质溶液中的阳离
子移向
正
极,某些阳离子在正极上得电子被
还原
,形成一个
闭合回路。
二、化学电源
化学电源包括一次电池、二次电池和燃料电池等几大类,一次电池又称为
干电池,二次电池又称为充电电池或蓄电池。
电池
电极反应式
总反应式
碱性锌
锰电池
负极:Zn+2OH
-
-2e
-
Zn(OH)
2
Zn+2MnO
2
+2H
2
O
2
MnOOH+Zn(OH)
2
正极:2MnO
2
+2H
2
O+2e
-
2
MnOOH+2OH
-
铅蓄
电池
负极:Pb(s)+S
(aq)-2e
-
PbSO
4
(s)
Pb(s)+PbO
2
(s)+2H
2
SO
4
(aq)
2PbSO
4
(s)+2H
2
O(l)
正极:PbO
2
(s)+4H
+
(aq)+S
(aq)
+2e
-
PbSO
4
(s)+2H
2
O(l)
氢镍电池
负极:H
2
+2OH
-
-2e
-
2H
2
O
2NiOOH+H
2
2Ni(OH)
2
正极:2NiOOH+2H
2
O+2e
-
2
Ni(OH)
2
+2OH
-
氢氧燃料
电池(H
2
SO
4
作电解质)
负极:2H
2
-4e
-
4H
+
2H
2
+O
2
2H
2
O
正极:O
2
+4H
+
+4e
-
2H
2
O
氢氧燃料
电池(KOH
作电解质)
负极:2H
2
+4OH
-
-4e
-
4H
2
O
2H
2
+O
2
2H
2
O
正极:O
2
+2H
2
O+4e
-
4OH
-
续表
三、原电池原理的应用
1.金属的腐蚀
(1)化学腐蚀:金属跟接触到的干燥气体(如O
2
、Cl
2
、SO
2
等)或非电解质液
体(如石油)等
直接发生化学反应
而引起的腐蚀。
电池
电极反应式
总反应式
CH
4
燃料电池
(H
2
SO
4
作电解质)
负极:CH
4
+2H
2
O-8e
-
CO
2
+8
H
+
CH
4
+2O
2
CO
2
+2H
2
O
正极:2O
2
+8H
+
+8e
-
4H
2
O
CH
3
OH燃料
电池(NaOH
作电解质)
负极:2CH
3
OH+16OH
-
-12e
-
2C
+12H
2
O
2CH
3
OH+3O
2
+4NaOH
2Na
2
CO
3
+6H
2
O
正极:3O
2
+6H
2
O+12e
-
12OH
-
(2)电化学腐蚀
a.定义:
不纯
的金属与电解质溶液接触时,会发生原电池反应,
比较活泼
的金属失去电子而被氧化,这种腐蚀叫电化学腐蚀。
注意
金属的腐蚀主要是发生
电化学腐蚀
。
b.吸氧腐蚀与析氢腐蚀(以钢铁的电化学腐蚀为例)
2.金属的防护
(1)改变金属的内部结构。例如把Ni、Cr等加入普通钢中制成不锈钢。
类型
吸氧腐蚀
析氢腐蚀
条件
水膜酸性
很弱
或呈
中
性
水膜呈
酸
性
正极反应(C)
O
2
+2H
2
O+4e
-
4OH
-
2H
+
+2e
-
H
2
↑
负极反应(Fe)
Fe-2e
-
Fe
2+
其他反应
Fe
2+
+2OH
-
Fe(OH)
2
↓ 4Fe(OH)
2
+2H
2
O+O
2
4Fe(OH)
3
Fe(OH)
3
失去部分水转化为铁锈(Fe
2
O
3
·
n
H
2
O)
(2)覆盖保护层:A.涂油脂、喷油漆、搪瓷、覆盖塑料等;B.电镀耐腐蚀的
金属(Zn、Sn、Cr、Ni等)。
(3)电化学保护法:通常采用如下两种方法。a.
牺牲阳极的阴极保护法
。这
种方法通常是在被保护的钢铁设备上(如锅炉的内壁、船舶的外壳等)装
上若干镁合金或锌块。b.
外加电流的阴极保护法
。这种方法是把被保护
的钢铁设备(如钢闸门)作为阴极,用惰性电极作为阳极,
置于同一电解质溶
液
(如海水)里,外接直流电源。通电后,电子被强制流向被保护的钢铁设备,
使钢铁表面腐蚀电流降至零或接近于零,从而起到保护作用。
3.金属腐蚀快慢的比较
不纯的金属在潮湿的空气中形成原电池发生电化学腐蚀,活泼金属因被腐
蚀而损耗。金属腐蚀的快慢与下列两种因素有关:
(1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势
越
大
,进行氧化还原反应的速率
越快
,活泼金属被腐蚀的速率就
越快
。
(2)与金属所接触的介质有关,通常活泼金属在电解质溶液中的腐蚀
快于
在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀
快于
在弱电解质溶液中的腐蚀。
一般来说,可用下列原则判断金属腐蚀的快慢:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀
考点二 电解原理及其应用
基础知识
一、电解原理
1.电解
使
电流
通过电解质溶液(或熔融的电解质)而在阴、阳两极引起①
氧化还原
反应的过程。
2.电解池
(1)装置特点
②
电
能转化为③
化学
能。
(2)形成条件
a.与直流电源相连的两个电极。
b.电解质溶液(或熔融态电解质)。
c.形成闭合回路。
3.电解池工作原理示意图
4.电解池阴、阳两极的放电顺序
二、电解原理的应用
1.氯碱工业
说明
阳离子交换膜(以电解饱和NaCl溶液为例)只允许阳离子(Na
+
)通过
,而阻止
阴离子(Cl
-
、OH
-
)和分子(Cl
2
)通过,这样既能阻止H
2
和Cl
2
混合爆炸,又能避
免Cl
2
和NaOH溶液反应生成NaClO影响烧碱质量。
电极反应及总反应
阳极:④
2Cl
-
-2e
-
Cl
2
↑
。
阴极:⑤
2H
+
+2e
-
H
2
↑
。
总反应(离子方程式):⑥
2Cl
-
+2H
2
O
2OH
-
+Cl
2
↑+H
2
↑
。
2.电镀
(1)电镀的特点
电镀时,阳极是⑦
镀层金属
,阴极是⑧
镀件
,一般用
含有镀层金属
离子的溶液作电镀液
;电镀池工作时,阳极质量⑨
减小
,阴极质量⑩
增大
,电解质溶液浓度
不变
。
(2)铜的电解精炼
阳极(用
粗铜
):
Cu-2e
-
Cu
2+
;精铜作阴极,
Cu
2+
+2e
-
Cu
。
粗铜中的
金、银
等金属杂质,因失电子能力比铜弱,难以在阳极失去电子变
成阳离子,以
阳极泥
的形式沉积下来。
3.电冶金
金属冶炼就是使矿石中的金属离子获得电子,从其化合物中还原出来。通
式为
M
n
+
+
n
e
-
M
。
钠的冶炼:NaCl在熔融状态下发生电离,通直流电,阴极反应式为
2Na
+
+
2e
-
2Na
,阳极反应式为
2Cl
-
-2e
-
Cl
2
↑
,总反应式:
2
NaCl(熔融)
2Na+Cl
2
↑
。
知识归纳
原电池、电解池、电镀池的比较
原电池
电解池
电镀池
定
义
将化学能转变成电能
的装置
将电能转变成化学能
的装置
应用电解原理在某些
金属表面镀上一层其
他金属或合金的装置
装
置
举
例
形
成
条
件
①活泼性不同的两电
极
②电解质溶液(电极插
入其中,并能与电极发
生自发反应)
③形成闭合回路
①两电极接直流电源
②两电极插入电解质
溶液(或熔融电解质)中
③形成闭合回路
①镀层金属接电源正
极,待镀金属接电源负
极
②电镀液必须含有镀
层金属的离子(电镀过
程中电镀液浓度不变)
电
极
名
称
负极:氧化反应,金属失
电子或者氢气等还原
性物质失电子
正极:还原反应,溶液中
的阳离子得电子或者
氧气等得电子
阳极:氧化反应,溶液中
的阴离子失电子,或金
属电极失电子
阴极:还原反应,溶液中
的阳离子得电子
阳极:金属电极失电子
阴极:电镀液中镀层金
属阳离子得电子(在电
镀控制的条件下,水电
离产生的H
+
及OH
-
一般
不放电)
负极
正极
电源负极
阴极
电源正极
阳极
同电解池
(1)同一原电池的正、负极的电极反应中得失电子数相等。(2)同一电解池的阴、阳极的电极反应
中得失电子数相等。(3)串联电路中的各个电极反应得失电子数相等。上述三种情况下,在计算电
解产物的量时,应按得失电子数相等计算
模型观
原电池、电解池工作原理模型的构建
通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关
系,建立认知模型,并能运用与解释化学现象、揭示现象的本质和规律。通
过构建原电池原理模型,判断原电池的正、负极;通过构建电解池的工作原
理模型,判断电解质溶液电解的规律。
一、原电池正、负极的判断
知能拓展
判断角度
负极
正极
电极材料
一般是活动性较强的金属
一般是活动性较弱的金属或能
导电的非金属
判断角度
负极
正极
电子流向
电子流出的一极
电子流入的一极
离子移动方向
阴离子移向的一极
阳离子移向的一极
发生的反应
氧化反应
还原反应
反应现象
一般质量减小
质量增加或不变
注意
(1)在原电池Al-NaOH(aq)-Mg中,Al作负极;(2)在原电池Al-浓硫酸-Cu中,
Cu作负极。
二、惰性电极电解电解质溶液的规律
类型
电极反应特
点
实例
电解
物质
电解质
的变化
pH
使电解质
溶液复原
的方法
电解
水型
阴极:4H
+
+4e
-
2H
2
↑
阳极:4OH
-
-4
e
-
2H
2
O
+O
2
↑
NaOH
水
浓度增大
增大
加水
H
2
SO
4
水
浓度增大
减小
加水
Na
2
SO
4
水
浓度增大
不变
加水
电解
电解
质型
电解质电离
出的阴、阳
离子分别在
两极放电
HCl
电解质
浓度减小
增大
加氯化氢
CuCl
2
电解质
浓度减小
—
加氯化铜
放H
2
生碱型
阴极:放出H
2
阳极:电解质
阴离子放电
NaCl
电解质
和水
生成新
电解质
增大
加氯化氢
放O
2
生酸型
阴极:电解质
阳离子放电
阳极:OH
-
放
电
CuSO
4
电解质
和水
生成新
电解质
减小
加氧化铜
说明
(1)用惰性电极电解强碱、含氧酸、活泼金属的含氧酸盐的稀溶液时,实
际上是电解H
2
O,溶质的质量分数增大,浓度增大。
(2)电解时产物的判断要遵循阴、阳离子的放电顺序。
(3)电解后要恢复原电解质溶液的浓度,需加适量的某物质,该物质可以是
阴极与阳极产物的化合物。例如用惰性电极电解CuSO
4
溶液,要恢复原溶
液的浓度,可向电解后的溶液中加入CuO,但不能加入Cu(OH)
2
,因为Cu(OH)
2
与生成的H
2
SO
4
反应后使水量增加。
例1(2019广东佛山二检,10)沉积物微生物燃料电池可处理含硫废水,其工
作原理如图所示。下列说法错误的是( )
A.碳棒b的电极反应式为O
2
+4e
-
+4H
+
2H
2
O
B.光照强度对电池的输出功率有影响
C.外电路的电流方向:碳棒a→碳棒b
D.酸性增强不利于菌落存活,故工作一段时间后,电池效率降低
解题导引 题目给出了沉积物微生物燃料电池示意图,解题时需先调用有
关原电池模型的知识点,根据示意图信息判断出碳棒a是负极,碳棒b是正
极,进一步分析出该原电池中电子、离子移动方向、电流方向和电极反应,
就可以判断出答案。
解析 由题图可知,碳棒a作负极,碳棒b作正极。A项,正极O
2
得电子生成
水,电极反应式为O
2
+4e
-
+4H
+
2H
2
O,故A正确;B项,CO
2
在光照和光合菌
的作用下反应生成氧气,光照强度对电池的输出功率有影响,故B正确;C项,
外电路电流由正极流向负极,即由碳棒b→碳棒a,故C错误;D项,酸性增强可
使菌落失活,工作一段时间后,电池效率降低,故D正确。
答案 C
易错警示 原电池中,负极失去电子发生氧化反应,正极得到电子发生还原
反应,电流从正极经外电路流向负极。守恒观 电极反应式的书写、与电
化学相关的计算
认识化学变化的本质特征是有新物质生成,根据物质变化,寻找参与电
极反应的反应物、生成物,遵循守恒,正确书写电极反应式。始终运用守
恒,解决与电化学相关的计算。
一、电极反应式的书写
(1)一般电极反应式的书写
(2)复杂电极反应式的书写
二、电化学的相关计算方法
如可以通过4 mol e
-
为桥梁构建如下关系式:
~
(式中M为金属,
n
为其离子的化合价数值)
例2一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确
的是
( )
A.反应 CH
4
+H
2
O
3H
2
+CO,每消耗1 mol CH
4
转移12 mol电子
B.电极A上H
2
参与的电极反应为:H
2
+2OH
-
-2e
-
2H
2
O
C.电池工作时,C
向电极B移动
D.电极B上发生的电极反应为:O
2
+2CO
2
+4e
-
2C
解题导引
解析 A项,由化合价变化知,每消耗1 mol CH
4
转移6 mol电子;B项,电极A
为负极,H
2
参与的电极反应为H
2
-2e
-
+C
H
2
O+CO
2
;C项,电池工作时,C
向电极A移动;D项,电极B是正极,电极反应为O
2
+4e
-
+2CO
2
2C
。
答案 D
镍金属氢化物电池、锂聚合物电池、水系锌离子电池等新型二次电池备
受青睐,以此为情境,创设出同时考查原电池和电解池工作原理的试题,培
养创新意识和知识应用能力。解题时通过构建原电池、电解池工作原理
模型,将模型迁移应用,解决问题。
实践探究
例题(2019课标Ⅲ,13,6分)为提升电池循环效率和稳定性,科学家近期利用
三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电
解质的3D-Zn-NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2
NiOOH(s)+H
2
O(l)
ZnO(s)+2Ni(OH)
2
(s)。
下列说法错误的是
( )
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)
2
(s)+OH
-
(aq)-e
-
NiOOH(s)+H
2
O(l)
C.放电时负极反应为Zn(s)+2OH
-
(aq)-2e
-
ZnO(s)+H
2
O(l)
D.放电过程中OH
-
通过隔膜从负极区移向正极区
解析 三维多孔海绵状Zn沉积的ZnO分散度高,原因就是海绵状Zn具有较
高的表面积,吸附能力强。在充电时总反应:ZnO(s)+2Ni(OH)
2
(s)
Zn(s)
+2NiOOH(s)+H
2
O(l),阳极发生氧化反应失去电子。放电时总反应:Zn(s)+2
NiOOH(s)+H
2
O(l)
ZnO(s)+2Ni(OH)
2
(s),负极失电子发生氧化反应。在
放电过程中,阳离子应该向正极区移动,而阴离子(OH
-
)应该通过隔膜从正
极区移向负极区,D错误。
答案 D
本题价值 借用科学家新设计的二次电池结构图为考查背景,不仅考查了
知识点,还考查了学生对图像信息的接受、吸收、整合能力。
1.活学妙用,溯本求源
对于复杂的组合装置,要分析题意确定装置是“原电池”还是“电解池”,
从氧化还原反应的角度,结合电子、离子的移动方向,确定装置的正、负极
或阴、阳极,紧紧抓住原电池、电解池的工作原理,防止被复杂的装置所迷
惑。
例1(2019安徽江南十校联考,13)利用电解质溶液的浓度对电极电势的影
响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置
示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说
法中错误的是( )
创新思维
A.循环物质E为水
B.乙池中Cu电极为阴极,发生还原反应
C.甲池中的电极反应式为Cu
2+
+2e
-
Cu
D.若外电路中通过1 mol电子,两电极的质量差为64 g
2.实事求是,尊重科学
化学是一门以实验为基础的自然科学,人们对科学规律的发现是通过对自
然现象的反复观察、探究和验证逐步完成的,化学离不开实验,当实验的现
象、结果与熟悉的知识不相符时,我们要尊重客观实验事实,实事求是,不
盲从于熟悉的知识。
解析 由S
的移动方向可知右边Cu电极为负极,发生氧化反应。当电路
中通过1 mol电子时,左边电极质量增加32 g,右边电极质量减小32 g,两极
的质量差为64 g。电解质再生池是利用太阳能将CuSO
4
稀溶液蒸发,分离
为CuSO
4
浓溶液和水后,再返回浓差电池。
答案 B
例2(2019 5·3原创预测卷四,13)如图所示,用两张砂纸分别将镁条和铝片表
面的氧化膜打磨干净,并迅速将两个电极分别插入两个盛有0.5 mol/L的电
解质溶液的烧杯中,盐桥中装有含饱和氯化钠溶液的琼脂。结果发现该装
置中,电流计指针一直偏向铝片,镁条溶解,两极上均没有气泡产生。下列
说法正确的是
( )
A.铝片为负极,电极反应为2Al+4OH
-
-6e
-
2Al
+2H
2
O
B.镁条为负极,电极反应为Mg-2e
-
Mg
2+
C.该实验证明镁能与氢氧化钠溶液反应
D.若镁电极减少0.48 g,则氢氧化钠溶液增重1.6 g
解析 从题中信息可知,镁条溶解,作负极,电极反应为Mg-2e
-
Mg
2+
,铝
片作正极,电极反应为O
2
+2H
2
O+4e
-
4OH
-
,该电池反应相当于镁在溶液
中发生了吸氧腐蚀,A、C错误,B正确;若0.02 mol Mg参加反应,失去0.04
mol e
-
,盐桥中转移0.04 mol Na
+
,则生成0.04 mol NaOH,但是由于水参与了
反应,氢氧化钠溶液增加的质量为(0.04
×
40)g-0.36 g=1.24 g,D错误。
答案 B