- 2.98 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题三 基 本 理 论
第
6
讲 物质的结构与元素周期律
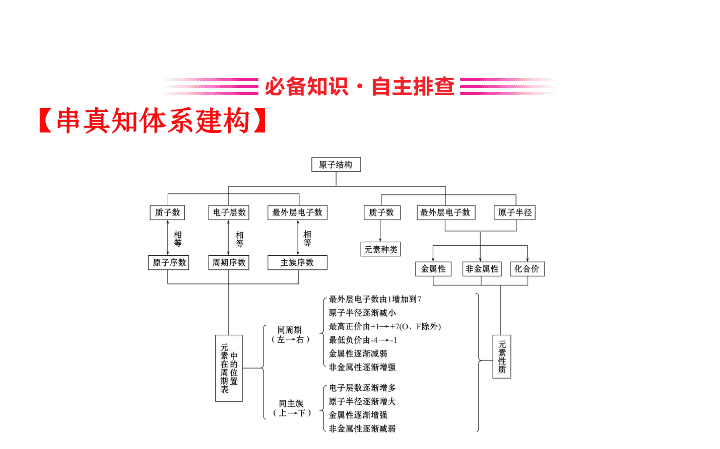
【
串真知体系建构
】
【
研核心思维激活
】
【
研习任务
1】
2019
年
4
月
23
日
,
一场隆重的海上阅兵在
黄海上进行。国家主席、中央军委主席习近平登上检
阅台
,
检阅受邀参加海上阅兵的
13
国海军
18
艘舰艇。此
次参加海上阅兵
,
囊括了航母、新型核潜艇、驱逐舰、
战机等海军新型主战舰机。低丰度的浓缩铀可作为航
母的动力源泉
是核反应堆的重要原料。
(1)
的中子数为
______
和
是两种核素
,
它
们互称
____________
。
(2)
某元素的一种同位素
X
原子的质量数为
A,
含
N
个中子
,
它与
1
H
原子构成
H
m
X
分子
,
在
a g H
m
X
中所含原子的物质
的量为
________,
所含中子的物质的量为
________,
所
含质子数为
________,
所含电子数为
________
。
答案
:
(1)143
同位素
(2) (m+1) mol
N mol
(m+A-N)N
A
(m+A-N)N
A
【
研习任务
2】
碳酸氢铵、硫酸铵和氯化铵三种物质是农业生产中常见的氮肥
,
分析它们的结构回答下列问题。
(1)
按构成微粒分类
,
它们属于哪类化合物
?
(2)
写出氯化铵的电子式
,
分析三种物质中存在什么化学键
?
答案
:
(1)
碳酸氢铵、硫酸铵和氯化铵属于铵盐
,
铵盐是
铵根离子和酸根离子结合而形成的化合物
,
由于是由离
子构成的
,
所以属于离子化合物。
(2)
氯化铵的电子式为
,
铵根离子中
有共价键
,
三种物质中既存在离子键也存在共价键。
【
研习任务
3】
现如今
,
世界各地的学生都会背元素周
期表
,
它被许多人视为化学领域最伟大的发现。
1869
年
,
俄国化学家德米特里
·
门捷列夫发现了化学元素的周
期性
,
并将已知的化学元素按照其各自的物理性质进行
了排列。元素周期表给化学世界带来了秩序
,
并预测了
一些当时尚未被发现的元素
,
为未来的理论研究指明了
方向。根据元素周期表填空
:
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
一
H
二
①
②
③
④
三
⑤
⑥
⑦
⑧
⑨
⑩
⑪
⑫
(1)
这些元素中
,________(
填元素符号
)
是最活泼的金
属元素
,________
是最活泼的非金属元素
,________
是
最不活泼的元素。
(2)
这些元素中
,
最高价氧化物对应的水化物中酸性最
强的是
________,
碱性最强的是
______,
呈两性的是
__________
。
(3)⑤
、⑥、⑦三元素的金属性由强到弱的顺序是
__________,
其最高价氧化物对应的水化物碱性由强到
弱的顺序是
__
。
(4)⑧
、⑨、⑩、⑪四元素的非金属性由强到弱的顺
序为
__________,
其最高价氧化物对应的水化物酸性由
强到弱的顺序是
__________,
氢化物的稳定性由强到弱
的顺序是
__
。
答案
:
(1)Na
F
Ar
(2)HClO
4
NaOH
Al(OH)
3
(3)Na
、
Mg
、
Al
NaOH
、
Mg(OH)
2
、
Al(OH)
3
(4)Cl
、
S
、
P
、
Si
HClO
4
、
H
2
SO
4
、
H
3
PO
4
、
H
2
SiO
3
HCl
、
H
2
S
、
PH
3
、
SiH
4
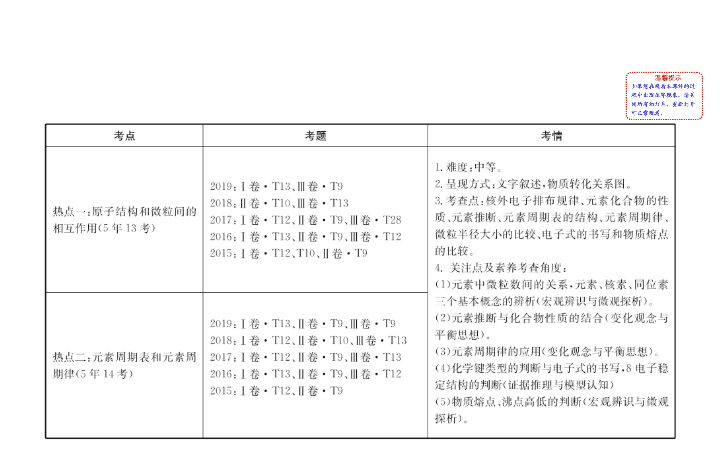
热点一 原子结构和微粒间的相互作用
【
研典例探究升华
】
角度一
:
原子结构及“四同”比较
【
典例
1】
(2019·
福州模拟
)
近年
,
科学家发现了
116
号
元素
Lv
。下列关于
293
Lv
和
294
Lv
的说法错误的是
(
)
A.
两者电子数相差
1 B.
两者质量数相差
1
C.
两者中子数相差
1 D.
两者互为同位素
【
解析
】
选
A
。
293
Lv
和
294
Lv
的电子数都是
116,A
错误
;
293
Lv
的质量数是
293,
294
Lv
的质量数是
294,
质量数相差
1,B
正确
;
293Lv
的中
子数是
177,
294
Lv
的中子数是
178,
中子
数相差
1,C
正确
;
293
Lv
和
294
Lv
是质子数相同
,
中子数不同
的同种元素的不同原子
,
互为同位素
,D
正确。
【
规律方法
】
元素、核素、同位素、同素异形体之间的联系
角度二
:
原子结构示意图和电子式
【
典例
2】
(2019·
江苏高考
)
反应
NH
4
Cl+NaNO
2
====
NaCl+N
2
↑+2H
2
O
放热且产生气体
,
可用于冬天石油开采。
下列表示反应中相关微粒的化学用语正确的是
(
)
A.
中子数为
18
的氯原子
B.N
2
的结构式
:N N
C.Na
+
的结构示意图
:
D.H
2
O
的电子式
:
【
解析
】
选
D
。
A
项
,Cl
的质子数为
17,
中子数为
18,
则质
量数为
35,
表示为
,
错误
;B
项
,N
2
分子中
N
与
N
之间
形成三键
,
结构式为
N≡N,
错误
;C
项
,Na
失去最外层一个
电子为
Na
+
,
结构示意图为
,
错误
;D
项
,H
2
O
为共
价化合物
,H
和
O
之间为共用电子对
,
正确。
角度三
:
化学键与物质类型
【
典例
3】
(2019·
济南模拟
)
一种碱金属与
C
60
形成的
新型超导材料球碳盐
K
3
C
60
,
属于离子化合物
,
下列分析
正确的是
(
)
A.C
60
中含有共价键
,
属于共价化合物
B.K
3
C
60
中既有离子键
,
又有共价键
C.1 mol K
3
C
60
中含有的阴离子个数为
3×6.02×10
23
D.C
60
和
K
3
C
60
,
两种物质中都存在分子间作用力
【
解析
】
选
B
。
C
60
只由一种元素组成
,
含有共价键
,
属
于单质
,A
错误
;
依据
K
3
C
60
属于离子化合物可知
,
该化合
物中一定含有离子键
,
但碳原子与碳原子之间只能形成
共价键
,B
正确
;K
3
C
60
中的阴离子为
,
则
1 mol K
3
C
60
中
含有的阴离子数为
6.02×10
23
,C
错误
;K
3
C
60
属于离子化
合物
,
不存在分子间作用力
,D
错误。
【
规律方法
】
微粒之间的相互作用力判断方法
【
精整合技法指导
】
1.
原子构成的符号
2.
书写“电子式”需要注意
5
个问题
(1)
首先要判断是阴离子还是阳离子
,
是离子化合物还
是共价化合物。
(2)
不能漏写没有参与成键的电子对
,
如
NH
3
的电子式不
是
。
(3)
不能错误合并离子
,
如
Na
2
O
2
的电子式写成
2Na
+
是错误的。
(4)
不能混淆化学键的类别
,
如
H
2
O
2
的电子式写成
H
+
2-
H
+
是错误的。
(5)
离子
(
或根
)
带电荷
,
基团不显电性
,
如
OH
-
为
,-OH
为
H
。
3.
化学键与化合物的关系
(1)
离子化合物中一定含离子键
,
可能含非极性键和极性键
;
(2)
共价化合物一定含极性键
,
可能含非极性键
,
一定不含离子键
;
(3)
既有极性键又有非极性键的共价化合物一般由多个原子组成
,
如
H
2
O
2
、
C
2
H
4
等
;
(4)
既有离子键又有极性共价键的物质
,
如
NaOH
、
K
2
SO
4
等
;
既有离子键又有非极性共价键的物质
,
如
Na
2
O
2
等。
【
练类题巩固拓展
】
1. (2019·
南京模拟
)
下列有关化学用语的表示正确的
是
(
)
A.
氯分子的电子式
:
B.
氯离子
(Cl
-
)
的结构示意图
:
C.
质子数为
17
、中子数为
20
的氯原子
D.
氯乙烯分子的结构简式
:H
3
C-CH
2
Cl
【
解析
】
选
A
。
A.
氯分子中每个氯原子最外层都满足
8
电子稳定结构
,
其电子式为
,
故
A
正确
;B.
为氯原子结构示意图
,
氯离子的核外电子总数为
18,
最
外层满足
8
电子稳定结构
,
其正确的离子结构示意图
为
,
故
B
错误
;C.
质子数为
17
、中子数为
20
的氯
原子的质量数为
37,
其正确的表示方法为
,
故
C
错误
;
D.
氯乙烯分子中含有
1
个碳碳双键
,
其正确的结构简
式为
H
2
C CHCl,
故
D
错误。
2.
下列叙述不正确的是
(
)
A.
6
Li
和
7
Li
的电子数相等
,
中子数也相等
B.
1
H
和
2
H
是不同的核素
,
它们的质子数相等
C.
14
C
和
14
N
的质量数相等
,
它们的中子数不等
D.
13
C
和
14
C
属于同一种元素
,
它们互为同位素
【
解析
】
选
A
。
A
项
,
6
Li
和
7
Li
的质子数都为
3,
电子数也
都为
3,
中子数分别为
6-3=3
、
7-3=4,
所以中子数不相等
,
错误
;B
项
,
1
H
和
2
H
的质子数都为
1,
中子数分别为
0
、
1,
所以
1
H
和
2
H
是不同的核素
,
正确
;C
项
,
14
C
和
14
N
的质量数
相等
,
质子数分别为
6
、
7,
中子数分别为
14-6=8
、
14-
7=7,
所以它们的中子数不等
,
正确
;D
项
,
13
C
和
14
C
的质子
数都为
6,
属于同一种元素
,
中子数分别为
13-6=7
、
14-6=8,
所以它们互为同位素
,
正确。
3.(2019·
滨州模拟
)X
、
Y
为两种短周期元素
,
其原子的
最外层电子数分别是
1
和
6,
则
X
、
Y
两种元素形成的常见
化合物或者离子不可能是
(
)
A.
只含极性键的共价化合物
B.
含非极性键的共价化合物
C.
阴阳离子个数之比为
1∶1
的离子化合物
D.
含非极性键的离子化合物
【
解析
】
选
C
。由题意可知
,X
可能为
H
、
Li
、
Na,Y
可能为
O
、
S,
故
X
、
Y
形成的化合物有
H
2
O
、
H
2
O
2
、
H
2
S
、
Na
2
O
2
、
Na
2
O
、
Na
2
S
等。
【
加固训练
】
1.
科学家最近发现了一种只由四个中子构成的粒子
R,
这标志着人类对化学微观世界的研究又取得了新的进
展。下列有关
R
的说法不正确的是
(
)
A.R
与其他原子一样呈电中性
B.R
的质量数与
4
He
相同
C.
与氢元素的质子数相同
D.R
中不含质子可称为“零号元素”
【
解析
】
选
C
。
A.
该粒子由四个中子构成
,
中子不带电
,
所以该粒子也不显电性
,A
正确
;B.
该粒子由四个中子构成
,
所以该粒子的质量数为
4,
质量数与
4
He
相同
,B
正确
;C.
由于该粒子质子数为
0,
而氢元素的质子数为
1,
质子数不同
,C
错误
;D.R
中不含质子
,
可称为“零号元素”
,D
正确。
2.
下列各组中两种微粒所含电子数不相等的是
(
)
A.H
3
O
+
和
OH
-
B.CO
和
N
2
C.HNO
2
和
N
D.C
和
【
解析
】
选
D
。中性微粒的电子数
=
质子数
,
阳离子的电
子数
=
质子数
-
所带电荷数
,
阴离子的电子数
=
质子数
+
所
带电荷数
,
则
A
、
H
3
O
+
和
OH
-
均含有
10
个电子
,A
不正确
;B
、
CO
和
N
2
均含有
14
个电子
,B
不正确
;C
、
HNO
2
和
N
均含
有
24
个电子
,C
不正确
;D
、
C
中含有
8
个电子
,
而
含有
10
个电子
,D
正确。
3.
下列说法正确的是
(
)
A.CO
2
的沸点低于
SiO
2
,
其原因是分子间作用力
:
CO
2
Y>Z
C.Y
的最高价氧化物的水化物是中强酸
D.
该新化合物中
Y
不满足
8
电子稳定结构
【
解析
】
选
C
。由
W
、
X
、
Y
、
Z
为同一短周期元素
,Z
的核
外最外层电子数是
X
核外电子数的一半
,
以及
X
、
Z
的成
键数可知
,Z
为
Cl
、
X
为
Si,
由化合价代数和为
0
可知
,Y
元
素化合价为
-3
价
,
则
Y
为
P
元素
;
由
W
的电荷数可知
,W
为
Na
元素。
WZ
的水溶液是
NaCl
水溶液
,
呈中性
,A
不正确
;
元
素非金属性的顺序为
Z >Y>X,
即
Cl>P>Si,B
不正确
;Y
的
最高价氧化物的水化物是
H
3
PO
4
,
是中强酸
,C
正确
;
该新化合物中
Y
形成两个化学键
,
但是得到
1
个电子后会形成一对孤电子对
,
故满足
8
电子稳定结构
,D
不正确。
【
名师支招
】
答题流程分析
第一步
:
审题找关键
第二步
:
推断元素
主族元素
→
元
素
种
类
原子序数
外层电子
同主族
物质特性
第三步
:
推断性质
元素
(
原子
)
→
半径大小
单质
聚集状态
化合物
类型
水溶液
水解
其他
化合价等
角度二
: “
元素周期表片段”综合推断题
【
典例
5】
(2019·
全国卷
Ⅱ)
今年是门捷列夫发现元素
周期律
150
周年。下表是元素周期表的一部分
,W
、
X
、
Y
、
Z
为短周期主族元素
,W
与
X
的最高化合价之和为
8
。下列
说法错误的是
(
)
W
X
Y
Z
A.
原子半径
:WX>Y
C.Y
的氢化物常温常压下为液态
D.X
的最高价氧化物的水化物为强酸
【
解析
】
选
C
。短周期元素
W
、
X
、
Y
、
Z
的原子序数依次
增加。
m
、
p
、
r
是由这些元素组成的二元化合物
,n
是元
素
Z
的单质
,
通常为黄绿色气体
,
则
n
是氯气
,Z
是氯元素
;
0.01 mol·L
-1
r
溶液的
pH
为
2,
说明
r
是强酸
,
因此
W
是
H;q
的水溶液具有漂白性
,s
通常是难溶于水的混合物
,
根据转化关系图可知
m
是水
,r
是氯化氢
,q
是次氯酸
,p
是
烷烃
(
如甲烷
),
因此
X
是碳元素
,Y
是氧元素。同周期自
左向右原子半径逐渐减小
,
同主族自上而下原子半径逐
渐增大
,
则原子半径的大小
:WY>X,B
错误
; Y
的氢化物是
水或双氧水
,
常温常压下为液态
,C
正确
;X
的最高价氧化
物的水化物碳酸为弱酸
,D
错误。
【
规律方法
】
元素的特殊性质
(1)
形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素
:C
。
(2)
空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素
:N
。
(3)
地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素
:O
。
(4)
等物质的量的单质最轻的元素
:H;
最轻的金属单质
:Li
。
(5)
单质在常温下呈液态的非金属元素
:Br;
金属元素
:Hg
。
(6)
最高价氧化物及其水化物既能与强酸反应
,
又能与强碱反应的元素
:Al
。
(7)
元素的气态氢化物和它的最高价氧化物对应的水化物能起化合反应的元素
:N;
能起氧化还原反应的元素
:S
。
【
精整合技法指导
】
1.
答题必用的“位、构、性”思维模型
2.
微粒半径比较的方法
(1)①
同周期原子半径或同性离子半径从左到右均减小
如
:r(S)>r(Cl)
、
r(
)>r(Cl
-
)
。
②同主族原子半径或离子半径从上到下均增大
如
:r(Na)r(Fe
2+
)>r(Fe
3+
)
、
r(Cl)r(Mg
2+
)>r(Al
3+
)
。
(4)
核电荷数、电子层数、电子数均不同的粒子
:
可用参照法。如
r(K
+
)
与
r(Mg
2+
)
比较时可参照
r(K
+
)>r(Na
+
)>r(Mg
2+
)
来确定
r(K
+
)>r(Mg
2+
)
。
3.
金属性和非金属性强弱的判断方法
三表
元素周期表
:
金属性“右弱左强
,
上弱下强
,
右上弱左下强”
;
非金属性“左弱右强
,
下弱上强
,
左下弱右上强”
金属活动性顺序
:
按
K
、
Ca
、
Na
、
Mg
、
Al
、
Zn
、
Fe
、
Sn
、
Pb
、
Cu
、
Hg
、
Ag
、
Pt
、
Au
的顺序
,
金属性减弱
非金属活动性顺序
:
按
F
、
O
、
Cl
、
Br
、
I
、
S
的顺序
,
非金属性减弱
三反
应
置换反应
:
强的置换弱的
,
适合金属也适合非金属
与水或非氧化性酸反应越剧烈
,
或最高价氧化物对应水化物的碱性越强
,
则金属性越强
与氢气反应越容易
,
生成的气态氢化物的稳定性越强
,
或最高价氧化物对应水化物的酸性越强
,
则非金属性越强
氧化
性
金属离子的氧化性越弱
,
对应金属性越强
还原
性
非金属氢化物或非金属阴离子的还原性越弱
,
对应非金属性越强
【
练类题巩固拓展
】
1.W
、
X
、
Y
、
Z
均为短周期元素且原子序数依次增大
,
元素
X
和
Z
同族。盐
YZW
与浓盐酸反应
,
有黄绿色气体产生
,
此气体同冷烧碱溶液作用
,
可得到含
YZW
的溶液。下列说法正确的是 世纪金榜导学号
(
)
A.
原子半径大小为
WY>X
B.W
与
X
组成的化合物中只含有极性键
C.
简单氢化物的沸点
:YZ>X
【
解析
】
选
D
。短周期主族元素
W
、
X
、
Y
、
Z
的原子序数
依次增大
,Y
和
Z
位于同一主族。
m
、
n
、
p
均为由这些元
素组成的二元化合物
,
甲、乙、丙为其中三种元素对应
的单质
,
丙为淡黄色固体
,
易溶于
XZ
2
,
丙是
S,
所以
X
是
C,Z
是
S
。
n
是一种二元弱酸
,
根据转化关系可判断
n
是
H
2
S,
则甲是氢气
,
乙是氧气。
p
是
SO
2
,m
是水
,
因此
W
是
H,Y
是
O
。
A.
同周期自左向右原子半径逐渐减小
,
同主族
从上到下原子半径逐渐增大
,
则原子半径
:WZ,C
错误
;D.
非金属性
:O>S>C
即
Y>Z>X,D
正确。
【
加固训练
】
1.(2018·
全国卷
Ⅱ)W
、
X
、
Y
和
Z
为原子序数依次增大
的四种短周期元素。
W
与
X
可生成一种红棕色有刺激性
气味的气体
;Y
的周期数是族序数的
3
倍
;Z
原子最外层的
电子数与
W
的电子总数相同。下列叙述正确的是
(
)
A.X
与其他三种元素均可形成两种或两种以上的二元化合物
B.Y
与其他三种元素分别形成的化合物中只含有离子键
C.
四种元素的简单离子具有相同的电子层结构
D.W
的氧化物对应的水化物均为强酸
【
解析
】
选
A
。
W
、
X
、
Y
、
Z
的原子序数依次增大
,W
与
X
生成一种红棕色气体
,
则
W
为氮元素
,X
为氧元素
;Y
的周
期数是族序数的
3
倍
,
则
Y
为钠元素
;
故
Z
为第
3
周期元
素
,Z
的最外层电子数与
W(N)
的电子总数相同
,
因此
Z
为
氯元素。氧元素可以与其余元素
N
、
Na
、
Cl
形成多种二
元化合物
,
故
A
项正确
;
钠元素与氧元素形成的化合物
Na
2
O
2
中含有离子键和共价键
,
故
B
项错误
;N
、
O
、
Na
形成的简单离子的电子层结构相同
,
均为
10
电子微粒
,
而氯元素形成的简单离子为
18
电子结构
,
故
C
项错误
;N
的氧化物对应的水化物有
HNO
2
和
HNO
3
,
其中
HNO
2
为弱酸
,
故
D
项错误。
2.(2017·
全国卷
Ⅲ)
短周期元素
W
、
X
、
Y
和
Z
在周期表
中的相对位置如表所示
,
这四种元素原子的最外层电子
数之和为
21
。下列关系正确的是
(
)
A.
氢化物沸点
:WW
C.
化合物熔点
:Y
2
X
3
r(Z)>r(W)
B.
化合物
N
和乙烯使溴水褪色的原理相同
C.
含
W
元素的盐溶液可能显酸性、中性或碱性
D.Z
与
X
、
Y
、
W
形成的化合物中
,
各元素均满足
8
电子结构
【
解析
】
选
C
。乙是一种“绿色氧化剂”
,
乙是
H
2
O
2
,M
是单质
,
所以
M
是
O
2
;
乙和丁的组成元素相同
,
丁是
H
2
O;
化合物
N
是具有漂白性的气体
,N
是
SO
2
,
丙是
H
2
S,
甲是硫
化物
;X
、
Z
原子序数之和是
Y
、
W
原子序数之和的
,Z
是钠元素
;X
、
Y
、
Z
、
W
分别是
H
、
O
、
Na
、
S
。原子半
径
:r(Na)>r(S)>r(O), A
错误
;SO
2
使溴水褪色发生氧化
还原反应
,
乙烯使溴水褪色发生加成反应
, B
错误
;
含硫元素的盐溶液
,NaHSO
4
溶液显酸性
,Na
2
SO
4
溶液显中性
,Na
2
SO
3
溶液呈碱性
, C
正确
;Na
与
H
、
O
、
S
形成的化合物中
,NaH
中氢元素不满足
8
电子结构
, D
错误。