- 175.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时达标作业16 元素周期表和元素周期律
基础题
1.门捷列夫对化学这一学科发展的最大贡献在于发现了化学元素周期律。下列事实不能用元素周期律解释的只有( )
A.碱性:KOH>Ca(OH)2>Mg(OH)2
B.稳定性:H2O>H2S>H2Se
C.挥发性:HNO3>H3PO4>H2SO4
D.原子半径:P>S>Cl
解析:元素的金属性越强,其原子失电子能力越强,其对应最高价氧化物的水化物碱性越强,金属性K>Ca>Mg,则碱性:KOH>Ca(OH)2>Mg(OH)2,A可以;元素的非金属性越强,其对应的气态氢化物越稳定,同主族元素非金属性O>S>Se,则稳定性:H2O>H2S>H2Se,B可以;挥发性与物质的结构无关,C不可以;同周期元素从左到右原子半径逐渐减小,D可以。
答案:C
2.据腾讯科技报道:日本科学家合成了第113号元素,并获得国际机构确认。关于该元素的有关说法错误的是( )
A.该元素的单质可用作半导体材料
B.该元素一种同位素的质量数为A,则中子数为A-113
C.该元素的最高正化合价为+3
D.该元素位于元素周期表中第七周期第ⅢA族
解析:元素周期表排满时有118种元素,第118号元素位于第七周期0族,故该元素位于第七周期第ⅢA族,D项正确;根据元素递变规律推断该元素为金属元素,其单质为导体,A项错误;根据质子数+中子数=质量数,可知该同位素的中子数为A-113,B项正确;该元素位于第ⅢA族,最高正化合价为+3,C项正确。
答案:A
3.元素周期表中第三周期的主族元素,按由左到右的顺序,以下说法正确的是( )
A.原子半径和离子半径均减小
B.金属性减弱,非金属性增强
C.氧化物对应的水化物碱性减弱,酸性增强
D.单质的熔点降低
解析:
第三周期元素,原子半径减小,但离子半径不是减小(阳离子只有2个电子层,阴离子3个电子层),A项错误;第三周期元素,从左到右,金属性减弱,非金属性增强,B项正确;应该是最高价氧化物对应的水化物碱性减弱,酸性增强,C项错误;单质熔点没有规律,D项错误。
答案:B
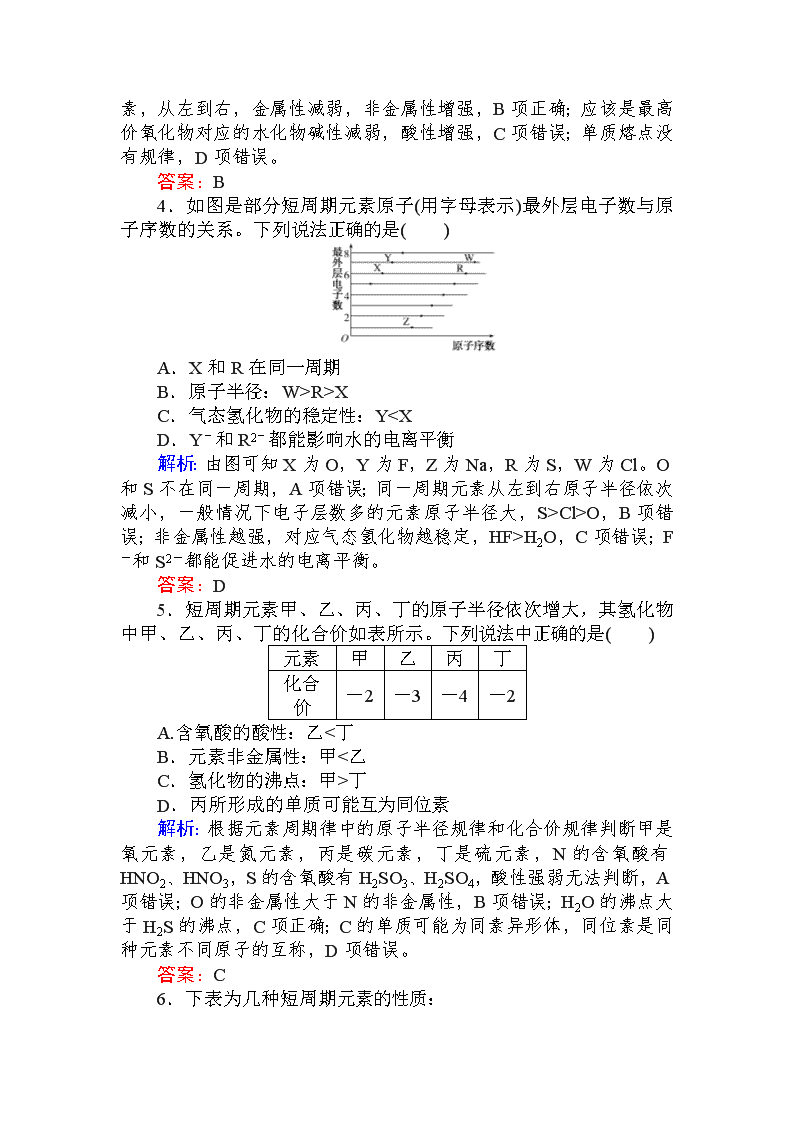
4.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系。下列说法正确的是( )
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:YCl>O,B项错误;非金属性越强,对应气态氢化物越稳定,HF>H2O,C项错误;F-和S2-都能促进水的电离平衡。
答案:D
5.短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示。下列说法中正确的是( )
元素
甲
乙
丙
丁
化合价
-2
-3
-4
-2
A.含氧酸的酸性:乙<丁
B.元素非金属性:甲<乙
C.氢化物的沸点:甲>丁
D.丙所形成的单质可能互为同位素
解析:根据元素周期律中的原子半径规律和化合价规律判断甲是氧元素,乙是氮元素,丙是碳元素,丁是硫元素,N的含氧酸有HNO2、HNO3,S的含氧酸有H2SO3、H2SO4,酸性强弱无法判断,A项错误;O的非金属性大于N的非金属性,B项错误;H2O的沸点大于H2S的沸点,C项正确;C的单质可能为同素异形体,同位素是同种元素不同原子的互称,D项错误。
答案:C
6.下表为几种短周期元素的性质:
元素编号
①
②
③
④
⑤
⑥
⑦
⑧
原子半径(10-1nm)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最低化合价
-2
+2
+1
+5
-3
+7
-1
+1
+5
-3
+3
对上述元素有关说法正确的是( )
A.元素④的原子序数小于元素⑦的原子序数
B.②、③处于同一周期
C.上述八种元素中,最高价氧化物对应水化物酸性最强的元素是⑤
D.⑧号元素原子结构示意图为:
解析:①~⑧都为短周期元素,①有最低价-2价,处于ⅥA族,没有最高价,则①为O;④、⑦都有最低价-3价,最高价+5价,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;⑤有+7、-1价,处于ⅦA族,且原子半径比①大,则⑤为Cl;③、⑥都有+1价,处于ⅠA族,⑥的原子半径较大,且③不是所有元素中原子半径最小的元素,则③为Li、⑥为Na;②有+2价,处于ⅡA族,原子半径大于Li,则②为Mg。⑧有+3价且原子半径比O大,比P小,则⑧为B。④为P、⑦为N,P的原子序数大于N,故A项错误;②为Mg,③为Li,二者为不同周期的元素,B项错误;⑤为Cl,八种元素中,元素的非金属性最强,其最高价氧化物对应水化物的酸性最强,C项正确;⑧为B,其原子序数为5,D项错误。
答案:C
7.现有部分短周期主族元素的性质与原子(或分子)结构如下表:
元素编号
元素性质与原子(或分子)结构
T
最外层电子数是次外层电子数的3倍
X
常温下单质为双原子分子,分子中含有3对共用电子对
Y
M层电子数与K层电子数相同
Z
第三周期元素的简单离子中半径最小
下列说法正确的是( )
A.Z的氧化物对应的水化物可以溶于氨水
B.T与氢形成的化合物中不可能含非极性键
C.Y与Z的单质分别与相同浓度的盐酸反应,Y的反应要剧烈些
D.X和Y两元素之间有可能形成共价键
解析:
T的最外层电子数是次外层电子数的3倍,次外层电子数为2,最外层电子数为6,所以T为O;常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N;Y的M层电子数与K层电子数相同,所以质子数为12,即Y为Mg;第三周期元素的简单离子中半径最小的为Al3+,所以Z为Al。Z的氧化物对应的水化物为Al(OH)3,不能溶于氨水,A项错误;T与氢形成的化合物H2O2中含有非极性键,B项错误;金属性Mg>Al,其单质分别与相同浓度的盐酸反应,Mg的反应要剧烈些,C项正确;X(N)和Y(Mg)形成的化合物是离子化合物,不存在共价键,D项错误。
答案:C
8.X、Y、Z、W四种短周期主族元素,原子序数依次增大,其中X的简单气态氢化物可与其最高价含氧酸反应生成离子化合物,Y与Z同主族,W的最高价含氧酸是同周期元素中最强的无机酸。下列说法正确的是( )
A.钠元素与Y元素可形成化合物Na2Y2
B.最简单氢化物的沸点:YCl->O2-,C项错误;Cl2与NaOH的反应中,Cl2既表现氧化性又表现还原性,D项错误。
答案:A
9.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:WZ
解析:由题意可知X为Na,则Z为Cl,W、Y分别为O、S。A项,离子半径:Cl->O2->Na+,即X<W<Z,错误;B项,W与X形成的化合物为Na2O或Na2O2
,二者溶于水后都生成NaOH,所得溶液均呈碱性,正确;C项,非金属性O>S,故气态氢化物的热稳定性:H2O>H2S,即W>Y,错误;D项,元素的非金属性Y(S)<Z(Cl),则最高价氧化物的水化物的酸性:Y<Z,错误。
答案:B
10.已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是( )
A.原子半径:X>Y>Z>W
B.W的含氧酸的酸性比Z的含氧酸的酸性强
C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D.若W与X原子序数差为5,则形成化合物的化学式为X3W2
解析:由于原子序数按W、X、Y、Z依次增大,W与Z是同一主族的元素,而X、Y、Z是同一周期的元素,且只有X是金属元素,则这四种元素在周期表中的相对位置为:,则原子半径X>Y>Z>W,A项正确;若W为N元素,酸性;HNO2Y,气态氢化物的稳定性W>Y,C项错误;若W与X原子序数差5,当W为N元素,则X为Mg元素,可形成Mg3N2,当W为O元素,则X为Al元素,可形成Al2O3,D项错。
答案:A
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为34。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:XW
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
解析:据题意得,X原子核外最外层电子数是其电子层数的2倍,可知X为碳元素;X、Y的核电荷数之比为3:4,则Y为8号元素,应为氧元素;金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为钠元素;又W-的最外层为8电子结构,结合四种元素原子序数依次增大,故W为氯元素。A项,碳和氧形成的化合物主要为CO、CO2
,其中CO不能与氢氧化钠反应,错误;B项,原子半径:C>O,Na>Cl,错误;C项,化合物Na2O中只存在离子键,而NaClO3存在离子键和共价键,错误;D项,O3、Cl2、ClO2等可用作水的消毒剂,正确。
答案:D
12.如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误的是( )
X
A
Y
C
B
A.原子半径大小:Y>C>X>A
B.Y和B形成的化合物中Y和B的原子个数比为2:3
C.X、C、A中最高价氧化物对应的水化物的酸性最强的是A
D.A、B均为非金属元素,所以两者的氢化物相遇不发生反应
解析:由题图可知,A为N,B为S,C为Si,X为C,Y为Al。同周期元素从左至右原子半径依次减小,同主族元素从上至下原子半径依次增大,所以原子半径:Al>Si>C>N,A正确;Al和S形成的化合物为Al2S3,分子中Al和S的原子个数比为2:3,B正确;C、Si、N中,非金属性最强的是N,所以最高价氧化物对应的水化物酸性最强的是N,C正确;A、B均为非金属元素,N的氢化物为氨气,S的氢化物为硫化氢,二者相遇可以发生反应,D错误。
答案:D
13.X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
X
Y
Z
W
A.W的原子序数不可能是Y的原子序数的2倍
B.Z元素的原子半径一定比Y元素的大
C.X的气态氢化物的稳定性一定比Y的强
D.Z元素的最高价氧化物对应的水化物一定是强碱
解析:若Y、W分别为O、S,W的原子序数是Y的2倍,A错;X的非金属性一定小于Y,则X的气态氢化物的稳定性比Y的弱,C错;无法确定Z元素的位置,所以不能确定其最高价氧化物对应的水化物的酸碱性及其强弱,D错。
答案:B
14.随着原子序数的递增,八种短周期元素(x~h)原子半径的相对大小、最高正价或最低负价的变化如下图所示。下列说法错误的是( )
A.y在元素周期表的位置是第二周期ⅣA族
B.d元素常见离子的半径大于f元素常见离子的半径
C.x、z元素能组成一种四原子共价化合物,其电子式可以表示为
D.e、f的最高价氧化物对应的水化物可以相互反应
解析:由变化图中原子半径的大小可知x位于第一周期,y、z、d位于第2周期,e、f、g、h位于第3周期,再根据元素的化合价可推出x为H,y、z、d分别为C、N、O,e、f、g、h分别为Na、Al、S、Cl。y(C)在元素周期表的位置是第二周期ⅣA族,A项正确;O2-、Al3+具有相同的电子层结构,而核电荷数OAl3+,B项正确;x、z元素能组成一种四原子共价化合物为NH3,其电子式为,C项错误;e、f的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者可以相互反应,D项正确。
答案:C
能力题
15.下面是元素周期表的一部分,参照元素①~⑧在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________________。
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:________________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为________________。
解析:由元素在周期表中的位置,可知:①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl。
(1)同周期元素自左而右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,故原子半径:Na>Si>O。
(2)非金属性越强,最高价含氧酸的酸性越强,由于非金属性Cl>C>Si,故酸性:HClO4>H2CO3>H2SiO3。
(3)H、O、Na、Cl四种元素形成的既含离子键又含非极性共价键的离子化合物为Na2O2,其电子式为。
(4)⑤的同周期相邻主族元素的单质为Mg,②和④组成的能与Mg反应的化合物为CO2,Mg在二氧化碳中燃烧生成MgO和碳单质,其反应的化学方程式为:2Mg+CO22MgO+C。
(5)⑦的单质为Si,⑤的最高价氧化物的水化物为NaOH,二者反应生成硅酸钠与氢气,反应的离子方程式为:Si+2OH-+H2O===SiO+2H2↑。
答案:(1)Na>Si>O
(2)HClO4>H2CO3>H2SiO3
(3)
(4)2Mg+CO22MgO+C
(5)Si+2OH-+H2O===SiO+2H2↑
16.五种短周期元素的部分性质数据如下:
元素
T
X
Y
Z
W
原子半径(nm)
0.037
0.075
0.099
0.102
0.143
最高或最低化合价
+1
+5,-3
+7,-1
+6,-2
+3
请回答下列问题:
(1)Z离子的结构示意图为________。
(2)关于Y、Z两种元素,下列叙述正确的是______(填序号)。
a.简单离子的半径Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中立即有甲放出,原因是____________________________________。
一段时间后,观察到试管中的现象是_______________,发生反应的离子方程式是_____________。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被NaOH溶液吸收的化学方程式是:2XO2+2NaOH===M+NaXO3+H2O(已配平),产物M中元素X的化合价为________。
解析:(1)先根据化合价的数值判断出各元素的主族序数,再结合原子半径的变化规律得出:T为H,X为N,Y为Cl,Z为S,W为Al。
(2)因为Cl比S元素的非金属性强,故HCl比H2S稳定性强。
(3)AlCl3与NH3·H2O反应只能生成Al(OH)3沉淀。
(4)由原子守恒可得2NO2+2NaOH===NaNO2+NaNO3+H2O,故NaNO2中N元素化合价为+3。
答案:(1) (2)b
(3)把浓氨水滴到NaOH固体上,NaOH固体可吸收水,并且溶液中OH-浓度增大,可使平衡NH3+H2ONH3·H2ONH+OH-向左移动,且过程中放热,故有利于NH3放出 生成白色沉淀 Al3++3NH3·H2O===Al(OH)3↓+3NH (4)+3