- 480.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安徽省皖南八校2020届高三第三次联考
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.中华传统文化中蕴含着丰富的化学知识。下列说法错误的是( )
A.“零落成泥碾作尘,只有香如故”中的“香”体现了分子是由原子构成的
B.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,涉及的操作是蒸馏
C.《抱朴子》中“丹砂(HgS)烧之成水银,积变又还成丹砂”,涉及的反应是分解和化合
D.李商隐的《无题》诗句中的“春蚕到死丝方尽”中的蚕丝的主要成分是蛋白质
8.化合物1,1二环丙基乙烯是重要的医药中间体。下列有关该化合物的说法正确的是( )
A.分子中所有碳原子共平面 B.其同分异构体可能是苯的同系物
C.-氯代物有4种 D.可以发生加成反应、氧化反应和加聚反应
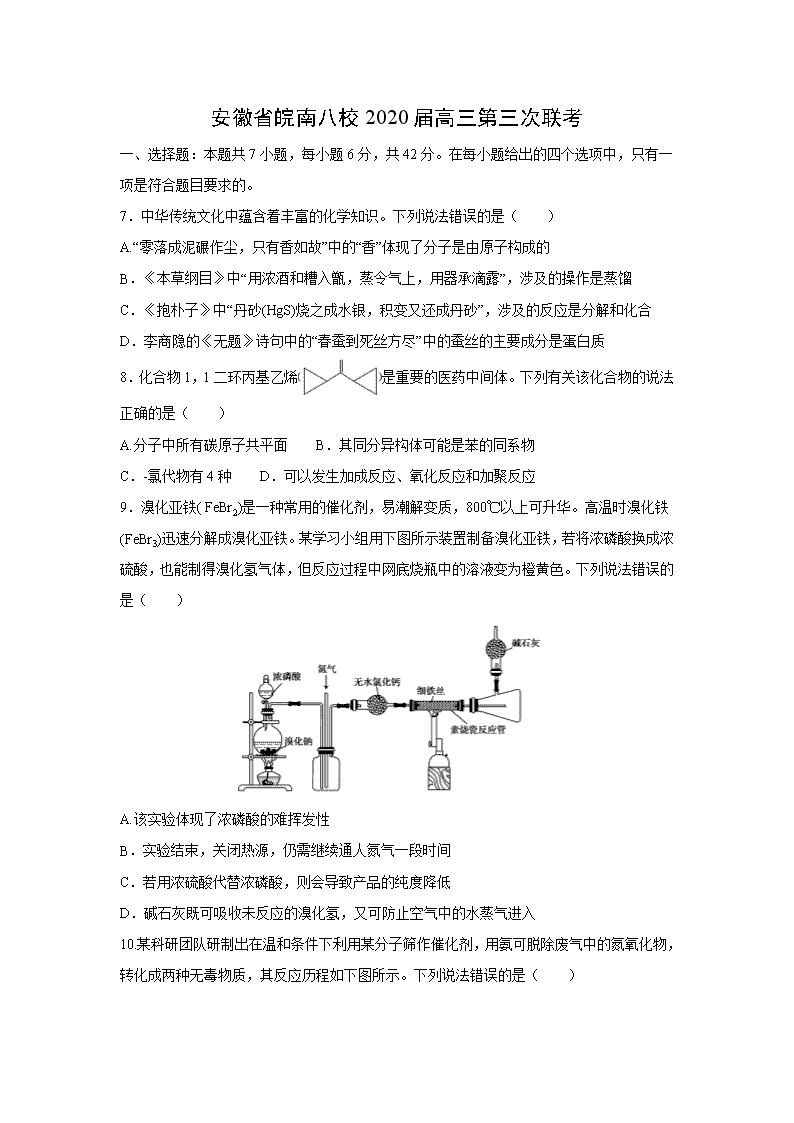
9.溴化亚铁( FeBr2)是一种常用的催化剂,易潮解变质,800℃以上可升华。高温时溴化铁(FeBr3)迅速分解成溴化亚铁。某学习小组用下图所示装置制备溴化亚铁,若将浓磷酸换成浓硫酸,也能制得溴化氢气体,但反应过程中网底烧瓶中的溶液变为橙黄色。下列说法错误的是( )
A.该实验体现了浓磷酸的难挥发性
B.实验结束,关闭热源,仍需继续通人氮气一段时间
C.若用浓硫酸代替浓磷酸,则会导致产品的纯度降低
D.碱石灰既可吸收未反应的溴化氢,又可防止空气中的水蒸气进入
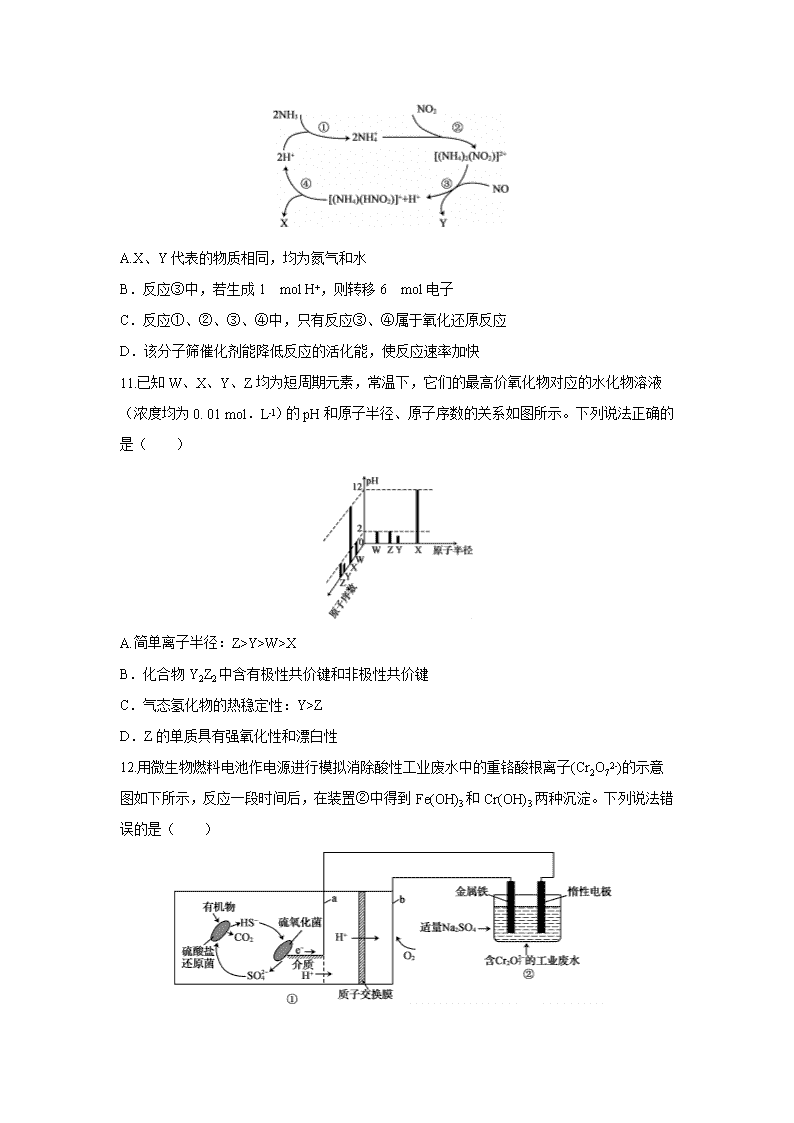
10.某科研团队研制出在温和条件下利用某分子筛作催化剂,用氨可脱除废气中的氮氧化物,转化成两种无毒物质,其反应历程如下图所示。下列说法错误的是( )
A.X、Y代表的物质相同,均为氮气和水
B.反应③中,若生成1 mol H+,则转移6 mol电子
C.反应①、②、③、④中,只有反应③、④属于氧化还原反应
D.该分子筛催化剂能降低反应的活化能,使反应速率加快
11.已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为0. 01 mol.L-l)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
A.简单离子半径:Z>Y>W>X
B.化合物Y2Z2中含有极性共价键和非极性共价键
C.气态氢化物的热稳定性:Y>Z
D.Z的单质具有强氧化性和漂白性
12.用微生物燃料电池作电源进行模拟消除酸性工业废水中的重铬酸根离子(Cr2O72-)的示意图如下所示,反应一段时间后,在装置②中得到Fe(OH)3和Cr(OH)3两种沉淀。下列说法错误的是( )
A.装置①中,a极的电极反应为
B.向装置②中加入适量Na2SO4,其主要作用是增强溶液的导电性
C.装置①中,b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)相等
D.当装置①中有0.6 mol H+通过质子交换膜时,装置②中产生0.4 mol沉淀
13.常温下,向某二元弱酸H2Y溶液中逐滴加入NaOH溶液,混合溶液中lg X[X为或]与pH的变化关系如图所示。下列说法正确的是( )
A.曲线I表示随pH变化的关系曲线
B.由图可知,H2Y的二级电离常数Ka2( H2Y)数量级为10-10
C.从a点到b点过程中,水的电离程度先增大后减小
D.NaHY溶液中的离子浓度大小为:c(Na+)>c(HY-) >c(OH-)>c(H+)>c(Y2-)
26.(14分)五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。一种以粗钒(主要含有V2O5、V2O4,还有少量Fe3O4、Al2O3、SiO2等)为原料生产五氧化二钒的工艺流程如下:
已知:
①部分含钒物质的溶解情况:(VO2)2SO4易溶于水,VOSO4可溶于水,NH4VO3难溶于水。
②部分金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物及氢氧化物溶解与pH的关系如下表:
回答下列问题:
(l)“研磨”的目的是 ,“酸溶”时V2O5发生反应的化学方程式为 。
(2)加入NaCIO溶液,含钒元素的粒子发生反应的离子方程式为 。
(3)向三颈烧瓶中加入NaOH溶液时实验装置如图所示,虚线框中最为合适的仪器是 (填标号),调节溶液的pH范围为 ,滤渣b为 (写化学式)。
(4)实验显示,沉钒率的高低与温度有关,下图是沉钒率随温度的变化曲线,则沉钒时的加热方法为 。温度高于80℃,沉钒率下降,其可能原因是
27.(14分)已知某钴酸锂(LiiCoO2)电池中含有少量的铝、铁、碳等单质。为实现绿色环保,某化学兴趣小组在实验室尝试对废旧钴酸锂电池进行回收再利用,实验流程如下:
已知:Fe3+和C2O42-结合生成较稳定的[Fe(C2O4)3]3-;在强酸性条件下,[Fe(C2O4)3]3-分解生成Fe3+。
回答下列问题:
(l)操作①中使用的主要玻璃仪器有___________________________。
(2)溶液①到固体②的离子方程式为_________________________________。
(3)已知溶液③中含有CoCl2、LiCl等溶质,则LiCoO2和盐酸反应的化学方程式为____________________________________________________________.
(4)向溶液③中加入草酸铵得到CoC2O4.2H2O固体的实验操作为__________、____________、过滤、洗涤、干燥。
(5)能说明Li2CO3固体已洗涤干净的实验操作方法是_________________________________
_____________________________________________________________.
(6)溶液⑤中铁元素以离子______(填离子符号)形式存在,然后加入__________(填化学式)试剂,再进行后续操作。
(7)已知固体失重率为对应温度下样品失重的质量与样品的初始质量之比。现在空气中加热一定质量的CoC2O4.2H2O固体样品时,若在300--350℃时其固体失重率为59.0%,则生成的固体为__________________(填化学式)。
28.(15分)碳、氮、硫的化合物在生产、生活中广泛存在。回答下列问题:
(l)甲烷不仅能用作燃料,还可用于生产合成气(CO+H2)。CH4与H2O(g)通人聚焦太阳能反应器,发生反应:CH4 (g)+H2O(g)=CO(g)+3H2 (g) △H。已知:CH4、H2、CO的燃烧热△H分别为-a kJ/mol、-b kJ/mol、-c kJ/mol,lmol H2O的气化热△H为+dkJ/mol (a、b、c、d均大于0),则反应CH4 (g)+H2O(g)=CO (g)+3H2(g)的△H= ____________kJ.mol-l.
(2)在某密闭容器中发生反应:2CO2(g)=2CO(g)+O2(g),0.995 mol CO2在不同温度下的平衡分解情况如图所示。
①图中a、b、c三点的平衡常数K(a)、K(b)、K(c)的大小关系为______________________。
②若1660℃时反应达到平衡状态,且容器体积为1L,则该温度下,该反应的逆反应2CO(g)+O2(g)=2CO2 (g)的平衡常数K= ____________L·mol-l。
③恒温恒容条件下,能表示该可逆反应达到平衡状态的是______(填标号)。
A. CO的体积分数与O2的体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
(3)烟道气中的SO2和CO2可用氢氧化钠溶液或氢氧化钡溶液来吸收。
①下列事实中,能比较碳酸与亚硫酸的酸性强弱的是 (填标号)。
A.25℃下,饱和碳酸溶液的pH大于饱和亚硫酸溶液的pH
B.25℃下,等物质的量浓度的NaHCO3溶液的pH大于NaHSO3溶液的pH
C.将SO2气体通人NaHCO3溶液,再将逸出的气体通入澄清石灰水中,石灰水变浑浊
D.滴定等量的氢氧化钠溶液至中性时消耗的碳酸溶液的体积比亚硫酸溶液的体积多
②25℃时,Ksp(BaSO3)=5.46×10-7,Ksp( BaCO3)=2.6×10-9。该温度下,BaSO3和BaCO3沉淀共存的悬浊液中,=____________。
(4)光化学烟雾中的NO2可以被NaOH溶液吸收生成两种钠盐,溶液呈碱性,反应的离子方程式为________________________________________________。已知常温下,HNO2的电离平衡常数Ka=5.0×10-4,则0. 05 mol.L-1 NaNO2溶液的pH为____________。
35.[化学——选修3:物质结构与性质](15分)
铝、铁、铜等金属在日常生活中应用广泛,钛由于其特殊的性能被誉为“未来世纪的金属”。回答下列问题:
(l)下列有关说法正确的是______(填标号)。
A.铜元素焰色反应的光谱为吸收光谱
B.铝晶体中的作用力没有方向性和饱和性
C.在单质或化合物中,铁的配位数都是6
D.四水合铜离子中,配位原子的VSEPR模型为V形
(2)氯化铝熔点很低,加热容易升华。
①基态Al原子的价层电子排布式为__________________。
②固态AICl3的晶体类型是____________,加热升华后以二聚物Al2C16形式存在,Al2Cl6中铝原子的杂化形式为____________。
③离子[AlCl4]-的立体构型为____________。
(3)甘氨酸亚铁[(H2NCH2COO)2Fe]可用于改善缺铁性贫血。Fe2+中电子占据最高能级的空间运动状态有______
个。甘氨酸亚铁中位于第二周期的非金属元素的第一电离能由大到小的顺序为________________,由其中不同的两种元素形成的等电子体分子是______(写出两种分子式)。
(4)[Ti(H2O)6]C13和[Ti(H2O)5Cl]C12.H2O是TiC13六水合物的两种晶体,这两种晶体所含元素的电负性由大到小的顺序为____________________。
(5)Cu2O晶体的品胞如图所示;
①该晶胞中原子坐标参数A为(0,0,0);B为(1,0,0);C为。则D的原子坐标参数为__________________。
②已知Cu2O晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则其中两个Cu+之间的距离为____________pm(列出计算表达式)。
36.[化学——选修5:有机化学基础](15分)
有机物G是一种重要的医用药物,其合成路线如下:
已知:A中不含有甲基,
回答下列问题:
(I)A中的官能团名称是__________________。
(2)②的反应类型是____________。
(3)C的化学名称为__________________。
(4)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出 F的结构简式,并用星号(*)标出 F中的手性碳____________。
(5)①的化学方程式为__________________________________________。
(6)已知化合物H是D的同分异构体,则满足下列条件的H共有______种(不考虑立体异构);其中核磁共振氢谱为四组峰,峰面积之比为2:2:1:1的结构简式为________________。
①遇氯化铁溶液显紫色 ②与碳酸氢钠溶液反应产生CO2气体
(7)设计由HOOCCH2CH2OH制备化合物G的合成路线:__________________________________________________________(无机试剂任选)。
【参考答案】