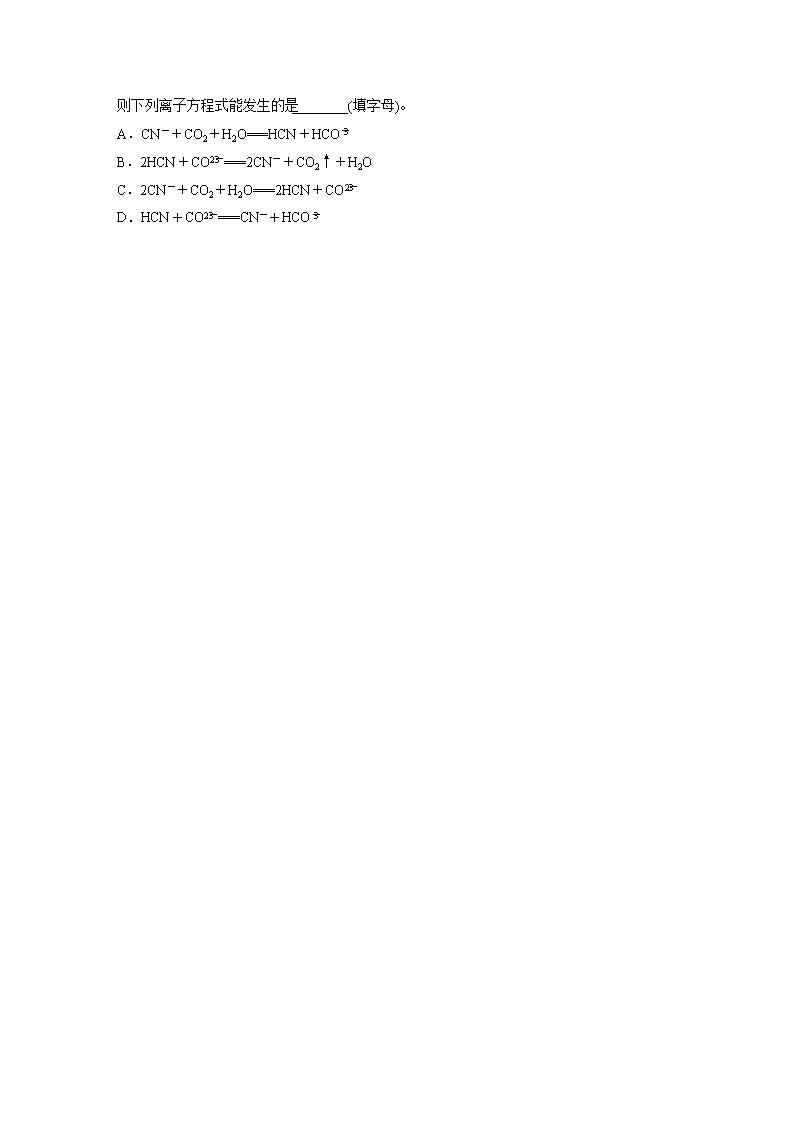- 446.71 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.下列关于卤素(用X表示)的叙述正确的是( )
A.其单质都能与水反应,通式为X2+H2O HX+HXO
B.HX易溶于水,其水溶液都是强酸
C.其单质都有颜色,都有毒
D.最高价含氧酸的通式为HXO4
2.根据卤素性质的递变规律,推测卤素——砹(At)及其化合物不可能具有的性质是( )
A.砹单质为有色固体,易溶于有机溶剂
B.HAt十分稳定
C.AgAt为有色的、难溶于水的盐
D.NaAt易溶于水
3.(2020·成都调研)有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
A.7∶4 B.7∶3 C.7∶2 D.7∶1
4.下列叙述中正确的是( )
A.氯水久置过程中,氯水的氧化性增强,酸性减弱
B.用硝酸酸化的AgNO3溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液
C.向某溶液中加入CCl4,振荡、静置后,CCl4层显紫红色,证明原溶液中存在I-
D.某浅黄色的溴水,加CCl4振荡、静置后,上层显橙红色
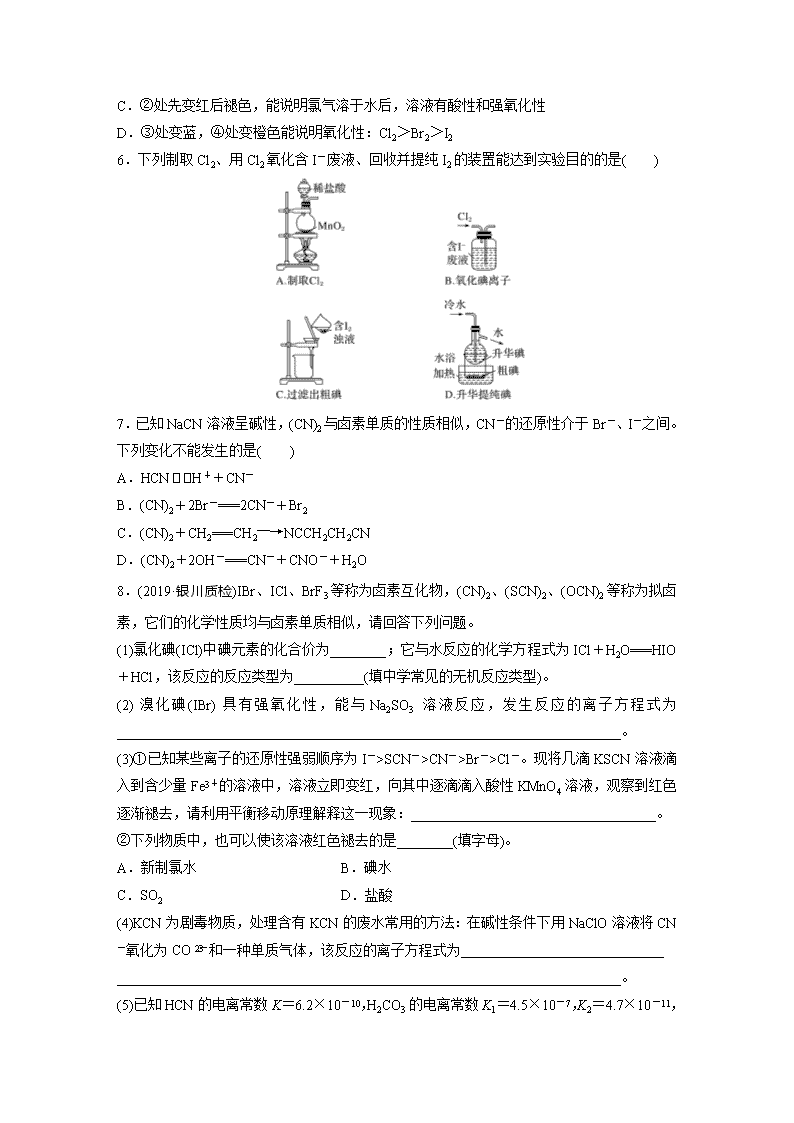
5.氯气性质的微型实验装置如图所示,①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有石蕊溶液、淀粉KI溶液、KBr溶液,含KSCN的FeCl2几种溶液,实验时滴几滴浓盐酸,
下列说法不正确的是( )
A.产生氯气的离子方程式为:16H++10Cl-+2MnO===2Mn2++5Cl2↑+8H2O
B.⑤处变红色,发生反应为:2Fe2++Cl2===2Fe3++2Cl-,Fe3++3SCN-===Fe(SCN)3
C.②处先变红后褪色,能说明氯气溶于水后,溶液有酸性和强氧化性
D.③处变蓝,④处变橙色能说明氧化性:Cl2>Br2>I2
6.下列制取Cl2、用Cl2氧化含I-废液、回收并提纯I2的装置能达到实验目的的是( )
7.已知NaCN溶液呈碱性,(CN)2与卤素单质的性质相似,CN-的还原性介于Br-、I-之间。下列变化不能发生的是( )
A.HCNH++CN-
B.(CN)2+2Br-===2CN-+Br2
C.(CN)2+CH2===CH2―→NCCH2CH2CN
D.(CN)2+2OH-===CN-+CNO-+H2O
8.(2019·银川质检)IBr、ICl、BrF3等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称为拟卤素,它们的化学性质均与卤素单质相似,请回答下列问题。
(1)氯化碘(ICl)中碘元素的化合价为________;它与水反应的化学方程式为ICl+H2O===HIO+HCl,该反应的反应类型为__________(填中学常见的无机反应类型)。
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液反应,发生反应的离子方程式为________________________________________________________________________。
(3)①已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。现将几滴KSCN溶液滴入到含少量Fe3+的溶液中,溶液立即变红,向其中逐滴滴入酸性KMnO4溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象:___________________________________。
②下列物质中,也可以使该溶液红色褪去的是________(填字母)。
A.新制氯水 B.碘水
C.SO2 D.盐酸
(4)KCN为剧毒物质,处理含有KCN的废水常用的方法:在碱性条件下用NaClO溶液将CN-氧化为CO和一种单质气体,该反应的离子方程式为_____________________________
________________________________________________________________________。
(5)已知HCN的电离常数K=6.2×10-10,H2CO3的电离常数K1=4.5×10-7,K2=4.7×10-
11,则下列离子方程式能发生的是________(填字母)。
A.CN-+CO2+H2O===HCN+HCO
B.2HCN+CO===2CN-+CO2↑+H2O
C.2CN-+CO2+H2O===2HCN+CO
D.HCN+CO===CN-+HCO
答案精析
1.C [F2与水反应的化学方程式为2F2+2H2O===4HF+O2,A项错误;氢氟酸为弱酸,B项错误;F没有正价,不存在含氧酸,D项错误。]
2.B
3.B [设Cl-、Br-、I-的物质的量分别为2 mol、3 mol、4 mol,由电荷守恒可得:2n(Fe2+)=n(Cl-)+n(Br-)+n(I-)=2 mol+3 mol+4 mol=9 mol,n(Fe2+)=4.5 mol,通入氯气后,要满足n(Cl-)∶n(Br-)=3∶1,Cl-只要增加7 mol就可以,即需通入氯气3.5 mol。4 mol I-先消耗2 mol氯气,3 mol Fe2+消耗1.5 mol氯气,剩余Fe2+1.5 mol,则通入氯气与剩余Fe2+的物质的量之比为3.5∶1.5=7∶3,故选B。]
4.B 5.D
6.D [实验室利用MnO2与浓盐酸在加热条件下反应制取Cl2,不能用稀盐酸,A错误;Cl2通入含I-废液中氧化I-生成I2,通入Cl2的导管应长进短出,B错误;从含I2浊液中提取碘,要加入CCl4等有机溶剂萃取,再通过蒸馏法进行分离,不能采用过滤的方法,C错误;I2易升华,故常采用升华法提纯碘,D正确。]
7.B
8.(1)+1 复分解反应 (2)IBr+SO+H2O===I-+Br-+SO+2H+ (3)①酸性高锰酸钾溶液将SCN-氧化,减小了SCN-的浓度,使反应Fe3++3SCN-Fe(SCN)3的平衡不断向左移动,最终Fe(SCN)3完全反应,红色消失 ②AC
(4)2CN-+5ClO-+2OH-===2CO+5Cl-+N2↑+H2O (5)AD
解析 (1)Cl原子得电子能力强于I原子,则ICl中Cl元素显-1价、I元素显+1价;此反应中没有化合价的变化,属于复分解反应(非氧化还原反应)。
(2)IBr具有强氧化性,I元素显+1价,被还原成I-,SO被氧化成SO,因此离子方程式为IBr+SO+H2O===I-+Br-+SO+2H+。
(3)①溶液立即变红,发生反应Fe3++3SCN-Fe(SCN)3,加入酸性KMnO4溶液红色褪去,说明KMnO4把SCN-氧化,促使上述平衡向逆反应方向移动,最终Fe(SCN)3完全反应,溶液红色褪去;②能使红色褪去的物质,可以具有强氧化性,如新制氯水中Cl2将SCN-氧化,也可以具有还原性,如SO2将Fe3+还原,故A、C正确。
(4)CN-中N元素显-3价,C元素显+2价,另一种单质气体为N2,因此反应的离子方程式为2CN-+5ClO-+2OH-===2CO+N2↑+5Cl-+H2O。
(5)根据电离常数大小,推出酸电离出氢离子的能力强弱顺序(酸性强弱)为H2CO3>HCN>HCO,根据“强酸制取弱酸”的规律知,A、D正确。