- 138.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课题2 人工固氮技术-------合成氨同步试题
1对于可逆反应 H<0,下列说法正确的是( )
A.达到平衡时反应物和生成物浓度一定相等
B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时减小
C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以反应向逆反应的速率移动
D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率
答案:B
2关于氨的合成工业的下列说法正确的是 ( )
A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低
B.由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行
D.合成氨工业采用10 MPa ~ 30MPa ,是因该条件下催化剂的活性最好
答案:B
3在合成氨工业中,为增加氨的日产量,下列变化过程中不能使平衡向右移动的是( )
A. 不断将氨分离出来 B.使用催化剂
C. 采用500C左右的温度 D. 采用10~30MPa的压强
答案:B C
4.合成氨所需的H2可由煤和水蒸气反应而制得,其中一步的反应为:
CO+H2O(g) CO2+H2(正反应放热),下列措施中,能提高CO转化率的是( )
A.增大压强 B.降低温度
C.增大水蒸气浓度 D.增大CO浓度
答案:BC
5.在合成氨时,可以提高H2转化率的措施是 ( )
A.延长反应时间 B.充入过量H2
C.充入过量N2 D.升高温度
答案:C
6、下列有关合成氨工业的途述,可用勒沙特列原理来解释的是( )
A、使用铁触媒,使N2和H2混合气体有利于合成氨
B、高压比常压条件更有利于合成氨的反应
C、5000C左右比室温更有利于合成氨的反应
D、合成氨时采用循环操作,可提高原料的利用率
4
答案:B
7、(正反应为吸热反应),为了有利于Z的生成,应采用的反应条件是 ( )
A、高温高压 B、高温低压 C、低温高压 D、低温高压
答案:A
8.在3H2 + N2 2NH3反应中,使用催化剂的理由是( )。
A.使平衡向正反应方向移动 B.没有催化剂该反应不能发生
C.使化学反应速率增大 D.遏止逆反应的发生
答案:C
9.工业合成氨的反应是在500℃左右进行,主要原因是( )
A.500℃时反应速率最快
B.500℃时 的平衡浓度最大
C.500℃时 的转化率最高 D.500℃时催化剂能发挥最大效力
答案:D
10、对于可逆反应下列说法正确的是( )
A.达平衡时反应物和生成物的浓度都相等
B.达平衡后加入,当重新达到平衡时,的平衡浓度比原平衡时增大,的浓度比原平衡时减少(反应前后体积不变)。
C.达到平衡时,升高温度,加快了吸热反应速率,降低了放热反应速率,所以平衡向逆反应方向移动。
D.达平衡后加入,当重新达到平衡时,在混合气中体积分数增大。
答案:BD
11. 合成氨厂所需可由煤与水反应制得,其中有一步反应为
,欲提高转化率可采用的方法是( )
①降低温度;②增大压强;③使用催化剂;④增大浓度;⑤增大水蒸气浓度
A.①②③ B.④⑤ C.①⑤ D.⑤
答案:C
12、在总压强为3×105帕下,将氮、氢混和气体通入合成塔,反应达平衡时,按的体积百分含量为20%,平衡时压强为( )
A、1×107帕 B、2.5×107帕 C、5×107帕 D、10×107帕
答案:B
14、某温度时,在一体积为2L的密闭容器中,通入112和24此时容器内压强为p大气压。在该温度和催化剂作用下,H2和N2反应达到平衡,测得平衡时压强为0.95p大气压,下列说法不正确的是( )
A.平衡时,N2物质的量是3.6 mol
B.平衡时,H2的物质的量是10.8mol
C.平衡时,N2的转化率10%
D.NH3的体积百分含量是10%
答案:D
4
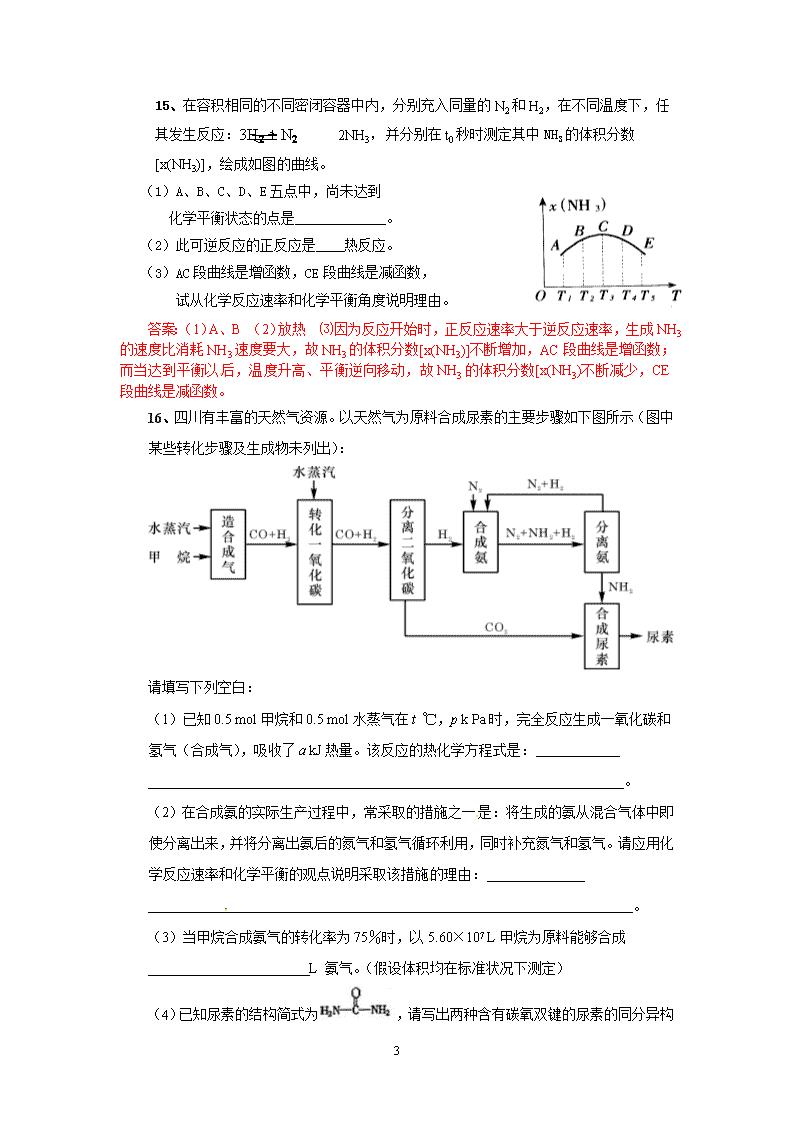
15、在容积相同的不同密闭容器中内,分别充入同量的N2和H2,在不同温度下,任其发生反应:3H2 + N2 2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
(1)A、B、C、D、E五点中,尚未达到
化学平衡状态的点是_____________。
(2)此可逆反应的正反应是____热反应。
(3)AC段曲线是增函数,CE段曲线是减函数,
试从化学反应速率和化学平衡角度说明理由。
答案:(1)A、B (2)放热 ⑶因为反应开始时,正反应速率大于逆反应速率,生成NH3的速度比消耗NH3速度要大,故NH3的体积分数[x(NH3)]不断增加,AC段曲线是增函数;而当达到平衡以后,温度升高、平衡逆向移动,故NH3的体积分数[x(NH3)不断减少,CE段曲线是减函数。
16、四川有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是:
。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中即使分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请应用化学反应速率和化学平衡的观点说明采取该措施的理由:
。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成
L 氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为
4
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:① ,② 。
【答案】(1)CH4(g)+H2O(g)CO(g)+3H2(g);△H=2a kJ/mol
(2)增大氮气和氢气的浓度有利于增大反应速率;减小氨气的浓度,增大氮气和氢气的浓度都有利于平衡向正反应方向移动。
(3)1.12×108
(4)
4