- 513.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019-2020学年下学期高三5月第二次教学质量检测
理科综合部分化学试卷
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.考试结束后,请将本试题卷和答题卡一并上交。
相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137
一、单选题(每小题6分,共42分。每小题只有一个选项符合题目要求。)
7.化学与生活、环境、科技等密切相关。下列说法错误的是
A.温室效应导致海水的酸度增大,贝壳类生物的生存将会受到威胁
B.植物油的主要成分是不饱和高级脂肪酸甘油酯,长时间放置的植物油会因水解而变质
C.常温下用3体积乙醇与1体积蒸馏水配制成的混合液,可以灭活新型冠状病毒
D.白葡萄酒含维生素C等多种维生素,通常添加微量SO2的目的是防止营养成分被氧化
8.现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是
A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8mol NaOH发生反应
9.若NA表示阿伏加德罗常数,则下列说法不正确的是
A.23g钠在空气中充分燃烧,转移的电子数为NA
B.50ml 12mol/L的盐酸与足量的MnO2共热,充分反应后,转移电子数为0.3NA
C.0.6mol过氧化钠晶体中所含阴离子的数目为0.6NA
D.常温常压下,8.8g N2O和CO2混合气体所含的原子总数为0.6NA
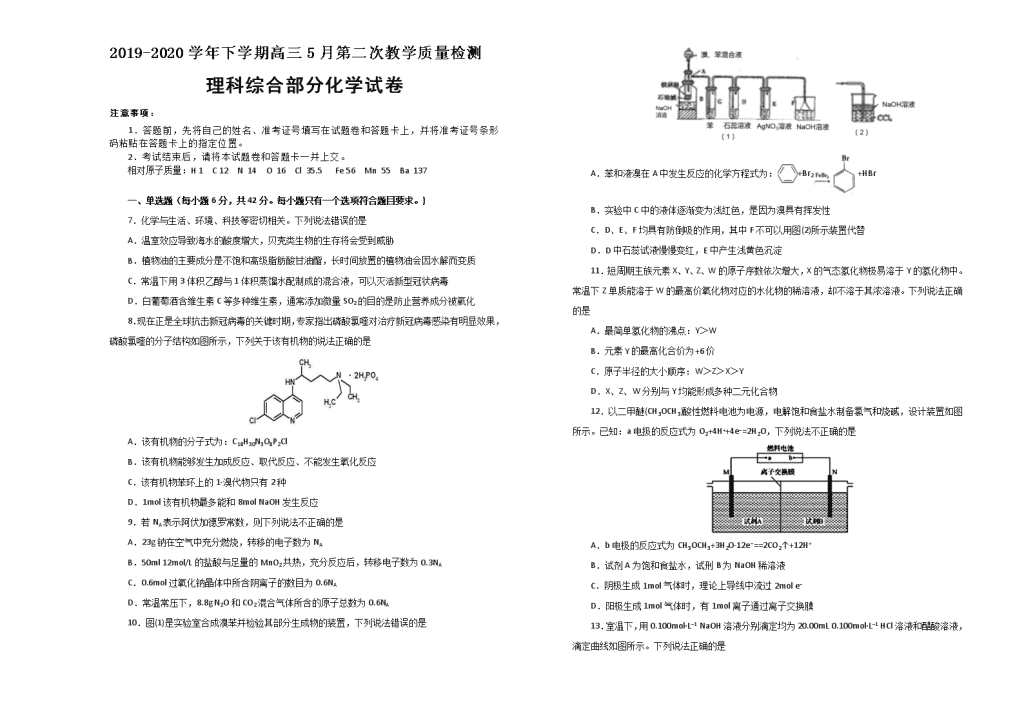
10.图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是
A.苯和液溴在A中发生反应的化学方程式为:+Br2+HBr
B.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中。常温下Z单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.最简单氢化物的沸点:Y>W
B.元素Y的最高化合价为+6价
C.原子半径的大小顺序:W>Z>X>Y
D.X、Z、W分别与Y均能形成多种二元化合物
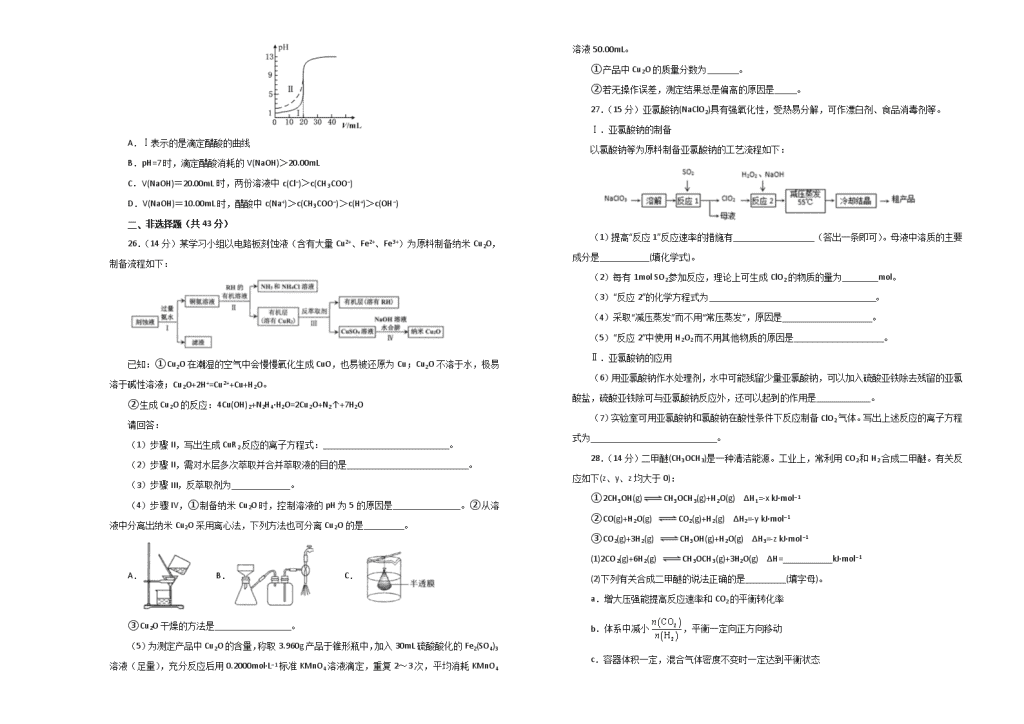
12.以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e−=2H2O,下列说法不正确的是
A.b电极的反应式为CH3OCH3+3H2O-12e−==2CO2↑+12H+
B.试剂A为饱和食盐水,试刑B为NaOH稀溶液
C.阴极生成1mol气体时,理论上导线中流过2mol e−
D.阳极生成1mol气体时,有1mol离子通过离子交换膜
13.室温下,用0.100mol·L−1 NaOH溶液分别滴定均为20.00mL 0.100mol·L−1 HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
A.Ⅰ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl−)>c(CH3COO−)
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO−)>c(H+)>c(OH−)
二、 非选择题(共43分)
26.(14分)某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu2O,制备流程如下:
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu;Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+=Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4∙H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________。
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________。
(3)步骤III,反萃取剂为_____________。
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________。②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________。
A. B. C.
③Cu2O干燥的方法是_________________。
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000mol·L−1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______。
②若无操作误差,测定结果总是偏高的原因是_____。
27.(15分)亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。
Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应1”反应速率的措施有__________________(答出一条即可)。母液中溶质的主要成分是___________(填化学式)。
(2)每有1mol SO2参加反应,理论上可生成ClO2的物质的量为________mol。
(3)“反应2”的化学方程式为_____________________________________。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是____________________。
(5)“反应2”中使用H2O2而不用其他物质的原因是____________________。
Ⅱ.亚氯酸钠的应用
(6)用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是____________。
(7)实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。写出上述反应的离子方程式为____________________________。
28.(14分)二甲醚(CH3OCH3)是一种清洁能源。工业上,常利用CO2和H2合成二甲醚。有关反应如下(z、y、z均大于0):
①2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH1=-x kJ·mol−1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-y kJ·mol−1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=-z kJ·mol−1
(1)2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=___________kJ·mol−1
(2)下列有关合成二甲醚的说法正确的是_________(填字母)。
a.增大压强能提高反应速率和CO2的平衡转化率
b.体系中减小,平衡一定向正方向移动
c.容器体积一定,混合气体密度不变时一定达到平衡状态
d.充入适量CO,可能提高CH3OCH3的产率
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g) CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,将_____(选填“增大”“减小”或“不变”)。
(4)在恒容密闭容器中用CO2和H2合成二甲醚时CO2的平衡转化率与温度、投料比的关系如图所示。
①500K时,将9mol H2和3mol CO2充入2L恒容密闭容器中,5min时反应达到平衡状态,则0~5min内的平均反应速率v(H2)=____________mol∙L−1∙min−l,该温度下,反应的平衡常数K=____(列出计算式即可,无需化简)。
②由图像可以得出的结论是_________(答两条)。
(5)工业上也可用CO和H2合成二甲醚,而且二者还能作燃料电池的燃料。以CO、H2体积比为1∶2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为______________________。
三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。)
35. 【化学——选修3:物质结构与性质】(15分)
氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]−(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH−生成[B(OH)4]−,而体现弱酸性。[B(OH)4]−中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A.离子键 B.σ键 C.π键 D.氢键 E.范德华力
(4)SF6被广泛用作高压电气设备绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系的键能。则S—F的键能为_______kJ·mol−1。
(5)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm−3。
①CuF比CuCl熔点高的原因是_____________;
②已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=__________nm(列出计算式)。
36. 【化学——选修5:有机化学基础】(15分)
化合物H具有似龙延香、琥珀香气息,香气淡而持久,广泛用作香精的稀释剂和定香剂.合成它的一种路线如图:
已知以信息:
①;
②核磁共振氢谱显示A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,溶液呈紫色;
④芳香烃F的相对分子质量介于90~100之间,0.1mol F充分燃烧可生成7.2g水;
⑤R1COOH+RCH2ClR1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是____,由C生成D的反应的化学方程式为______________。
(2)由F生成G的反应的化学方程式为____________,反应类型为____。
(3)H的结构简式为_________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有 (不考虑立体异构)_____种,其中核磁共振氢谱中有5组峰,且峰面积之比为1∶2∶2∶2∶1的同分异构体的结构简式是________(任写一种即可)。
(5)由苯酚和已有的信息经以下步骤可以合成化合物。
反应1所用的试剂为___,K的结构简式为____,反应3所用的试剂为___。
参考答案
7. B
8. D
9. B
10. C
11. A
12. D
13. C
26.(1)Cu(NH3)+2RH=2NH+2NH3+CuR2
(2) 提高铜离子的萃取率,提高原料利用率
(3) 稀硫酸
(4) pH太小氧化亚铜会发生歧化反应,pH太大,氧化亚铜会溶解 C 真空干燥
(5) 90.90% 制备氧化亚铜时,氧化亚铜被肼还原,产品中含有铜粉,测定结果均增大
27.(1)适当升高反应温度,增大吸收液浓度等 Na2SO4
(2) 2
(3) H2O2+2ClO2+2NaOH=2NaClO2+O2↑+2H2O
(4) 常压蒸发温度过高,亚氯酸钠容易分解
(5) 多余的H2O2可分解为氧气和水,不引入其它杂质
(6) Fe2+被氧化为Fe3+,Fe3+水解生成Fe(OH)3,Fe(OH)3具有胶体的性质,可以吸附水的杂质
(7) ClO+ClO+2H+=2ClO2↑+H2O
28.(1)-(x+2z)
(2) ad
(3) 减小
(4) 0.72 投料比不变,升高温度CO2的平衡转化率降低,温度不变,投料比越大,CO2的平衡转化率越大
(2) CO+2H2–6e−+8OH−=CO+6H2O
35.(1)X-射线衍射
(2) V型 H2O NH
(3) F>N>O>B sp3 AB
(4) 327
(5) 由两者的熔点可知,CuCl是分子晶体,而CuF为离子晶体,CuF离子晶体的晶格能大于CuCl分子间范德华力 ×107
36.(1)2-甲基苯酚(或邻甲苯酚)
(2) 取代反应
(3)
(4) 6 、
(5) C(CH3)3CCl/AlCl3 浓HI