- 414.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电化学基础
一、单选题(每小题只有一个正确答案)
1.下列关于电解池的说法正确的是( )
A. 电源的负极就是阴极 B. 与直流电源正极相连的是电解池的阴极
C. 与直流电源负极相连的电极上发生还原反应 D. 阳极上发生还原反应
2.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应方程式为Li+MnO2===LiMnO2,下列说法正确的是( )
A. Li是正极,电极反应式为Li-e-===Li+
B. Li是负极,电极反应式为Li-e-===Li+
C. MnO2是负极,电极反应式为MnO2+e-===MnO
D. Li是负极,电极反应式为Li-2e-===Li2+
3.将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A. 答案A B. 答案B C. 答案C D. 答案D
4.某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中不正确的是( )
A. 电源中的a为正极,b为负极,制取效果较好
B. 可以用NaCl溶液作为电解液
C. A、B两端都必须用铁作电极
D. 阴极发生的反应是:2H++2e-===H2↑
5.下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A. a为负极、b为正极 B. a为阳极、b为阴极
C. 电解过程中,d电极质量增加 D. 电解过程中,氯离子浓度不变
6.下列电池工作时,O2在正极放电的是( )
A. A B. B C. C D. D
7.取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是( )
A. b电极是阴极 B. a电极与电源的正极相连接
C. 电解过程中,水是氧化剂 D. b电极附近溶液的pH变小
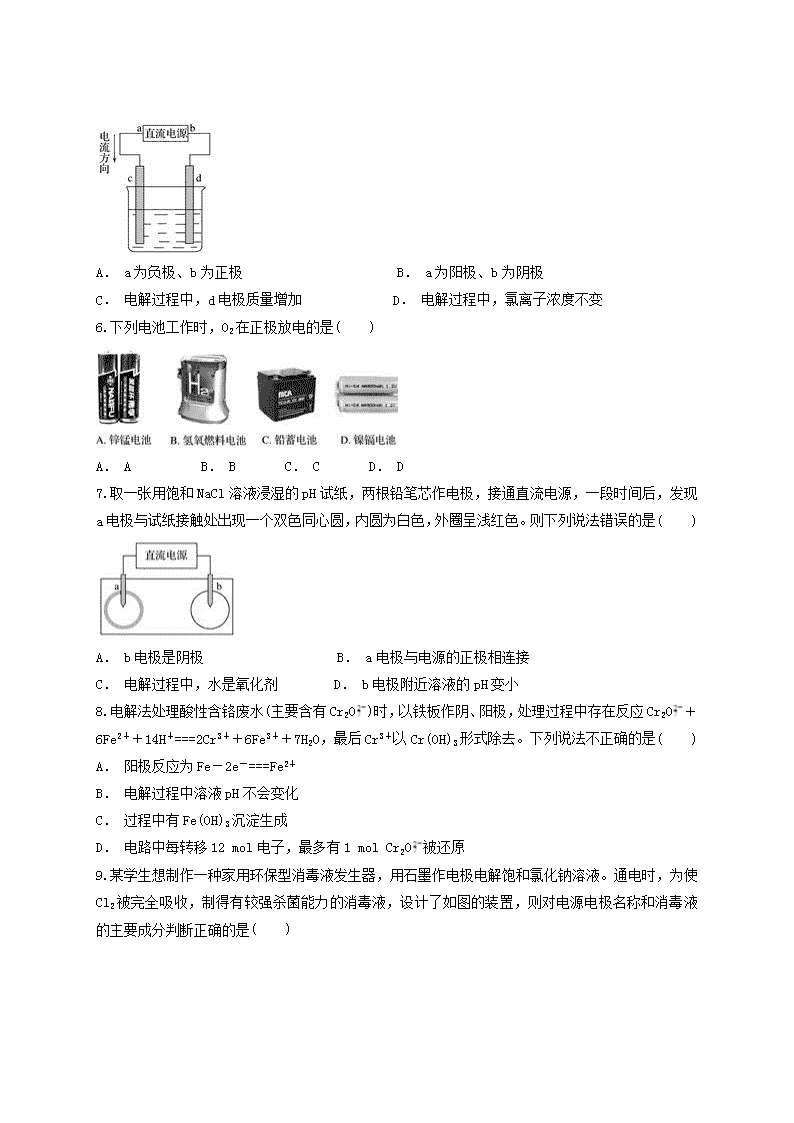
8.电解法处理酸性含铬废水(主要含有Cr2O)时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
A. 阳极反应为Fe-2e-===Fe2+
B. 电解过程中溶液pH不会变化
C. 过程中有Fe(OH)3沉淀生成
D. 电路中每转移12 mol电子,最多有1 mol Cr2O被还原
9.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A. a为正极,b为负极;NaClO和NaCl B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl D. a为阴极,b为阳极;HClO和NaCl
10.如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )
A. 2∶2∶4∶1 B. 1∶1∶2∶1 C. 2∶1∶1∶1 D. 2∶1∶2∶1
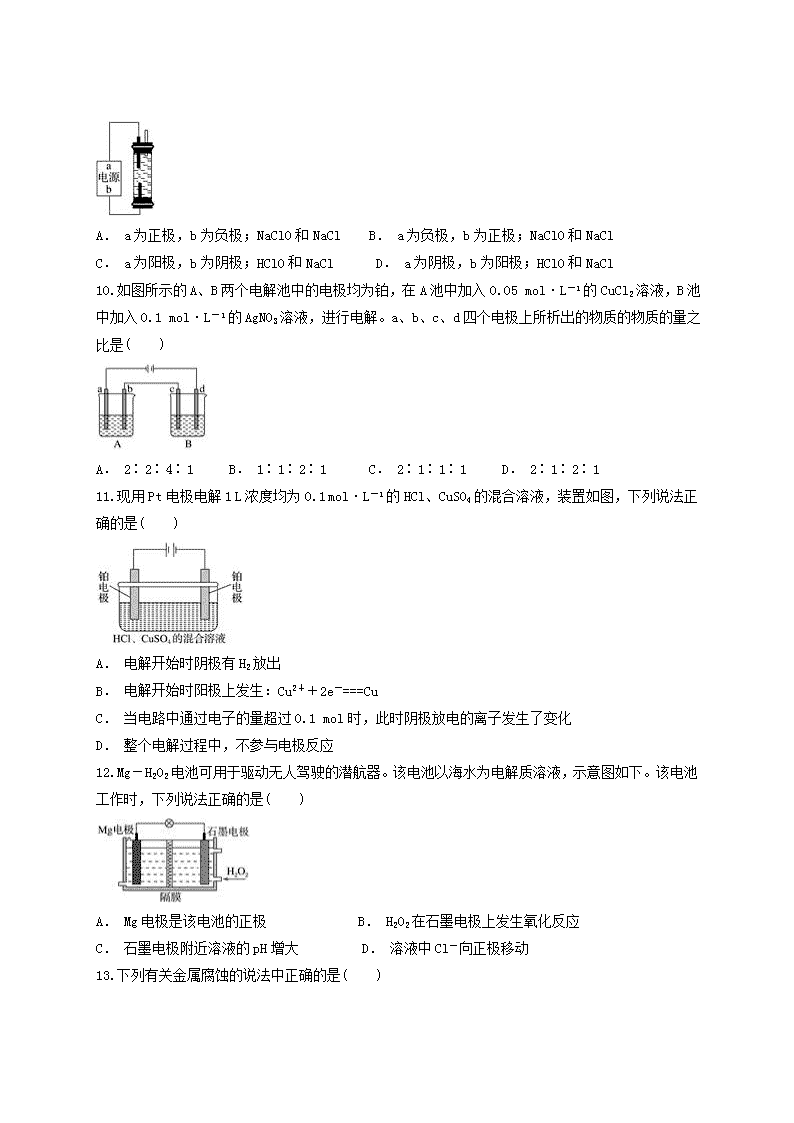
11.现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )
A. 电解开始时阴极有H2放出
B. 电解开始时阳极上发生:Cu2++2e-===Cu
C. 当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
D. 整个电解过程中,不参与电极反应
12.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
A. Mg电极是该电池的正极 B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大 D. 溶液中Cl-向正极移动
13.下列有关金属腐蚀的说法中正确的是( )
A. 金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程
B. 电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C. 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D. 金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
14.X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)===Z(OH)2+H2↑;
④水溶液中,X+Y2+===X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
A. Z>X>Y>M>N B. Z>Y>X>M>N
C. Z>X>Y>N>M D. X>Y>M>N>Z
15.关于下图装置的叙述,正确的是( )
A. 铜是负极,铜片上有气泡产生 B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片 D. 氢离子在铜片表面被还原后生成H2
二、填空题
16.电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如图是电解产生多硫化物的实验装置:
(1)已知阳极的反应为(x+1)S2-===Sx+S2-+2xe-,则阴极的电极反应式是__________________________当反应转移xmol电子时,产生的气体体积为___________(标准状况下)。
(2)将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示)_______________________________________________________________。
17.(1)
将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。锌片上发生的电极反应是___________________;银片上发生的电极反应是___________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,产生氢气的体积在标准状况下是________。
18.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。
从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1) 请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了____________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是____________。
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
19.如图,X和Y均为石墨电极:
(1)若电解质溶液为滴有酚酞的饱和食盐水,电解反应的离子方程式为______________________;电解过程中________(填“阴”或“阳”)极附近会出现红色。
(2)若电解质溶液为500 mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。电解后溶液的pH为________;要使电解后溶液恢复到电解前的状态,需加入一定量的________________(填加入物质的化学式)。(假设电解前后溶液的体积不变)
20.有一纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O+H2O===2Ag+Zn(OH)2。
(1)Zn发生________反应,是________极,电极反应式是________________________________。
(2)Ag2O发生________反应,是________极,电极反应式是____________________________。
三、实验题
21.有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1硫酸溶液中,乙同学将电极放入6 mol·L-1的氢氧化钠溶液中,如下图所示。
(1)写出甲池中正极的电极反应式_______________________________________。
(2)写出乙池中负极的电极反应式________________________________________。
(3)写出乙池中总反应的离子方程式_______________________________________。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确( )
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案________________(如可靠,此空可不填)。
22.某研究性学习小组对原电池的构成及形成条件做如下探究性实验,请你对可能的现象作出推测,并作出合理的解释。
答案解析
1.【答案】C
【解析】解答本题需了解电解池阴、阳极的判断及电解的特点。电解池的阴、阳极是根据直流电源的正、负极确定的,与电源负极相连的电极为电解池的阴极,该电极上发生还原反应;与电源正极相连的电极为电解池的阳极,该电极上发生氧化反应。C正确。
2.【答案】B
【解析】由总反应方程式i+nO2===nO2可知,Li元素在反应后化合价升高(0→+1),Mn元素在反应后化合价降低(+4→+3)。Li被氧化,在电池中作负极,电极反应为Li-e-===Li+,MnO2在正极上反应,电极反应为MnO2+e-===MnO。
3.【答案】D
【解析】A中滴加CuSO4溶液:Zn+CuSO4===Cu+ZnSO4,置换出的Cu附着在Zn表面构成原电池,可以加快产生H2的速率,A的斜率要大于B的斜率,B错误;A中部分Zn与CuSO4反应,则与稀硫酸反应的Zn比B中小,产生的H2体积比B中小,A和C错误。
4.【答案】C
【解析】电解过程溶液必须产生Fe2+,铁必须作阳极,即Fe-2e-===Fe2+,而阴极需要产生OH-,最好为H+放电,2H2O+2e-===H2↑+2OH-,D正确;氯化钠溶液作电解质溶液时,不影响阴极H+放电生成氢气,B正确;装置中铁一定作阳极,阴极可以是铁,也可以是其他惰性电极,C错误;a为正极,b为负极时,Fe2+在A区生成,H2在B区生成,气体上升,既可以排除溶液中的氧气,也可起到搅拌作用,制取效果较好,A正确。
5.【答案】C
【解析】根据电流方向可知,a是正极,b是负极,则电解池中c是阳极,d是阴极,A、B错误;阴极反应(d电极):Cu2++2e-===Cu,C正确;阳极反应(c电极):2Cl--2e-===Cl2↑,D错误。
6.【答案】B
【解析】A项,锌锰电池,Zn是负极,MnO2为正极,所以正极放电的物质是MnO2;B项,氢燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,通入氧气的一极为原电池的正极;C项,铅蓄电池负极为Pb,正极为PbO2放电;D项,镍镉电池负极为Cd,正极为NiO(OH)放电。
7.【答案】D
【解析】饱和NaCl溶液浸湿的pH试纸,接通直流电源,形成电解池。a极内圆为白色说明a电极反应产生了漂白性的氯气,2Cl--2e-===Cl2↑,a极为阳极,与电源正极相连;则b电极是阴极,A、B正确;b阴极电极反应为2H++2e-===H2↑,水是氧化剂,C正确;b极附近碱性增强,pH增大,D错误。
8.【答案】B
【解析】电解时用铁作阳极,失去电子生成Fe2+,Fe2+将废水中的Cr2O还原为Cr3+,A项正确;阴极反应式为2H++2e-===H2↑,溶液的pH变大,B项错误;电解过程中H+在阴极放电,Fe2+还原Cr2O时也消耗H+,使溶液的pH升高, Fe3+转化为Fe(OH)3沉淀,C项正确;根据电极反应式Fe-2e-===Fe2+,可知每转移12 mol e-生成6 mol Fe2+,6 mol Fe2+可还原1 mol Cr2O,D项正确。
9.【答案】B
【解析】有关反应有2NaCl+2H2O2NaOH+H2↑+Cl2↑,Cl2+2NaOH===NaCl+NaClO+H2O,阳极生成Cl2,阴极生成NaOH,为使二者充分作用,根据气体特点,Cl2应在下端产生,从而推知电源b为正极,a为负极,消毒液的主要成分是NaCl、NaClO。B正确。
10.【答案】A
【解析】由电解规律可知:a、c为阴极,b、d为阳极。a极上析出Cu,b极上析出Cl2,c极上析出Ag,d极上析出O2。由电子守恒可得出:2e-~Cu~Cl2~2Ag~O2,可知a、b、c、d四个电极上所析出物质的物质的量之比为1∶1∶2∶=2∶2∶4∶1,A正确。
11.【答案】D
【解析】依据放电顺序阴极先放电的是Cu2+,阴极反应:Cu2++2e-===Cu,阳极先放电的是Cl-,阳极反应:2Cl--2e-===Cl2↑,A、B错误;根据电子守恒Cu2+~2e-~Cl2,n(Cu2+)=0.1 mol,当电路中通过电子的量达到0.2 mol时,此时Cu2+恰好完全反应,阴极放电离子变为H+,C错误;阳极先是Cl-放电,当Cl-消耗完毕,此时H2O电离产生的OH-开始在阳极放电,不参与电极反应,D正确。
12.【答案】C
【解析】该电池中Mg电极为负极,A项错误;石墨电极为正极,H2O2得电子发生还原反应,电极反应式为H2O2+2e-===2OH-,电极附近溶液pH增大,B项错误,C项正确;溶液中Cl-移向Mg电极,即Cl-向负极移动,D项错误。
13.【答案】D
【解析】金属腐蚀的本质,主要是金属原子失电子被氧化,腐蚀的内因是金属的化学性质比较活泼,外因是金属与空气、水和其他腐蚀性的物质接触,腐蚀主要包括化学腐蚀和电化学腐蚀,所以A错误;电化学腐蚀指不纯金属与电解质溶液接触时发生原电池反应而损耗的过程,不需要外加电流,所以B错误;钢铁腐蚀最普遍的是吸氧腐蚀,正极吸收氧气,而不是负极吸收氧气,所以C错误。
14.【答案】A
【解析】①M上冒气泡,发生反应:2H++2e-===H2↑,M为原电池正极,活动性Y>M;②在原电池反应中,负极失电子,电子流出,正极得电子,电子流入,活动性M>N;③Z+2H2O(冷水)===Z(OH)2
+H2↑,证明Z的活动性是题目提供的所有的元素中最强的;④水溶液中,X+Y2+===X2++Y,则证明活动性X>Y;所以这五种金属的活动性由强到弱的顺序为Z>X>Y>M>N 。
15.【答案】D
【解析】锌的活泼性比铜强,Zn为原电池负极,失去电子被氧化,A错误。Cu为原电池的正极,电流流向与电子流向相反,电子经导线流向正极(Cu极),溶液中的氢离子在正极得到电子而被还原为H2,B、C错误,D正确。
16.【答案】(1)2H++2e-===H2↑ 11.2xL
(2)2S2-+O2+2H2O===2S↓+4OH-
【解析】在碱性电解质溶液中,只能是水电离的H+在阴极发生得电子,发生还原反应,生成H2。有xmol电子转移,产生H20.5xmol。S2-具有较强还原性,易被空气中的氧气氧化,配制溶液时需要氮气作保护气。
17.【答案】(1)Zn-2e-===Zn2+ 2H++2e-===H2↑ (2)4.48 L
【解析】(1)该电池中Zn为负极,Zn-2e-===Zn2+,正极上得电子,电极反应式2H++2e-===H2↑。
(2)在电池反应过程中只有Zn溶解而Ag电极上没有金属析出,故电极质量的减小就是反应掉的Zn的质量,n(Zn)=0.2 mol,则n(H2)=n(Zn)=0.2 mol,V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。
18.【答案】(1)
(2)吸氧 还原
2H2O+O2+4e-===4OH-
(3)反应放热,温度升高
(4)实验步骤和结论(不要求写具体操作过程):
①药品用量和操作同编号①试验(多孔橡皮塞增加进、出导管);
②通入氩气排净瓶内空气;
③滴入醋酸溶液,同时测量瓶内压强变化(也可测温度变化、检验Fe2+等)。
如果瓶内压强增大,假设一成立。否则假设一不成立。(答案合理均可)
【解析】(1)要求根据控制变量讨论外界条件对反应速率的影响。
(2)通过坐标图给出的容器内开始时与t2时的压强比较(t0>t2),说明钢铁最终发生了吸氧腐蚀。
(3)通过坐标图0~t1时压强变大的原因提出假设——恒温恒容气体物质的量增大;气体物质的量相等且恒容时,温度升高。
(4)设计实验验证产生H2的实验方案——保证实验条件与坐标图0~t1时压强变大的实验即实验①的条件相同;排净容器内空气,防止发生吸氧腐蚀;通过明显的宏观现象(测容器内压强、温度;或检验实验后溶液中Fe2+)来进行判断。
19.【答案】(1)2Cl-+2H2O2OH-+Cl2↑+H2↑ 阴 (2)1 CuO(或CuCO3)
【解析】(1) NaCl溶液中离子有Na+、H+及Cl-、OH-四种离子,得电子能力H+>Na+,失电子能力Cl->OH-,阴极反应为H2+2e-===H2↑,阳极反应为2Cl--2e-===Cl2↑。阴极遇酚酞后变红。
(2)由实验现象可知电解质为可溶性含氧酸铜盐,X为阴极,Y为阳极,无色气体为O2,离子方程式为2Cu2++2H2O2Cu+4H++O2↑,溶液中n(H+)=2×=0.05 mol,c(H+)=0.1 mol·L-1,pH=1;电解质溶液中析出铜和氧气,要恢复至电解前的溶液组成,可加入一定量的CuO或CuCO3。
20.【答案】(1)氧化 负 Zn+2OH--2e-===Zn(OH)2
(2)还原 正 Ag2O+2e-+H2O===2Ag+2OH-
【解析】由总反应可知,锌化合价升高,发生氧化反应,失去电子,作负极,在碱性环境中Zn+2OH--2e-===Zn(OH)2;氧化银发生还原反应,得到电子,作正极,在碱性环境中Ag2O+2e-+H2O===2Ag+2OH-。
21.【答案】(1)2H++2e-===H2↑
(2)2Al+8OH--6e-===2AlO+4H2O
(3)2Al+2OH-+2H2O===2AlO+3H2↑
(4)Mg Al
(5)AD
(6)不可靠;将两种金属作电极连上电流计后插入电解质溶液,构成原电池,利用电流计测定电流的方向,从而判断电子流动方向,再确定原电池正负极
【解析】甲同学依据的化学反应原理是Mg+H2SO4===MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O===2NaAlO2+3H2↑。由于铝与碱的反应是一个特例,不可作为判断金属性强弱的依据。判断原电池的正极、负极要依据实验事实。
22.【答案】
【解析】原电池的形成条件:
①有活动性不同的两个电极,②两电极插入电解质溶液中,③两极用导线相连形成闭合回路,
④相对活泼的金属与电解质溶液发生自发的氧化还原反应。表中的①和②两组不能形成闭合电路;⑥组两个电极相同;⑦组两个电极都不能与电解质溶液发生自发的氧化还原反应;③④⑤⑧⑨符合形成原电池的条件。