- 749.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
宁夏回族自治区银川一中2020届高三第四次模拟考试理科综合
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cu-64 Ag-108
一、选择题:本题共7小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列说法正确的是( )
A.2022年冬奥会聚氨酯速滑服是新型无机非金属材料
B.75%酒精可用于消毒杀死新冠病毒,如果用90%酒精效果更好
C.纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的
D.核酸检测是确认病毒类型的有效手段, 核酸是高分子化合物
8.NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1 mol甲基(—CH3)所含的电子数为10NA
B.64g Cu和足量的硫粉加热,充分反应转移的电子数是2NA
C.在0℃、101 kPa条件下,11.2L丁烷中含极性共价键数目为5NA
D.1L 0.1 mol· L-1NH4H2PO4溶液中阴阳离子数相等
9.X、Y、Z、M、Q、R为短周期元素, 其原子半径和最外层电子数之间的关系如图所示。下列说法错误的是( )
A.R不能把Q从其盐溶液中置换出来
B.X、R、Q三种元素可以构成离子化合物
C.热稳定性:ZX3<YX4
D.X2M的水溶液露置于空气中易变质
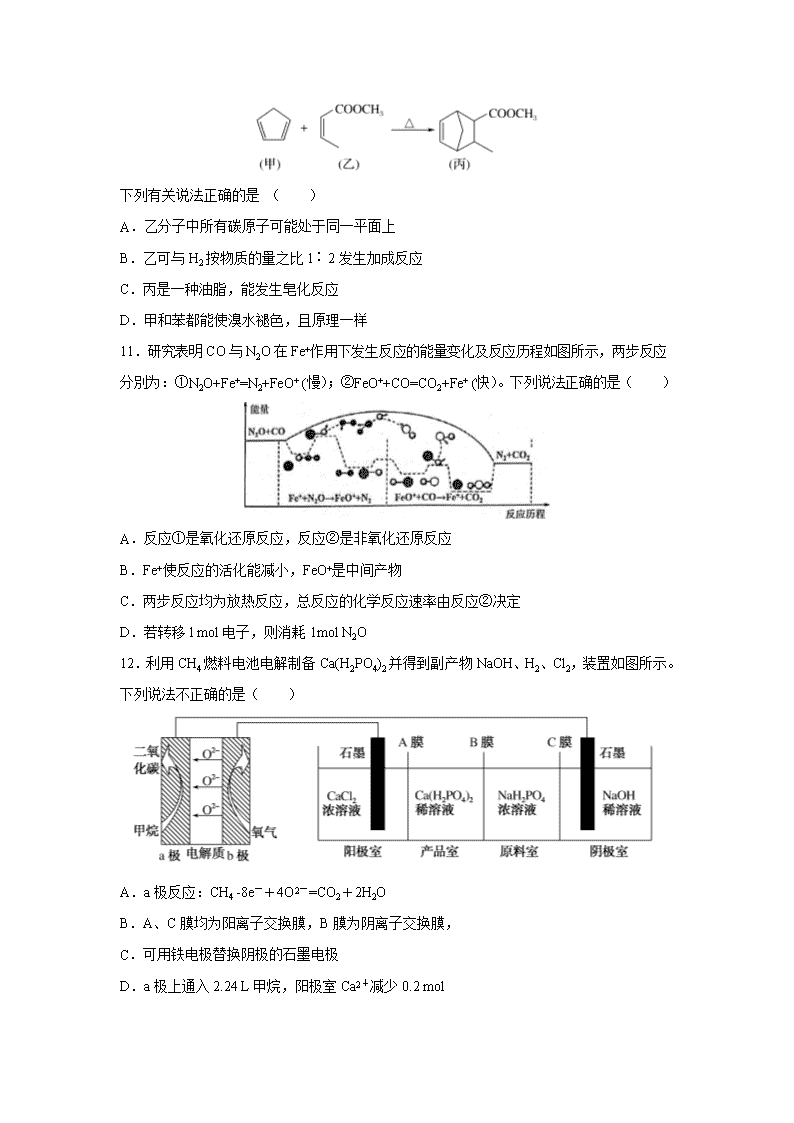
10.化合物丙属于一种桥环化合物,是某些医药的中间体,可以通过以下反应制得:
下列有关说法正确的是 ( )
A.乙分子中所有碳原子可能处于同一平面上
B.乙可与H2按物质的量之比1∶2发生加成反应
C.丙是一种油脂,能发生皂化反应
D.甲和苯都能使溴水褪色,且原理一样
11.研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+ (慢);②FeO++CO=CO2+Fe+ (快)。下列说法正确的是( )
A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移l mol电子,则消耗1mol N2O
12.利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是( )
A.a极反应:CH4 -8e-+4O2-=CO2+2H2O
B.A、C膜均为阳离子交换膜,B膜为阴离子交换膜,
C.可用铁电极替换阴极的石墨电极
D.a极上通入2.24 L甲烷,阳极室Ca2+减少0.2 mol
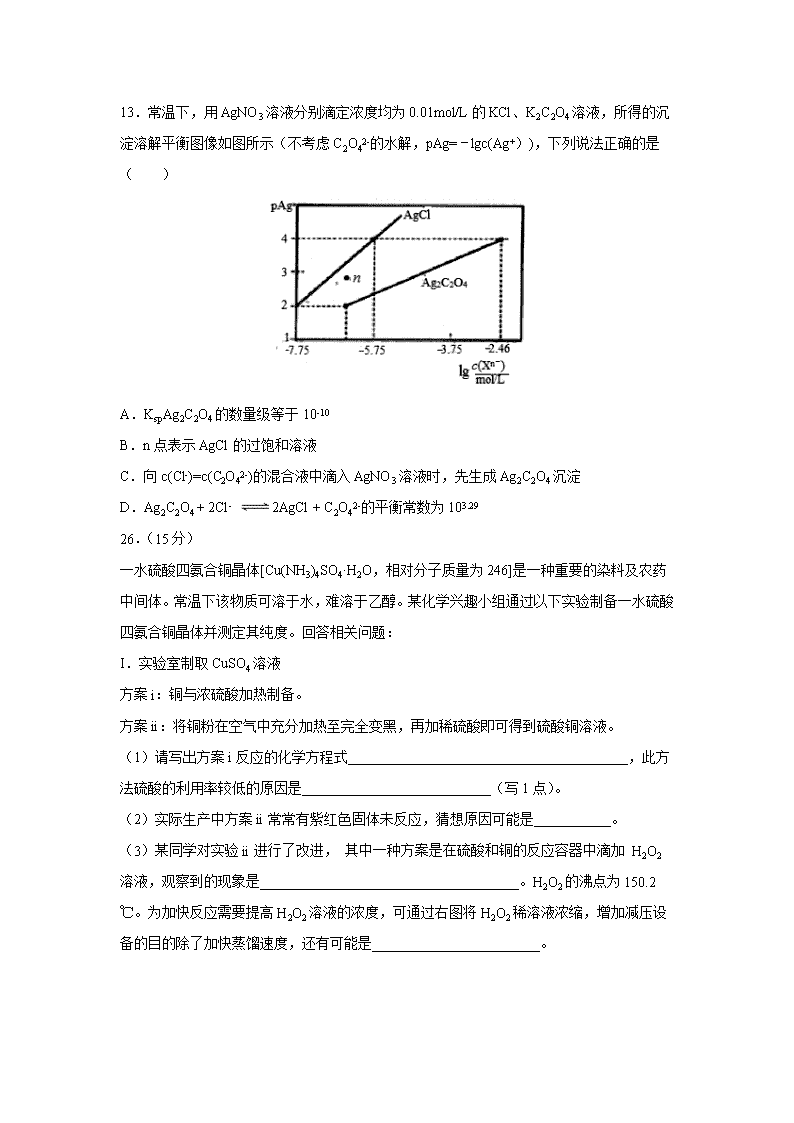
13.常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解,pAg=lgc(Ag+)),下列说法正确的是( )
A.KspAg2C2O4的数量级等于10-10
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4 + 2Cl- 2AgCl + C2O42-的平衡常数为103.29
26.(15分)
一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式________________________________________,此方法硫酸的利用率较低的原因是___________________________(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是___________。
(3)某同学对实验ii进行了改进, 其中一种方案是在硫酸和铜的反应容器中滴加 H2O2 溶液,观察到的现象是_____________________________________。H2O2的沸点为150.2 ℃。为加快反应需要提高H2O2溶液的浓度,可通过右图将H2O2稀溶液浓缩,增加减压设备的目的除了加快蒸馏速度,还有可能是________________________。
II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式____________________________________________________________________。
(5)继续滴加 NH3·H2O, 会转化成深蓝色溶液。向深蓝色溶液中加入乙醇可析出深蓝色晶体,滴加乙醇的作用可能是( )
A.乙醇可以作还原剂 B.乙醇可以降低该晶体在该溶液中的溶解度
C.乙醇可以作萃取剂
Ⅲ.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL 0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1
NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL NaOH溶液。产品纯度的表达式为____________。
27.(14分)
JohnB.Goodenough等三位科学家因为在锂离子电池研究领域的突出贡献获得2019年诺贝尔化学奖。碳酸锂是一种常见的锂离子电池原料,一种以锂辉石为原料制取碳酸锂的工艺如下图:(锂辉石:LiAl(SiO3)2,也表示为Li2O·Al2O3·4SiO2,还含微量的钠、钙、镁等元素)
[查阅资料]:Li2CO3为无色单斜晶系结晶体,熔点618℃,溶于硫酸,微溶于水,在冷水中的溶解度比热水中大。
(1)在“硫酸浸出”流程,将硫酸加热到130℃的目的是___________________________。
(2)工业上高温煅烧FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O)的混合物制取电池材料磷酸亚铁锂(LiFePO4),反应的化学方程式为__________________________________。
(3)LiFePO4含有Fe、Li两种金属元素,它们的焰色反应的颜色分别是( )
A.黄色、紫红色 B.绿色、黄色 C.无焰色反应、紫红色 D.黄色、无焰色反应
(4)在“Li2CO3分离、洗涤”流程,用热水洗涤的原因是___________________________。
(5)某浓差电池的原理示意如下图所示,可用该电池从浓缩海水中提取LiCl溶液。
电池中的Y电极为________(填“正极”或“负极”或“阳极”或“阴极”)。
X极的电极反应方程式为:________________________________________________。
Y极每生成标况下22.4L Cl2,有_________mol Li+经过离子导体。
28.(14分)
CO、CO2是化石燃料燃烧后的主要产物。
(1) 汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)已知:反应CO2(g)CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
①分析图1,求2min内v(CO2)=_______,5min时达到平衡,平衡时c(CO)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(3)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项
T/K
时间/min
催化剂种类
甲醇的含量(%)
A
450
10
CuO-ZnO
78
B
450
10
CuO-ZnO-ZrO2
88
C
450
10
ZnO-ZrO2
46
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A.使用催化剂CuO-ZnO-ZrO2 B.适当降低反应温度
C.增大CO和H2的初始投料比 D.恒容下,再充入a mol CO和3a mol H2
35.[化学——选修3:物质结构与性质](15分)
我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________,基态时该阳离子的价电子排布式为___________。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____元素。
(3)已知Cu、Zn的第二电离能分别为1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后者的原因是________________________________________。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O22CH3CHO+2H2O。
乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
①该铜银合金的化学式是___________________。
②已知:该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=×100%)
36.[化学—选修5:有机化学基础](15分)
麻黄素M是拟交感神经药。合成M的一种路线如图所示:
已知:I.R—CH2OHRCHO
II.R1-CHO+R-C≡CNa
IV.
V.
请回答下列问题:
(1)D名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为________________。
(6)已知:仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体的路线________________。
【参考答案】
7
8
9
10
11
12
13
D
C
C
A
B
D
B
26.(15分)
(1)Cu+2H2SO4(浓)CuSO4+ SO2↑+2H2O(2分);
随着反应的进行,浓硫酸被稀释为稀硫酸,稀硫酸不与Cu反应或者浓硫酸反应生成SO2,使得硫酸利用率降低(2分)。
(2)表面生成的CuO阻止内部铜与O2接触或反应(2分)。
(3)铜溶解、溶液变蓝(2分);
降低水的沸点,避免H2O2分解(2分)。
(4)2Cu2++2NH3·H2O+SO42-=Cu2(OH)2SO4↓+2NH4+ (2分)
(5)B(1分)
(6)=(2分)
27、(每空2分,共14分)
(1)温度升高可加快浸出速率
(2)2FePO4+Li2CO3+H2C2O4.2H2O2LiFePO4+3CO2↑+3H2O↑
(3)C
(4)Li2CO3在冷水中的溶解度比热水中大,热水洗涤可减少Li2CO3的溶解度损耗,提高产率
(5)负极 2H++ 2e- =H2↑ 2
28、(每空2分,共14分)
(1) -746.5
(2) ① 3×10-7 mol/(L·min) 2×10-6 mol/L ②3.2×10-8
(3) ① B cd ②BD
35、(15分)
(1) 2 (1分) 3d9 (1分)
(2) O或氧 (1分)
(3) Cu失去一个电子后的价层电子排布式为3d10,达到全充满稳定结构;Zn失去一个电子后的价层电子排布式为3d104s1,Zn+ 4s1上的电子比Cu+ 3d10上的电子易失去 (2分)
(4).sp2、sp3 (2分) 6:1 (2分)
(5) ①AgCu3或Cu3Ag (2分) ② (2分) ③(2分)
36、 (15分)
(1)苯甲醛(1分) 羟基(1分)
(2)取代反应或水解反应 (2分) (2分)
(3)+CH3NH2+H2O (2分) (4)10(2分)
(5)(2分)
(6) (3分)