- 931.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020年高考适应性训练
化 学 试 题(三)
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整,笔迹清晰。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 Si 28 Cl 35.5 Cu 64
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活及社会发展密切相关。下列说法正确的是
A.植物油长期露置在空气中会因氧化反应而变质
B.碳纤维和制医用口罩的聚丙烯纤维都是有机高分子化合物
C.利用维生素C的氧化性,可防止鲜榨苹果汁变黄
D.过氧化氢、乙醇、过氧乙酸等均可将病毒氧化而达到消毒目的
2.使用化学药品必须注意安全,下列药品对应的安全标识不正确的是
A
B
C
D
硝酸钾、氯酸钾
苛性钠、浓硫酸
四氯化碳、酒精
白磷、苯
3.CH、·CH3、CH都是重要的有机反应中间体,有关它们的说法正确的是
A.·CH3中的碳原子杂化方式为sp2
B.CH空间构型为正四面体
C.CH中的键角大于NH3
D.CH与OH-形成的化合物中含有离子键
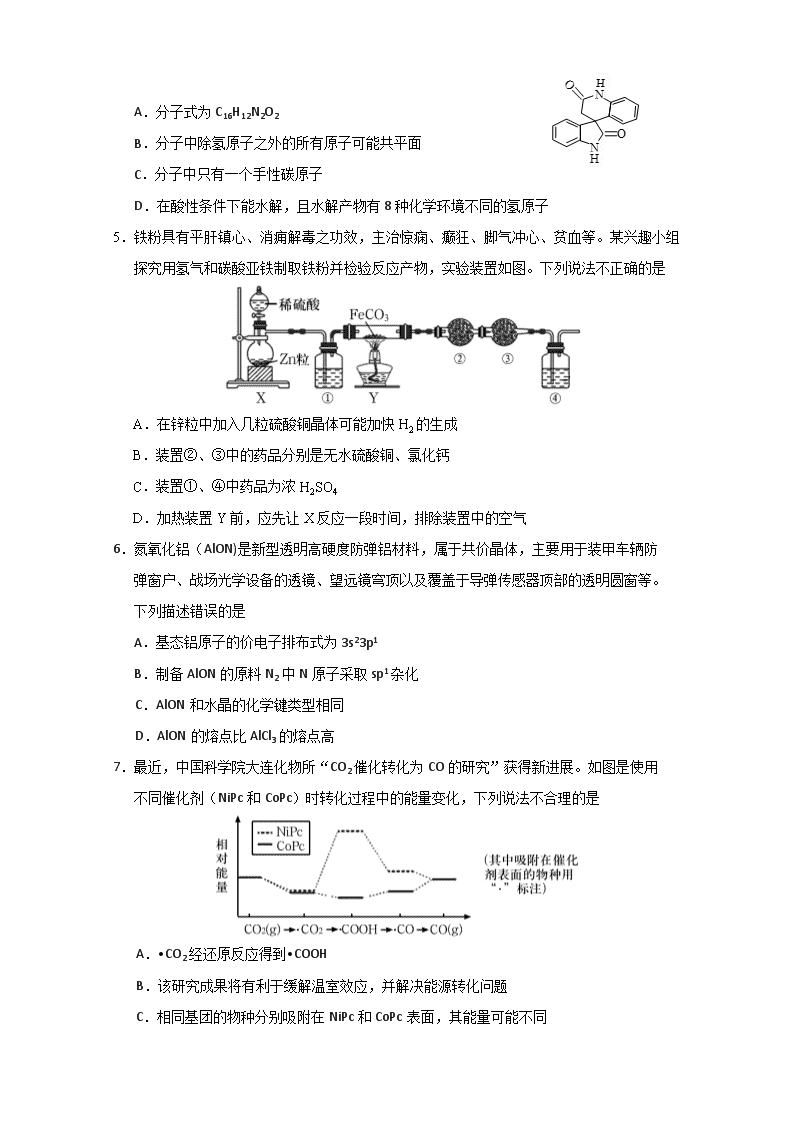
4.南开大学的周其林院士及其团队凭借“高效手性螺环催化剂”的发现,获得了2019年度国家自然科学奖一等奖。一种手性螺环分子的结构简式如右图所示。下列关于该有机物说法错误的是
A.分子式为C16H12N2O2
B.分子中除氢原子之外的所有原子可能共平面
C.分子中只有一个手性碳原子
D.在酸性条件下能水解,且水解产物有8种化学环境不同的氢原子
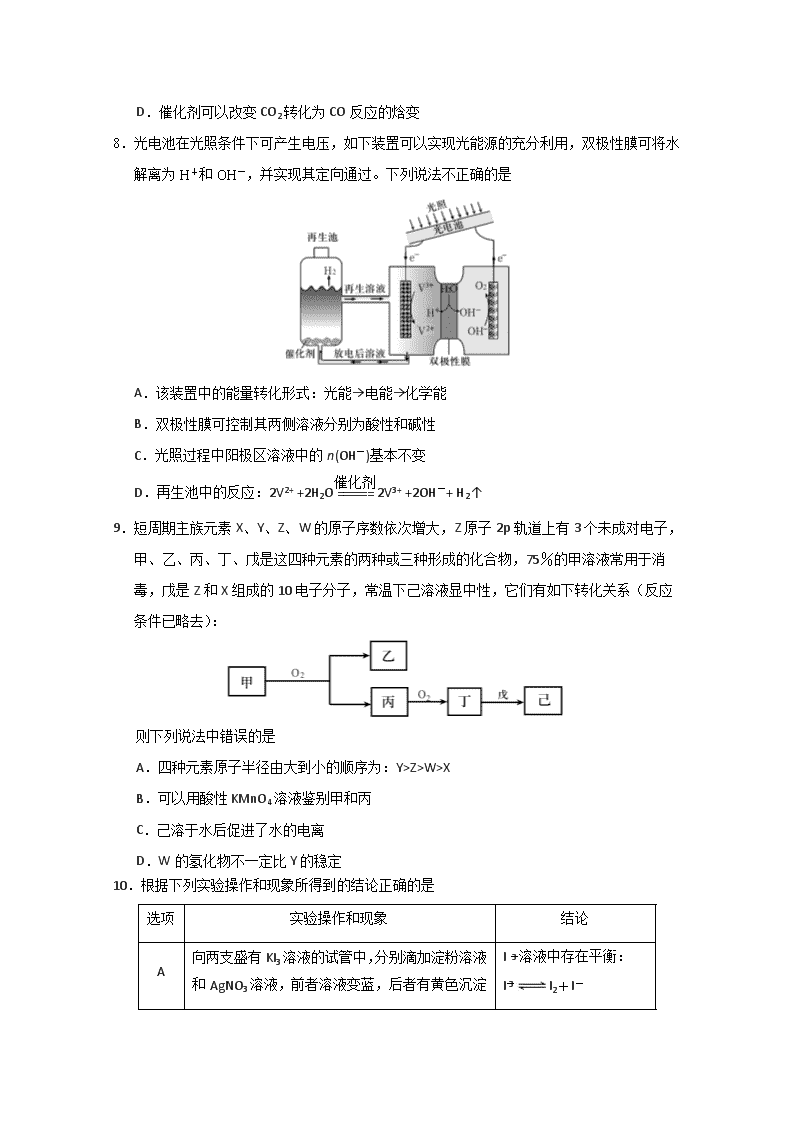
5.铁粉具有平肝镇心、消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
A.在锌粒中加入几粒硫酸铜晶体可能加快H2的生成
B.装置②、③中的药品分别是无水硫酸铜、氯化钙
C.装置①、④中药品为浓H2SO4
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
6.氮氧化铝(AlON)是新型透明高硬度防弹铝材料,属于共价晶体,主要用于装甲车辆防
弹窗户、战场光学设备的透镜、望远镜穹顶以及覆盖于导弹传感器顶部的透明圆窗等。
下列描述错误的是
A.基态铝原子的价电子排布式为3s23p1
B.制备AlON的原料N2中N原子采取sp1杂化
C.AlON和水晶的化学键类型相同
D.AlON的熔点比AlCl3的熔点高
7.最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用
不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是
A.•CO2经还原反应得到•COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
8.光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是
A.该装置中的能量转化形式:光能→电能→化学能
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应:2V2+ +2H2O2V3+ +2OH-+ H2↑
9.短周期主族元素X、Y、Z、W的原子序数依次增大,Z原子2p轨道上有3个未成对电子,甲、乙、丙、丁、戊是这四种元素的两种或三种形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下己溶液显中性,它们有如下转化关系(反应条件已略去):
则下列说法中错误的是
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.可以用酸性KMnO4溶液鉴别甲和丙
C.己溶于水后促进了水的电离
D.W的氢化物不一定比Y的稳定
10.根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀
I溶液中存在平衡:
II2+I-
B
在Ca(ClO)2溶液中通入SO2气体,有沉淀生成
酸性:H2SO3>HClO
C
向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去
氯气具有强氧化性和漂白性
D
在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色
植物油含有酯基
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.氮化镓(GaN)是制造LED的重要材料,被誉为“第三代半导体材料”。镓(31Ga)
的氧化物和氢氧化物均为两性化合物,工业制备氮化镓的工艺流程如图所示。下列判
断正确的是
A.Ga位于第五周期第IIIA族
B.酸性:Al(OH)3>Ga(OH)3
C.Ga(OH)3可与NaOH反应生成NaGaO2
D.Ga与NH3反应的另一种生成物可用作航天燃料
12.由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐Na4S2O3中加入足量稀硫
酸,发生反应:2Na4S2O3+4H2SO4===4Na2SO4+3S↓+SO2↑+4H2O。下列说法正确的是
A.Na4S2O3的水溶液显碱性
B.1 mol Na4S2O 3中共含离子数为5NA
C.上述反应中,每产生3 mol S,转移电子的物质的量为6 mol
D.CaOCl2也可称为混盐,向CaOC12中加入足量较浓度的硫酸会有C12产生
13.工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完
成乙烯氯化,下列叙述错误的是
A.过程Ⅰ中的TBA替代了侯德榜
制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2
的再生
C.理论上每生成1 mol NaHCO3,
可得到1 mol C2H4Cl2
D.过程Ⅲ中的反应是C2H4+2CuCl2C2H4Cl2+2CuCl
14.1,3-丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物M和N(不考虑立
体异构),其反应机理如图1所示;室温下,M可以缓慢转化为N,能量变化如图2
所示。下列关于该过程的叙述错误的是
A.室温下,M的稳定性强于N
B.N存在顺反异构体
C.有机物M的核磁共振氢谱中有四组峰,峰面积之比为2:1:2:2
D.
15.25℃时,向50 mL浓度均为1.0 mol·L-1 的醋酸和醋酸钠混合溶液中,缓慢滴加1.0 mol·L-1 的NaOH溶液,所得溶液的pH变化情况如右图所示(已知25℃,Ka(CH3COOH)=1.8×10-5)。下列叙述错误的是
A.a点溶液中,c(H+)约为1.8×10-5 mol·L-1
B.b点溶液中,c(CH3COO
)>c(Na+)>c(CH3COOH)>c(H+)
C.V[NaOH(aq)]≤50 mL时,随V[NaOH(aq)]增大,溶液中离子总浓度增大
D.从 a点到c点的过程中,溶液中不变
三、非选择题:本题共5小题,共60分。
16.(12分)十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:
(1)已知:CO(g) +H2O(g)CO2(g)+H2(g) ∆H 1=-41 kJ·mol-1
CH3CH2OH(g)+3H2O(g)2CO2(g)+6H2(g) ∆H 2 =+174.1 kJ·mol-1
反应 I的热化学方程式为___________________________。
(2)反应 II在进气比[n(CO) : n(H2O)]不同时,测得相应的 CO 平衡转化率见下图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
①图中A、E和 G三点对应的反应
温度TA、TE、TG的关系是_______,
其原因是 __________。
该温度下,要提高CO平衡转化率,
除了改变进气比之外,还可采 取的
措施是__________。
②由图中可知CO的平衡转化率与进气比、反应温度之间的关系是_______。
③ A、B 两点对应的反应速率大小:vA_____vB(填“<” “=”或“>”)。已知反应速率 v=v正−v逆= k正x(CO)x(H2O) − k逆x(CO2) x(H2) ,k为反应速率常数,x为物质的量分数,在达到平衡状态为D点的反应过程中,当CO的转化率刚好达到20%时,_____。
(3)反应III在饱和KHCO3电解液中,电解活化的CO2来制备乙醇,其原理如图所示,
则阴极的电极反应式为___________。
17.(13分)新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3, =8,25℃有关物质的溶度积常数:
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
8.0×10-16
4.0×l0-38
5.12×10-33
4.0×l0-14
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为__________。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_______,
检验还含有Fe2+的方法是_________。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是___________,若所得
溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为__________(当
溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二
者均可被氧化为Mn3O4,若控温氧化时溶液的pH随
时间的变化如右图,则15~150 min内滤饼中一定参
加反应的成分是 ;判断的理由是
(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_________________。
18.(12分)碱式氯化铜是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
(1)仪器X的名称是________,其主要作用有导气、_____________________。
(2)实验室利用装置A制NH3,发生反应的化学方程式为____________________。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有
________________。
(4)若体系中NH3过量会导致碱式氯化铜的产量_________(填“偏高”、“偏低”或“无
影响”),原因为__________________。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(5)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1。则称取的样品中 n(Cu2+)=________mol。
(6)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:
0.1000 mol·L-1 NH4SCN溶液
ⅰ)20. 00 mL待测液
ⅱ)聚乙烯醇溶液
ⅲ) 30. 00 mL 0.1000 mol·L-1 AgNO3溶液
①滴定时,应选用下列哪种物质作为指示剂________(填标号)。
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品
中n(Cl-)=______mol。
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为____________________。
19.(11分)
氨基酸微量元素螯合物在饲料生产应用、解决过量添加无机盐造成环境污染等方面有重要应用。该类螯合物通常以蛋氨酸、赖氨酸、甘氨酸等为配位体,以铜、铁、锌、锰、铬、钴等元素为中心离子。
(1)甘氨酸中共有______个σ键,所含元素的电负性由大到小的顺序为____________,官能团中C原子的杂化方式为_________。
(2)上述金属元素中,基态原子有五个未成对电子的原子的核外电子排布式为______。
(3)蛋氨酸铜的结构式如图。该螯合物中含有的化学键类型有_________(填序号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。某化合物的化学
式为Na3CrO8,其阴离子结构可表示为,则Cr的化合价为______。
CrO呈四面体构型,结构为,Cr2O由两个CrO四面体组成,这两个
CrO四面体通过共用一个顶角氧原子彼此连接,结构为。则由n(n>1)个CrO通过顶角氧原子连结的链式结构的化学式为______。
(5)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是______;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的结构如下图所示(K+未画出),则一个晶胞中的K+个数为______。
20.(13分)温室气体CO2资源化利用的一种途径如下,生成物H和I可用作锂离子电
池的电解质。
回答下列问题:
(1)由A到B的反应类型为 ;由C到D的反应所需试剂为 。
(2)E中官能团的名称是 ,最多 个原子共线。
(3)F合成G的化学方程式为 。
(4)与G互为同分异构体的羧酸类芳香族化合物中,核磁共振氢谱为四组峰,峰面积之比为6:2:1:1的结构简式为 。
(5)设计由丙炔和甲醛为起始原料制备的合成路线(无机试剂任选)。
2020年高考适应性训练
化学(三)参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. A 2. C 3. C 4. B 5. C 6. B 7. D 8. D 9. B 10. A
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11. CD 12. AD 13. C 14. AC 15.C
三、非选择题:本题共5小题,共60分。
二卷评分细则:
1.卷面清晰,答案有错别字,字迹模糊无法辨认不得分。
2.方程式不配平、化学式、结构简式有错误不得分,反应条件不作要求,气体沉淀符号不作要求。
3.选择性题目严格按照题目要求填写,不符合要求不得分。
16.(12分)
(1)CH3CH2OH(g)+H2O(g)4H2(g)+2CO(g) ∆H= +256.1 kJ·mol-1 (2分)
(2)①TA=TE=TG(1分) KA=KE=KG=1(1分) 及时移去产物(1分)
②温度相同,进气比越大,CO的平衡转化率越小;进气比相同,反应温度越高,CO的平衡转化率越小 (2分)
③ <(1分) 36.0 (2分)
(3)14CO2+12e-+9H2O=CH3CH2OH+12HCO (2分)
17.(13分)
(1)+3、+4 (1分)
(2)MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O(2分)
取浸取液少许,加入几滴K3[Fe(CN)6]溶液(或酸性KMnO4溶液),若有蓝色沉淀生成(或紫红色褪去),则有Fe2+(2分)
(3)溶液中的铁离子催化过氧化氢分解(1分) 4.9-7.3 (2分)
(4)Mn2(OH)2SO4 (1分) 3 Mn2(OH)2SO4+O2===2Mn3O4+3H2SO4 (2分)
(5)8Mn3O4 +6Li2CO3 +5O26CO2 + 12LiMn2O4 (2分)
18.(12分,除标注外,其余每空1分)
(1)球形干燥管 防倒吸
(2) 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
(3)溶液中有大量墨绿色固体产生,三颈烧瓶中有白烟 (2分)
(4)偏低 碱式氯化铜能溶于氨水
(5)0.04
(6)① b ②0.02
(7)Cu2(OH)3Cl
19.(10分,除标注外,其余每空1分)
(1)9 O>N>C>H sp2 (2)[Ar]3d54s2 (3)abcd (2分)
(4)+5 CrnO3n+12- (5)K2[Fe(SCN)5] 4
20.(13分)
(1)加成反应(1分)(或、Fe)(1分)
(2)碳碳三键、羟基(2分) 6(1分)
(3)(2分)
(4)(2分)
(5)(4分)