- 560.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
广东省清远市方圆培训学校2020届
化学模拟试题精练(八)
(考试用时:50分钟 试卷满分:100分)
7.现代生活需要提升我们的科学素养,以下说法科学的是( )
A.某护肤品广告宣称产品不含任何化学成分
B.日用铝制品表面不需要刷漆防腐蚀
C.汽车尾气中的氮氧化物是由汽油不完全燃烧引起的
D.为了防腐保鲜,可在蔬菜表面洒少量福尔马林
解析:选B 所有物质都含有化学成分,不含化学成分的物质不存在,故A错误;铝与空气中的氧气反应生成致密的氧化膜,阻止铝与氧气继续反应,所以日用铝制品表面不用刷漆防腐蚀,故B正确;汽油的主要成分是C和H元素构成的烃类物质,汽油中不含N元素,所以汽车尾气中氮氧化物的产生与汽油是否完全燃烧无关,故C错误;福尔马林是甲醛的水溶液,甲醛有毒,不能用于食品的防腐保鲜,故D错误。
8.设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH的数目为0.1NA
B.质量均为1.7 g的OH-和—OH,所含质子数目均为0.9NA
C.1.0 mol Na2O2和1.0 mol Na2S混合后阴离子总数为2NA
D.60 g SiO2晶体中,含有SiO4四面体结构单元的数目为NA
解析:选A。A.由于NH4Cl溶液中存在NH的水解,所以1 L 0.1 mol·L-1 NH4Cl溶液中NH的数目小于0.1NA,故A错误;B.电子质量忽略不计,质量均为1.7 g的OH-和—OH,所含质子数目均为0.9NA,故B正确;C.1.0 mol Na2O2 中含有1.0 mol过氧根离子,1.0 mol Na2O2和1.0 mol Na2S 混合后阴离子总数为2NA,故C正确;D.n(SiO2)=60 g/60 g·mol-1=1 mol,每个Si原子和四个O原子形成四面体结构,所以60 g SiO2晶体中Si原子个数为NA,所含SiO4四面体数为NA,故D正确;故选A。
9.化学与材料、生活和环境密切相关。下列有关说法中错误的是( )
A.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
C.日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应
D.神舟十号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅
解析:选C。A.煤的干馏可得到煤焦油、焦炉气、粗苯等,而煤焦油经蒸馏又可得到苯、二甲苯等重要的化工原料;煤经气化、液化可得到甲醇等清洁能源,A正确;B.利用CO2合成聚碳酸酯类可降解塑料,这样将CO2转化为可降解塑料,实现了“碳”的循环利用,B正确;C.日常生活中人们大量使用铝制品,是因为常温下铝能与氧气反应生成致密的氧化铝保护膜,阻止了铝的进一步被氧化,C项错误;D.太阳能电池的材料是硅,D正确。
10.满足下列条件的同分异构体(不考虑立体异构)的数目判断正确的是( )
选项
A
B
C
D
分子式
C4H10O
C3H7Cl
C8H10
C4H8O2
已知条件
与钠生成H2
卤代烷烃
芳香烃
能水解
同分异构体数目
4
3
3
3
解析:选A。A.根据分子式,能和金属钠反应生成H2,该物质为醇类,丁基有四种结构,所以该醇有4种同分异构体,故A正确;B.C3H7Cl是一个氯原子取代丙烷一个氢原子,丙基存在2种结构,所以一氯丙烷有2种同分异构体,故B错误;C.分子式为C8H10的芳香烃,分子中含有1个苯环,故侧链为烷基,若有1个侧链,为—CH2—CH3,一种结构;若有2个侧链,为—CH3,有邻、间、对三种结构,总共4种同分异构体,故C错误;D.分子式为C4H8O2的有机物可水解,属于饱和一元酯,若为甲酸和丙醇酯化,形成的酯有2种;若为乙酸和乙醇酯化,只能形成一种酯;若为丙酸和甲醇酯化,形成的酯有1种;可形成的酯共有4种,故D错误。
11.A、B、C、D、E是原子序数依次增大的五种短周期元素,且B、C相邻,A在周期表中原子半径最小,C最外层电子数是次外层的三倍,D的简单阳离子和它的含氧酸根离子反应可生成白色沉淀,E单质常温下是黄绿色气体。下列说法中正确的是( )
A.元素的简单离子半径:D>C>B
B.A与B两种元素共同形成的10电子粒子有2种
C.B的最高价氧化物对应水化物的酸性比E的最高价氧化物对应水化物的酸性弱
D.由A、B、C三种元素构成的物质一定是共价化合物
解析:选C。由题意可推知A、B、C、D、E分别为H、N、O、Al、Cl。A.电子层结构相同的离子,原子序数大,半径小,故离子半径:N3->O2->Al3+,即B>C>D,故A错误;B.A与B两种元素共同形成的10电子粒子有NH3、NH 、NH,故B错误;C.B为N,E为Cl,非金属性越强,最高价氧化物对应水化物的酸性越强,氯的非金属性比氮强,故C正确;D.A、B、C组成的化合物可能是硝酸也可能是硝酸铵,所以可能是共价化合物也可能是离子化合物,故D错误。
12.某电池的简易装置图如图所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )
A.a电极反应式为C2H5OH+12OH--12e-===2CO2↑+9H2O
B.AlCl3溶液中的总反应为2Cl-+2H2O===Cl2↑+H2↑+2OH-
C.反应开始后,观察到x电极附近出现白色沉淀
D.左侧电解池每通入32 g O2,右侧电解池共生成2 mol气体
解析:选C。A.a是燃料电池负极,a电极反应式为C2H5OH+16OH--12e-===2CO+11H2O,故A错误;B.电解AlCl3溶液中的总反应为2Al3++6Cl-+6H2O通电,3Cl2↑+3H2↑+2Al(OH)3↓,故B错误;C.反应开始后,x电极的反应为2Al3++6H2O+6e-===3H2↑+2Al(OH)3↓,所以观察到x电极附近出现白色沉淀,故C正确;D.左侧电解池每通入32 g O2,转移4 mol电子,右侧电解池生成2 mol氢气、2 mol氯气,共生成4 mol气体,故D错误。
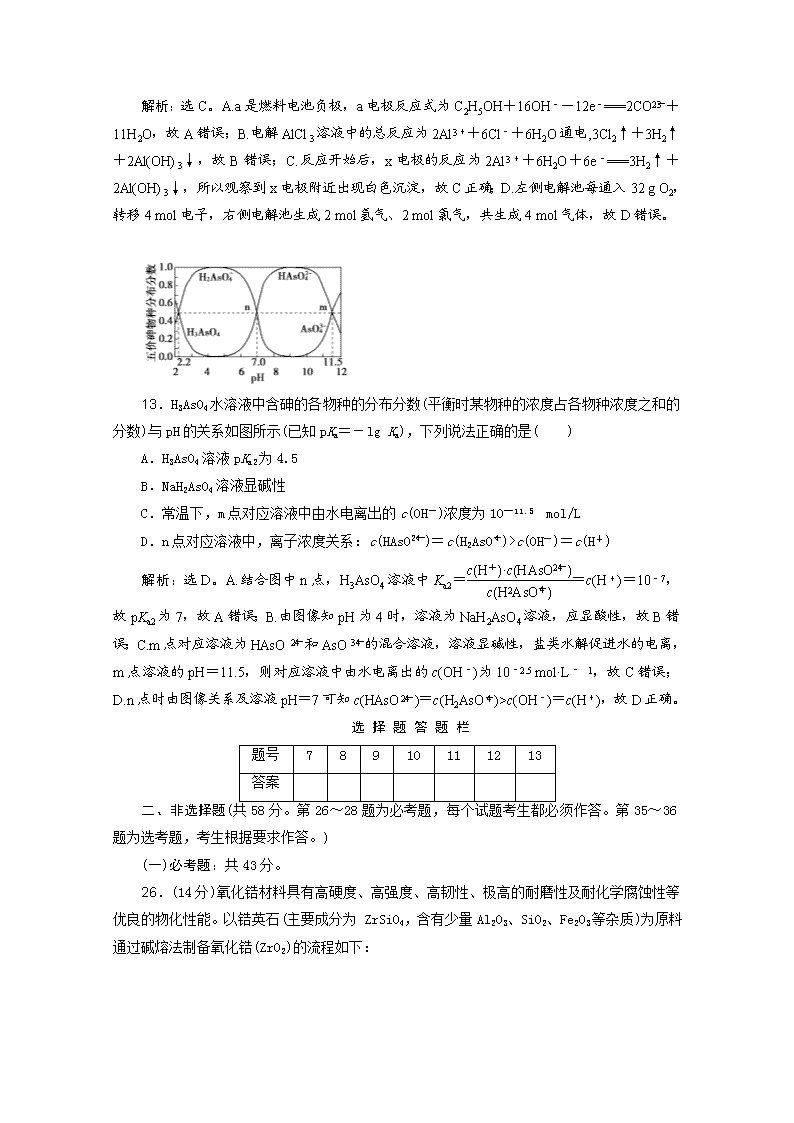
13.H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示(已知pKa=-lg Ka),下列说法正确的是( )
A.H3AsO4溶液pKa2为4.5
B.NaH2AsO4溶液显碱性
C.常温下,m点对应溶液中由水电离出的c(OH-)浓度为10—11.5 mol/L
D.n点对应溶液中,离子浓度关系:c(HAsO)=c(H2AsO)>c(OH-)=c(H+)
解析:选D。A.结合图中n点,H3AsO4溶液中Ka2==c(H+)=10-7,故pKa2为7,故A错误;B.由图像知pH为4时,溶液为NaH2AsO4溶液,应显酸性,故B错误;C.m点对应溶液为HAsO和AsO的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5 mol·L- 1,故C错误;D.n点时由图像关系及溶液pH=7可知c(HAsO)=c(H2AsO)>c(OH-)=c(H+),故D正确。
选 择 题 答 题 栏
题号
7
8
9
10
11
12
13
答案
二、非选择题(共58分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。)
(一)必考题:共43分。
26.(14分)氧化锆材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25 ℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3
Zr(OH)4
Al(OH)3
开始沉淀时pH
1.9
2.2
3.4
沉淀完全时pH
3.2
3.2
4.7
请回答下列问题:
(1)流程中为提高化学反应速率的措施有___________。
(2)操作Ⅰ的名称是___________,滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式为___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是________________________。
(5)写出“高温煅烧”过程的化学方程式______________________________。
根据ZrO2的性质,推测其两种用途______________________________________________。
解析:(1)锆英石状态为固态,为提高反应速率,可以通过将矿石粉碎,以增大接触面积;或者通过加热升高反应温度的方法加快反应速率;(2)操作Ⅰ是分离难溶于水的固体与可溶性液体物质的方法,名称是过滤;(3)将粉碎的锆英石与NaOH在高温下发生反应:ZrSiO4+4NaOHNa2ZrO3+Na2SiO3+2H2O;Al2O3+2NaOH===2NaAlO2+H2O;SiO2+2NaOH===2Na2SiO3+H2O;Fe2O3是碱性氧化物,不能与碱发生反应,所以水浸后过滤进入滤渣1中,Na2ZrO3、Na2SiO3、NaAlO2能溶于水,水浸、过滤进入滤液1中;(4)向滤液中加入足量盐酸,HCl会与Na2ZrO3、Na2SiO3、NaAlO2发生反应,生成NaCl、H2SiO3(或H4SiO4)、AlCl3、ZrCl4,其中H2SiO3(或H4SiO4)难溶于水,过滤时进入滤渣2中,其余进入滤液2中,因此滤渣2的成分为H2SiO3(或H4SiO4);向滤液2中加入氨水,发生复分解反应,调节溶液的pH至大于沉淀完全时Zr(OH)4的pH,而低于开始形成Al(OH)3沉淀的pH,即3.2p2,(4)①A.反应是在恒容的密闭容器内进行,由于该反应是气体体积减小的反应,若反应达到平衡,则容器内气体的压强保持不变,A正确;B.在任何时刻都存在:v正(H2)=2v正(CH3OH),若反应达到平衡v正(CH3OH)=v逆(CH3OH),则v正(H2)=2v逆(CH3OH),现在2v正(H2)=v逆(CH3OH),说明反应未处于平衡状态,B错误;C.由于该反应反应前后气体分子数不相等,若混合气体的相对分子质量保持不变,说明气体的物质的量不变,反应达到平衡状态,C正确;D.由于反应混合物都是气体,在任何状态下气体的质量不变,容器的容积不变,因此任何条件下,混合气体的密度都保持不变,故不能据此判断反应是否处于平衡状态,D错误;故合理选项是AC;
② 2H2(g)+CO(g)CH3OH(g)
n始(mol) 4 2 0
n10(mol) 2 1 1
n平(mol) 2 1 1
由于反应开始时气体的物质的量是6 mol,总压强为p0,则平衡时H2占分压为
,CO占分压为,CH3OH占分压为,带入平衡常数表达式Kp==(kPa)-2;③反应开始时H2占的分压为,10分钟时占分压为,减少了,所以v(H2)= kPa/min= kPa/min。
答案:(1)12H2O+O2+28e-===12H2 ↑+14O2- (2)-90.1 B (3)> 正反应为气体分子数减小的反应,加压平衡右移,CO的转化率增大,由图知相同温度时p1下CO的转化率大于p2,所以p1大于p2 (4)①AC ② ③
(二)选考题:共15分。请考生从2道化学题中任选一题作答。如果多做则按所做的第一题计分。
35.【化学——选修3:物质结构与性质】(15分)
N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________,基态铁原子的价电子排布图为________________________________________________________________________。
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N—N 键的键能为160 kJ/mol,而N2 的键能为942 kJ/mol,其可能潜在的应用是________________________________________________________________________。
(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N属于等电子体的一种分子__________(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是________(填标号)。
A.上述生成HN3的化学方程式为N2H4+HNO2===HN3+2H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图1所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为________(填最简整数比);已知该晶体的密度d g/cm3,阿伏加德罗常数的值为NA,则晶胞参数为________nm(用含d和NA的代数式表示)。
图 1 图 2
(5)一种铁、碳形成的间隙化合物的晶体结构如图2所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为________。
解析:(1)N为7号元素,基态N 原子的核外电子排布式是1s22s22p3;最高能级2p能级的电子云轮廓图形状为哑铃形(纺锤形);N原子的2p轨道电子处半充满状态,比较稳定,故N原子的第一电离能比O原子的大;Fe是26号元素,其原子核外有26个电子,其价电子排布式为3d64s2,故基态铁原子的价电子排布图为;(2)N原子的最外层有5个电子,可形成3个共价键,价层电子对个数=σ键个数+孤电子对个数=3+=4,氮原子的杂化轨道类型为sp3;这种高聚氮N—N 键的键能为160 kJ/mol,而N2的键能为942 kJ/mol,其可能潜在的应用是制炸药(或高能燃料);(3)①N有3个原子和16个价电子,故与N属于等电子体的分子有CO2或N2O;②氢叠氮酸(HN3) 可由肼(N2H4)被HNO2氧化制得,同时生成水。A.N2H4与HNO2反应生成HN3和水的化学方程式为N2H4+HNO2===HN3+2H2O,A正确;B.钠离子的半径小于钾离子,故NaN3的晶格能大于KN3的晶格能,B正确;C.氢叠氮酸(HN3)和水能形成分子间氢键,C正确;D.HN3是极性分子,N2H4是非极性分子,D不正确;E.HN3分子结构示意图为,靠近H原子的第1个N原子是sp2杂化,第二个N原子是sp杂化,端位的N原子不杂化,故四个原子不在一条直线上,E不正确。故选DE;(4)A含有1.5个亚铁离子、4个氧离子,B含有0.5个亚铁离子、4个氧离子、4个铁离子,则该氧化物中Fe2+、Fe3+、O2-的个数比为1∶2∶4。晶胞含有Fe2+、Fe3+、O2-的个数分别是为4、8、16,它们的相对质量之和是8×232,根据m=ρV可得8×232 g=d g/cm3×a3×NA,a=×107 nm;(5)根据均摊原则每个铁原子又为两个八面体共用,所以铁与碳原子数比是6×∶1=3∶1,则该化合物的化学式为Fe3C。
答案:(1)哑铃形(纺锤形) N原子的2p轨道电子处半充满状态,比较稳定 (2)sp3 制炸药(或高能燃料) (3)①CO2或N2O ②DE
(4) 1∶2∶4 a=×107 (5) Fe3C
36.【化学——选修5:有机化学基础】(15分)
某酯W是一种疗效明显的血管扩张剂,一种合成流程如下:
回答下列问题:
(1)E中含碳官能团的名称是________;C的名称是________。
(2)A→B反应条件和试剂是___________;C→D的反应类型是___________。
(3)写出W的结构简式为_____________________________。能测定H分子中所含化学键和官能团种类的仪器名称是____________。
(4)写出F→G的化学方程式为______________________________________________。
(5)R是E的同分异构体,R同时具备下列条件的结构有______种。
①遇氯化铁溶液发生显色反应;②能发生水解反应和银镜反应,其中,在核磁共振氢谱上有5组峰且峰的面积比为1∶1∶2∶2∶2的结构简式为______________________________。
(6)以乙醛为原料合成环酯,设计合成路线(其他试剂自选)________________________________________________________________________
________________________________________________________________________。